腺相关病毒载体在各种细胞株中的感染效率及表达特性研究*
周昆明 李峰生 俞庆华 周丁华 高 玲
稿 约
腺相关病毒载体在各种细胞株中的感染效率及表达特性研究*
周昆明①李峰生②*俞庆华③周丁华②高 玲④*
目的:研究腺相关病毒载体(AAV)感染各类正常细胞和肿瘤细胞的效率,为相关研究提供参考。方法:利用脂质体将重组腺相关病毒的包装质粒AAV-DJ、Helper以及表达绿色荧光蛋白(GFP)的穿梭质粒AAV-GFPP转染293FT细胞进行病毒包装,收集病毒液后感染2种正常细胞和14种肿瘤细胞,24 h后倒置荧光显微镜下观察GFP的表达,并随机选取3个视野统计感染GFP的细胞数目。结果:GFP重组腺相关病毒对各种细胞的感染效率存在差别,感染效率最高的为293FT细胞(占96.2%)和Hela细胞(占81.86%),对SCG7901、SEM-M和SP20细胞的感染效率近乎为零。结论:GFP重组腺相关病毒对正常细胞293FT感染效率最高,对肿瘤细胞Hela、SMC7721、BGC823、PANC-1、A549、A875、C6和MCF-7的感染效率较高,这类细胞适合使用AAV作为载体进行外源基因的导入及功能研究。
腺相关病毒载体;绿色荧光蛋白;正常细胞;肿瘤细胞;感染效率
DOI∶ 10.3969/J.ISSN.1672-8270.2015.07.001
[First-author’s address] Department of Hepatobiliary Surgery, The Second Artillery General Hospital of Chinense People's Liberation Army, Beijing 100088, China.
基因治疗是指将外源正常靶基因导入到靶细胞中,以纠正或补偿由于基因缺陷或异常导致的疾病,包括基因修正和基因置换,而基因载体的发展对基因治疗起了重要的推动作用[1]。在众多载体中,病毒载体因具有长期基因表达和较高的感染效率而广泛应用于基因治疗中,尤其是具有显著优势的腺病毒载体。
腺病毒载体是基因治疗中应用最为广泛的载体之一,在近期研制流行性埃博拉病毒疫苗中得到应用[2-3]。腺病毒载体以其较低的成本和本身所具有的特异性,使其成为高效的转染工具[4]。腺相关病毒载体(adenovirus-associated vector,AAV)是在腺病毒研究的制备工作中,电镜下发现的“病毒样”颗粒[5]。AAV宿主细胞具有多样性,如造血干细胞、神经细胞、上皮细胞及成肌细胞等。重组腺相关病毒载体(recombinant AAV,rAAV)具有非致病性、低免疫原性、特异性位点整合以及稳定表达目的基因等特性,使其在众多病毒载体中脱颖而出成为其中的佼佼者[6-7]。
AAV都具有不同的衣壳,从而将其进行分类,且衣壳使得AAV的趋性和转导特点各有不同[8-9]。本研究以绿色荧光蛋白(green fluorescent protein,GFP)为报告基因,利用荧光显微镜观察其感染效率,比较腺相关病毒对各型细胞的感染效率,探讨腺相关病毒对各类型细胞的亲和力,进一步为腺相关病毒用于基因治疗提供理论和实验依据。
1 材料与方法
1.1 试剂
①特级胎牛血清和DMEM培养基购于美国GIbco公司;②质粒小提试剂盒购自天根生化科技(北京)有限公司;③脂质体Lipofectamine2000和转染液opti-MEM均购自美国Invitrogen公司。
1.2 细胞培养及质粒
研究所用293人肾上皮细胞、Hacat人永生化表皮细胞、SMC7721肝癌细胞、HepG2肝癌细胞、PANC-1胰腺癌细胞、BGC823人胃癌细胞、SCG7901人胃癌细胞、A549人肺癌细胞、H1299人肺癌细胞、H322人非小细胞肺癌细胞、MCF-7乳腺癌细胞、Hela宫颈癌细胞、A875人黑色素瘤细胞、C6大鼠神经胶质瘤细胞、K562人白血病细胞以及SEM-M儿童B-细胞急性淋巴细胞白血病均购于北京协和医学院细胞库。细胞株用含有双抗的10%的DMEM培养基培养;AAV-DJ、Helper及AAV-GFP购自美国Addgene公司;感受态细胞(DH5α)购自天根生化科技(北京)有限公司。
1.3 质粒提取方法
取4 ml过夜培养的菌液,12 000 rpm离心1 min,吸除上清,加入250 μl溶液P1(已加入RNase A),彻底悬浮细菌沉淀;加入250 μl溶液P2,充分裂解菌体;加入350 μl溶液P3,充分混匀,直至出现白色絮状沉淀。12 000 rpm离心10 min,将上清液转移到吸附柱中(吸附柱放入收集管中),离心弃废液,加入600 μl漂洗液PW(已加入无水乙醇),洗涤吸附柱2遍并干燥;向吸附膜的中间部位滴加100 μl洗脱缓冲液EB,收集质粒于-4 ℃存放。
1.4 病毒包装方法
将293FT细胞接种于6孔板中,培养过夜。包装质粒AAV-DJ、Helper和穿梭质粒AAV-EGFP-Control总量4 μg按1∶1∶1的比例加入到150 μl的OPTIMEM,并加入4 μl的PlusTMLipofectamine®LTX,另用150 μl的OPTI-MEM稀释10 μl的Lipofectamine®LTX,将上述两种液体混合后混匀,在室温(25 ℃)静置15 min后加入6孔板的293FT细胞中。转染48 h后收集上清和细胞,反复冻融3次。10 000 rpm离心1 min,收集上清于-80 ℃存放。
1.5 感染与感染效率观察
(1)将细胞铺入48孔板中,加入培养基200 μl/孔,当24 h后细胞密度达到90%左右时,每孔加入病毒液100 μl;6 h后弃去病毒液的培养基,更换正常培养基。
(2)继续培养细胞48 h左右,在荧光显微镜下观察GFP蛋白表达并拍照,随机选取3个视野计数GFP细胞数目,计算其感染效率。
1.6 统计学方法
应用SPSS 16.0统计软件进行数据分析,计量资料结果以均值±标准差(x-±s)表示,两组之间的比较采用t检验分析,以P<0.05为差异有统计学意义。
2 结果
2.1 细胞株GFP感染效率观察
使用荧光显微镜观察GFP的表达,比较AAVGFP对各类细胞的感染效率,衡量AAV对细胞的不同感染效率(如图1所示)。
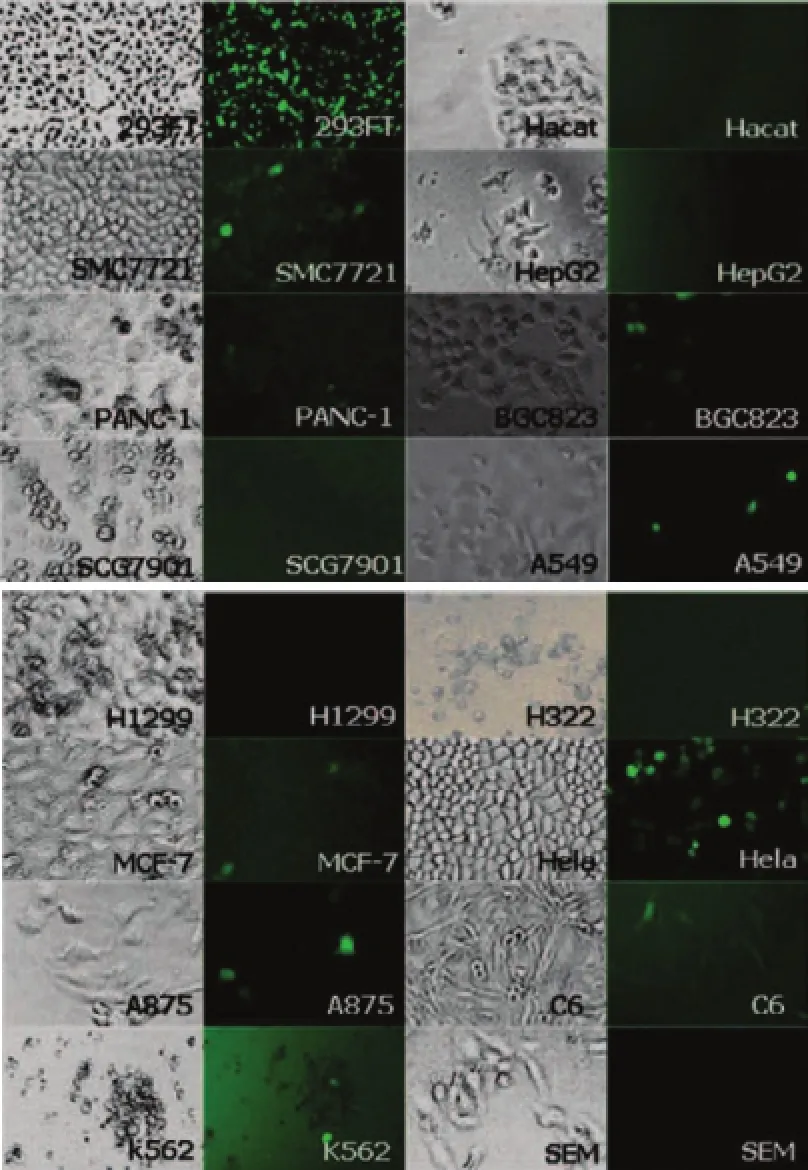
图1 AAV-GFP对正常细胞和肿瘤细胞的感染效率(10×10)
2.2 细胞株感染AAV-GFP效率统计学分析
随机选取3个视野,每个视野观察总数为500个细胞,计数表达GFP细胞的数目并计算感染效率,以293FT细胞为对照,分析AAV对各类细胞的感染效率,其细胞感染率比较,差异有统计学意义(见表1)。
3 讨论
分析结果显示,AAV-GFP对Hela和293FT细胞有很高的感染效率(>80%),对SMC7721、BGC823及Panc-1的感染效率较高(50%~79%),对HepG2、A549、A875、C6以及MCF-7的感染效率一般(30%~49%),对H322、H1299、Hacat及K562的感染效率较低(1%~30%),对SCG7901和SEM基本无感染效率(<1%)。

表1 各种细胞株感染AAV-GFP效率统计学分析(%)
腺病毒载体是基因治疗中一种安全有效的工具[10]。Atchison等[11]于1965年在腺病毒的制备中发现“病毒样”颗粒,并将其命名为腺相关病毒,并一直沿用至今。AAV以其低成本、高表达目的蛋白及安全性得到了研究者的青睐[12]。
在腺病毒载体介导的基因治疗中转染效率是关键[13]。本研究借助重组载体AAV-GFP包装成病毒对细胞进行转染后,直接在倒置显微镜下观察GFP表达量,以获得较为直观的结果。Sieger等[14]在其研究中用AAV载体对Hacat细胞的转染效率为8%,在Du等[15]所做的研究中AAV对HepG2的感染率为56.45%。另有研究显示,乳腺癌细胞MCF-7的转染效率为(41.52±3.16)%,K562的感染效率为(60±2)%[16-17]。
上述结果与本研究实验基本一致,腺相关病毒对不同细胞的感染效率存在差别,可能的因素很多,首先腺相关病毒的血清型不同导致其对特定的血清型细胞的感染效率较高[18]。不同类型的细胞株其血清型也不同,因此病毒与细胞的亲和性出现差别。除了对细胞的亲和性外,感染复数(multiplicity of infection,MOI)也会对感染效率有影响。MOI是指感染时病毒与细胞的比值,较高的MOI浓度会增加细胞毒性,使得细胞增值率和分泌功能下降[15]。同时,转染的时间也是影响转染效率的重要因素[19]。Aslanidi等[20]还发现,替换AAV病毒载体衣壳上的丝氨酸残基,尤其是改为缬氨酸时,转染效率大为增加。
本研究结果表明,GFP重组腺相关病毒对正常细胞293FT感染效率最高,对肿瘤细胞Hela、SMC7721、BGC823、PANC-1、A549、A875、C6和MCF-7的感染效率也较高,这类细胞适合使用AAV作为载体进行外源基因的导入及功能研究。
[1]Niidome T,Huang L.Gene therapy progress and prospects:nonviral vectors[J].Gene Ther, 2002,9(24):1674-1652.
[2]Chen H,Wang D,Xia R,et al.A novel adenoviral vector carrying an all-in-one Tet-On system with an autoregulatory loop for tight,inducible transgene expression[J].BMC Biotechnol,2015,15(1):4.
[3]Zhu FC,Hou LH,Li JX,et al.Safety and immunogenicity of a novel recombinant adenovirus type-5 vector-based Ebola vaccine in healthy adults in China:preliminary report of a randomised,double-blind,placebo-controlled,phase 1 trial[J].Lancet,2015,S0140-6736(15):60553-60560.
[4]Ayalew LE,Kumar P,Gaba A,et al.Bovine adenovirus-3 as a vaccine delivery vehicle[J]. Vaccine,2015,33(4):493-499.
[5]Hoggan MD,Blacklow NR,Rowe WP.Studies of small DNA viruses found in various adenovirus preparations:physical,biological,and immunological characteristics[J].Proc Natl Acad Sci USA,1966,55(6):1467-1474.
[6]陈阳,吕颖慧,李招发.腺相关病毒在帕金森病基因治疗研究中的应用进展[J].Acta Pharmaceutica Sinica,2014,49(5):576-581.
[7]Zhang D,Qiu F,Diao Y.Chemical modification of recombinant adenovirus-associated virus vectors[J].Bing Du Xue Bao,2013,29(5):566-572.
[8]Chakrabarty P,Rosario A,Cruz P,et al.Capsid serotype and timing of injection determines AAV transduction in the neonatal mice brain[J].PLoS One,2013,8(6):e67680.
[9]Ke J,Zheng LW,Cheung LK.Orthopaedic gene therapy using recombinant adeno-associated virus vectors[J].Arch Oral Biol,2011,56(7):619-628.
[10]Li XZ,Wang XH,Xia LJ,et al.Protective efficacy of recombinant canine adenovirus type-2 expressing TgROP18(CAV-2-ROP18)against acute and chronic Toxoplasma gondii infection in mice[J].BMC Infect Dis,2015,15(1):312-323.
[11]Atchison RW,Casto BC,Hammon WM. Adenovirus-associated defective virus particle[J].Science,1965,49:754-756.
[12]Zhu F,Liu M,Pan Y,et al.Adenovirus vectormediated short hairpin RNA targeting nuclear factor-kB suppresses proliferation of endometrial cells of Macaca fascicularis in vitro[J].Nan Fang Yi Ke Da Xue Xue Bao,2015,35(3):390-396.
[13]朴春姬,田梅,杨巍,等.携带人可溶性TRAIL基因重组腺病毒在肺癌细胞中的转染效率及表达特性研究[J].中国实验诊断学,2010,10(14):1515-1518.
[14]Sieger S,Jianq S,Kleinschmidt J,et al.Tumorspecific gene expression using regulatory elements of the glucose transporter isoform 1 gene[J].Cancer Gene Ther,2004,11(1):41-51.
[15]Du WZ,Yu TX.Generation of antitumor response against hepatocellular carcinoma by in vitro transduction of dendritic cells with adenoassociated virus expressing α-fetoprotein[J]. Zhonghua Yi Xue Za Zhi,2011,91(29):2077-2080.
[16]Veldwijk MR,Fruehauf S,Schiedlmeier B,et al. Differential expression of a recombinant adenoassociated virus 2 vector in human CD34+cells and breast cancer cells[J].Cancer Gene Ther,2000,7(4):597-604.
[17]Stiefelhagen M,Sellner L,Kleinschmidt JA,et al. Application of a haematopoetic progenitor celltargeted adeno-associated viral(AAV)vector established by selection of an AAV random peptide library on a leukaemia cell line[J].Genet Vaccines Ther,2008,12(6):12.
[18]Burger C,Gorbatyuk OS,Velardo MJ,et al. Recombinant AAV viral vectors pseudotyped with viral capsids from serotypes 1,2,and 5 display differential efficiency and cell tropism after delivery to different regions of the central nervous system[J].Mol Ther,2004,10(2):302-317.
[19]Liu C,Miao L,Sun W,et al.Assessment of transfection of AdCMV-EGFP to rat submandibular gland cells[J].Cell Biochem Biophys,2015,71(1):147-153.
[20]Aslanidi GV,River AE,Oriz L,et al.Highefficiency transduction of human monocytederived dendritic cells by capsid-modified recombinant AAV2 vectors[J].Vaccine,2012, 30(26):3908-3917.
Study on transfection efficiency and expression of recombinant adeno-associated virus in kinds of cell lines
ZHOU Kun-ming, LI Feng-sheng, YU Qing-hua, et al
China Medical Equipment,2015,12(7)∶1-4.
Objective∶ To Study on transfection effection and expression of recombinant adenoassociated virus in kinds of cell lines. Methods∶ Packaging 293FT cells with the packaging plasmids AAV-DJ, Helper, and shuttle plasmids, AAV-GFP of recombined adeno-associated virus by liposome. Collect the solution of virus and infect 2 normal cells and 15 kinds of cancer cells. 24hours after infection, the efficacy of adenoviral transfered into kinds of cells was assessed by quantification of GFP-positive cells under an inverted fluorescence microscope. Count cells in 3 random sights under microscope. Results∶The efficiency of GFP recombinant adeno-associated virus is various in these kinds of cells. The highest efficiency shows in 293FT cells and Hela cells, 96.2% and 81.86%. Conversely the efficiency is approximately 0 in SCG, SEM-M, SP20 cells. Conclusion∶ Due to the high and relatively high transfection efficiency of the AAV-GFP in normal cells, 293FT, and cancer cells, Hela, SMC7721, BGC823, Panc-1, A549, A875, C6, MCF-7, it is available to do some genetic therapy researh using AAV as a vector.
Adeno-associated virus; Green fluorescent protein; Normal cells; Cancer cells; Transfection efficiency
1672-8270(2015)07-0001-04
R446.113
A
周昆明,男,(1987- ),硕士研究生。辽宁医学院第二炮兵总医院研究生培养基地,研究方向:肝胆胰外科学。
2015-04-14
国家自然基金科学部主任基金(31340051)“腺病毒Ad-pig3RRP-PIAS3对辐射诱导肺腺癌细胞转移的抑制作用及其机制研究”;国家自然科学基金青年科学基金(81202151)“低剂量辐射对树突状细胞迁移能力的影响及其分子机制研究”;国家自然科学基金青年科学基金(81001216)“NOK激酶促进肿瘤细胞周期进程及提高肿瘤细胞辐射敏感性分子机制研究”;全军医学科技“十二五”科研项目(CWS12J082)“快速PCC-FISH方法作为辐射生物剂量计的研究”;中国疾病预防控制中心青年科研基金(2015A201)“利用负载lewis细胞的小鼠模型评价低剂量辐射对机体抗肿瘤免疫功能的影响”
①辽宁医学院第二炮兵总医院研究生培养基地 北京 100088
②第二炮兵总医院 北京 100088
③解放军第307医院胸外科 北京 100071
④中国疾病预防控制中心辐射防护与核医学安全所 辐射防护与核应急中国疾病预防控制中心重点实验室 北京 100088
*通讯作者:gaoling@nirp.cn;lifs0624@163.com

