响应面法优化植物乳杆菌产β-半乳糖苷酶发酵培养基
高晓峰,周颖,李柏良,周晶,霍贵成
(东北农业大学乳品科学教育部重点实验室,哈尔滨150030)
0 引言
β-半乳糖苷酶广泛来源于植物、动物、微生物中。其中微生物来源的β-半乳糖苷酶具有高活性及高稳定性的优点,因而在工业中得到广泛应用[1]。该酶通过其水解活性可以克服乳糖不耐症;通过转糖基作用生成益生元—低聚半乳糖[2]。
乳酸菌是公认安全(GRAS)的食品级微生物,因此,乳酸菌来源的酶可以不需进行大量的纯化而在各种食品工业中应用[3]。目前乳酸菌中嗜酸乳杆菌[4]、保加利亚杆菌[5]、短乳杆菌[6]等β-半乳糖苷酶的研究较多,而对植物乳杆菌β-半乳糖苷酶的研究相对较少。植物乳杆菌具有耐胆盐,免疫调节等益生功能[7]。本研究采用响应面法对植物乳杆菌产β-半乳糖苷酶的培养基进行优化,以提高β-半乳糖苷酶的产量,为菌株进一步工业化生产奠定理论基础。
1 实验
1.1 材料与试剂
植物乳杆菌KLDS1.0628,邻硝基苯酚-β-D-半乳糖苷(ONPG),邻硝基酚(ONP),其他试剂均为市售国产分析纯或化学纯。
种子培养基:蛋白胨10 g,牛肉膏10 g,酵母粉5 g,乳糖20 g,柠檬酸氢二铵2 g,硫酸镁0.58 g,硫酸锰0.25 g,乙酸钠0.5 g,磷酸氢二钾2 g,吐温-80 1 g,定容至1 000 mL,pH自然,121℃灭菌15 min。发酵培养基 蛋白胨10 g,酵母粉5 g,乳糖20 g,柠檬酸氢二铵2 g,硫酸镁0.58 g,硫酸锰0.25 g,乙酸钠0.5 g,磷酸氢二钾2 g,吐温-80 1 g,定容至1 000 mL,调pH为6.0,121 ℃灭菌15 min
1.2 仪器与设备
GL-21M冷冻离心机,DU800紫外/可见光分光光度计,Delta 320 pH计,DHP-9272型电热恒温培养箱,JY96-IIN超声波细胞粉碎机。
1.3 方法
1.3.1 粗酶液制备
将植物乳杆菌在种子培养基中活化3代,按体积分数为1%的接种量接种于发酵培养基中,37℃静置培养24 h,以8 000 r/min(10 min)、4 ℃条件离心菌体,去上清,取等体积磷酸钠缓冲液重悬菌体,以8 000 r/min(10 min)、4℃条件离心菌体,去上清,完成一次菌泥的洗涤;重复洗涤三次,获得的菌泥在冰水浴中进行超声波破碎,工作1 s,间歇2 s,破碎时间15 min,将裂解后的菌液于4℃、12 000 r/min离心10 min,收集上清液,即为粗酶液。
1.3.2 酶活力测定
向试管中加入2.5 mL,pH值为7.0浓度为50 mmol/L的磷酸氢二钠/磷酸二氢钠缓冲液,加入100 μL质量浓度为4 mg/mL(ONPG)溶液和100 μL酶液,40℃恒温反应10 min后加入0.3 mL浓度为1 mol/L的Na2CO3溶液中止反应,于420 nm下测定吸光度。采用国际酶活单位:1 mL酶液1 min催化邻硝基苯酚-β-D-半乳糖苷(ONPG)水解生成1 μmol邻硝基酚(ONP)定义为一个酶活单位。用己知浓度ONP溶液做标准曲线,根据ONP的浓度c对应的OD值,利用最小二乘法建回归方程:OD=4.4984c-0.0045 R2=0.9996。酶活计算公式为
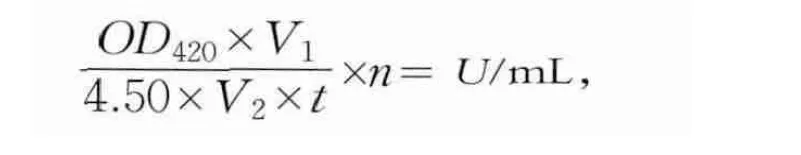
式中:V1为反应混合液总体积(mL);4.50为在实验条件下1 μmol/mL的ONP吸光度;t为反应时间(min);V2为酶液体积(mL);n为稀释倍数。
1.3.3 不同碳源对植物乳杆菌产β-半乳糖苷酶活力的影响
以发酵培养基为对照,选择葡萄糖、葡萄糖与乳糖质量比1:1的混合糖、麦芽糖、蔗糖、半乳糖替代发酵培养基中的乳糖,质量分数都为2%,调初始pH值为6.0。按1%接种量接种种子液于发酵培养基中,培养温度37℃,置于恒温箱内静置培养24 h,测定β-半乳糖苷酶酶活力。
1.3.4 不同氮源对植物乳杆菌产β-半乳糖苷酶活力的影响
以发酵培养基为对照,选择蛋白胨、酵母粉、酪蛋白胨、胰蛋白胨、牛肉膏、大豆蛋白胨替代发酵培养基中的氮源(即蛋白胨、酵母粉),质量分数都为1.5%,调初始pH值为6.0。按1%接种量接种种子液于发酵培养基中,培养温度37℃,置于恒温箱内静置培养24 h,测定β-半乳糖苷酶酶活力。
1.3.5 对植物乳杆菌产酶活力影响
本研究对影响产酶活力的9个因素进行筛选,9个因素包括:乳糖、酵母粉、蛋白胨、磷酸氢二钾、柠檬酸氢二铵、乙酸钠、吐温-80、硫酸镁、硫酸锰(均为质量分数)。每个变量分别设定高(+1)和低(-1)两个水平,实验因素水平如表1所示。按照Plackett-Burman设计对数据进行分析,得到影响酶活的最主要因素。
1.3.6 最陡爬坡实验
根据Plackett-Burman试验结果分析确定主要影响因素,以拟合的回归方程模型的系数符号和大小来设定主要因素的步长和变化方向,即对主要因素进行质量浓度梯度设计,能快速、经济地逼近最佳值区域。
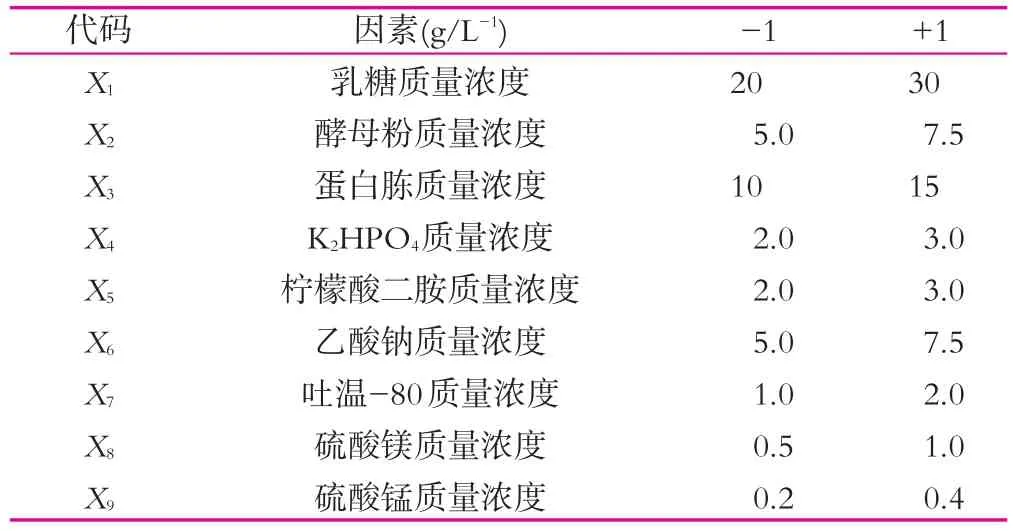
表1 Plackett-Burman实验设计参数与水平
1.3.7 中心组合试验设计(BBD)
以最坡爬坡设计得出的实验结果为依据确定Box-Behnken实验设计的中心点和步长,结果如表2所示。响应值为β-半乳糖苷酶活,主要影响因素为自变量,利用 Design-Expert实验软件进行Box-Behnken实验设计和数据的分析。

表2 BBD实验因素及水平
2 结果与分析
2.1 不同碳源的影响
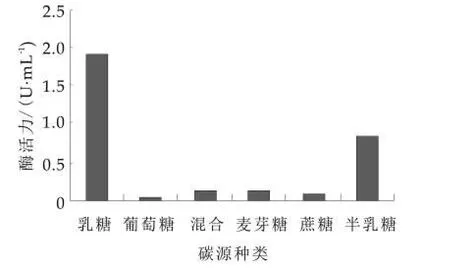
图1 碳源对β-半乳糖苷酶活力的影响
由图1可以看出,该菌以乳糖为唯一碳源时,β-半乳糖苷酶酶活最高,而当乳糖和葡萄糖共同作为碳源时,酶活明显降低,说明该菌株生物合成的β-半乳糖苷酶受乳糖操纵子的调控,是诱导酶,与已报道的乳糖对双歧杆菌[8]和嗜酸乳杆菌[9]影响一致。而Kim和Rajagopal研究发现半乳糖比乳糖对卷曲乳杆菌产β-半乳糖苷酶具有更强的诱导作用[10],宋园亮等研究发现以葡萄糖作为碳源时,短乳杆菌产β-半乳糖苷酶活性最高[6]。由此可见,不同碳源对产酶的影响因菌株的变化而不同。
2.2 不同氮源的影响

图2 氮源对β-半乳糖苷酶活力的影响
由图2可知,该菌采用唯一氮源时,6种氮源中酵母粉效果最好。但其酶活低于以蛋白胨和酵母粉为混合氮源的对照组,此时菌体所产酶的酶活为最大,说明蛋白胨和酵母粉这两种氮源中的某些成分具有一定的协同作用。因此选取蛋白胨和酵母粉混合氮源作为培养植物乳杆菌KLDS1.0628的氮源。
2.3 重要因素筛选实验
Plackett-Burman实验设计及结果如表3所示,实验的回归分析如表4所示。

表3 Plackett-Burman实验设计及结果

表4 Plackett-Burman实验的回归分析
由表4可以看出,9种培养基成分对植物乳杆菌产β-半乳糖苷酶影响的显著性排列为:乳糖>乙酸钠>柠檬酸氢二铵>吐温80>酵母粉>K2HPO4>硫酸锰>蛋白胨>硫酸镁。其中,乳糖、乙酸钠、柠檬酸氢二铵影响最为显著,可作为进一步优化的因素。
2.4 最陡爬坡实验设计及结果
根据Plackett-Burman试验结果设计,按一定的梯度改变乳糖、柠檬酸氢二铵和乙酸钠在发酵培养基中的浓度,柠檬酸氢二铵和乙酸钠是正效应,应依次增大;乳糖是负效应,应依次减小;其他非主要因素根据表4中的估计系数的正负取Plackett-Burman设计中的最大值或最小值,实验设计及结果如表5所示。

表5 最陡爬坡试验设计及结果
结果表明,随着乳糖浓度逐渐减小,柠檬酸氢二铵和乙酸钠浓度逐渐增大,酶活呈现先增大后减小的变化。当乳糖质量浓度为15 g/L,柠檬酸氢二铵为5.0 g/L,乙酸钠为10 g/L时,酶活达到最大。因此以实验编号3各因素水平为中心值设计后续响应面实验。
2.5 Box-Benhnken试验设计与响应面分析
以β-半乳糖苷酶活力为响应值Y,选取乳糖A、柠檬酸氢二铵B、乙酸钠C三个因素进行设计,Box-Benhnken试验设计及结果如表6所示。

表6 响应面试验设计方案及结果
根据试验结果,采用逐步回归的方法进行二次回归分析,得到相应的回归方程式为Y=3.28+0.21A+0.20B+0.083C-0.023AB+0.048AC-0.12BC-0.20A2-0.11B2-0.20C2。对回归模型进行方差分析,结果表明:该方程回归显著,模型的R2值为0.9425,说明回归方程的拟合程度良好,失拟项为0.0984,大于0.05,因此回归模型适合,不需对回归议程调整[11]。
构建β-半乳糖苷酶活与发酵培养组分乳糖、乙酸钠、柠檬酸氢二铵的三维空间响应面图,结果如图3~图5所示。

表7 回归模型方差分析

图3 乳糖与柠檬酸氢二铵对β-半乳糖苷酶活力的影响
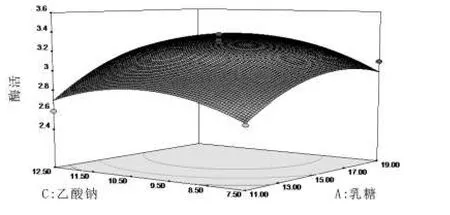
图4 乳糖与乙酸钠对β-半乳糖苷酶活力的影响

图5 乙酸钠与柠檬酸氢二铵对β-半乳糖苷酶活力的影响
图3~图5直观地反映了各因素交互作用对β-半乳糖苷酶的影响。比较三组图可知,乳糖和乙酸钠对β-半乳糖苷酶活力的影响比柠檬酸氢二铵对β-半乳糖苷酶活力的影响更为显著。根据Design-Expert软件得到的回归方程可计算得到Y的最大估计值为3.40 U/mL,此时乳糖 16.41 g/L,乙酸钠 10.21 g/L,柠檬酸氢二铵5.83 g/L。
2.6 验证实验
为检验响应曲面法所得结果的可靠性,采用上述优化发酵培养基进行验证实验,重复3次,测得的酶活平均值为3.32 U/mL,与理论预测值3.40 U/mL基本一致,因此,基于响应曲面法所得的β-半乳糖苷酶发酵培养基参数准确可靠。
3 结论
在发酵培养基的优化试验中,首先采用单因素试验对植物乳杆菌KLDS1.0628产β-半乳糖苷酶的最佳碳源、氮源进行优化,得到最佳碳源为乳糖,最佳氮源为蛋白胨和酵母粉。而Duraiswamy Gobinath研究发现半乳糖为碳源时,Lactobacillus plantarum MCC2156产β-半乳糖苷酶活性最高[12]。以乳糖为最佳碳源说明其具有利用工业废料乳清的潜力,从而降低β-半乳糖苷酶生产成本。通过Plackett-Burman试验筛选出对酶活影响主要的3个因素即乳糖、柠檬酸氢二铵、乙酸钠,然后以最陡爬坡试验结果为中心点,利用Box-Benhnken试验设计并进行响应面分析,优化得出植物乳杆菌KLDS1.0628发酵最佳质量浓度分别为:乳糖16.41 g/L,乙酸钠10.21 g/L,柠檬酸氢二铵5.83 g/L,利用该培养基发酵培养,测得的酶活平均值为3.32 U/mL,与理论预测值3.40 U/mL基本一致,酶活比优化前提高了73.8%。
[1]PARK A R,OH D K.Galacto-oligosaccharide production using microbial β -galactosidase:Current state and perspectives,[J].Applied Microbiology and Biotechnology,2010,85(5):1279-1286.
[2]RYCROFT,CE,JONES,MR,GIBSON,A comparative in vitro evaluation of the fermentation properties of prebiotic oligosaccharides.[J]Appl.Microbiol,2001,91:878-887.
[3]VASILJEVIC,T.;JELEN,P.Lactose hydrolysis in milk as affected by neutralizers used for the preparation of crude β-galactosidase extracts from Lactobacillus bulgaricus 11842[J].Innovative Food Science&Emerging Technologies,2002,3(2):175-184
[4]HUZAIFA S.CHOONIA,LELE S S,Three phase partitioning of β-galactosidase produced by an indigenous Lactobacillus acidophilus isolate[J].Separation and Purification Technology,2013,104(01):44-50.
[5]MOEZ RHIMI,NUSHIN AGHAJARIB.Exploring the acid tolerance of β -galactosidase from Lactobacillus delbrueckii subsp.Bulgaricus:an attractive enzyme for lactose bioconversion[J].Research in Microbiology,2009,160(10):775-784.
[6]宋园亮,殷建忠等.云南传统发酵豆豉中产β-半乳糖苷酶乳酸菌的筛选及其产酶条件的研究[J].Chinese Journal of Microecology,2011,23(5):398-403
[7]郭本恒,益生菌[M].北京:化学工业出版社,2004:415-422.
[8]HSU,CA,YU,R C,CHOU,C.C.Production of β-galactosidase by Bifidobacteria as influenced by various culture conditions.[J].International Journal of Food Microbiology,2005,104(2):197-206.
[9]AKOLKAR,S K,SAJGURE,A,LELE,S.S.Lactase production from Lactobacillus acidophilus.[J].World Journal of Microbiology and Biotechnology,2005,21(6):1119-1122.
[10]KIM,J W,RAJAGOPAL,S.N.Isolation and characterization of β-galactosidase from Lactobacillus crispatus.[J].Folia Microbiologica,2000,45(1):29-34.
[11]左爱连,张伟国.利用Design-Expert软件优化丝氨酸羟甲基转移酶产酶培养基[J].生物技术,2008,18(3):45-49.
[12]DURAISWAMY GOBINATH,Permeabilized probiotic Lactobacillus plantarum as a source of β-galactosidase for the synthesis of prebiotic galactooligosaccharides.[J].Biotechnol Lett 2014,36(1):153-157.

