益生菌在婴幼儿配方奶粉中稳定性的研究
刘晓雪,曹美丽,王雪飞
(黑龙江东方学院,哈尔滨150086)
0 引言
益生菌是指摄入后通过改善宿主肠道菌群的生态平衡而发挥有益作用,达到提高人和动物健康状态的活菌制剂及其代谢产物。目前应用于婴幼儿奶粉中的益生菌一般为双歧杆菌和乳杆菌两种类型[1-4]。国家卫生部要求只能添加菌种A、菌种B、菌种C和菌种D、菌种E、菌种F这6种菌种[5-6]。菌种A在食品中稳定性良好,能保证产品达到规定的活菌数量。菌种B是目前应用最广泛的益生菌,活菌数在长时间内略有减少,能适应胃酸环境。菌种C和菌种D可以提高机体免疫力、调节菌群的平衡[7-8]。
本文通过加速实验,研究添加益生菌的婴儿配方粉在不同环境条件下益生菌活菌数随时间的变化规律,以掌握益生菌奶粉的稳定趋势。
1 实验
1.1 材料
基粉:市售婴幼儿配方奶粉:一段(水分质量分数为2.26%±0.05%);二段(水分质量分数为2.47%±0.05%);三段(水分质量分数为2.49%±0.05%)。
益生菌:菌种A,菌种B,菌种C和菌种D
1.2 仪器与设备
BT 224 S分析天平;CLIMACELL人工气候箱;Systec VX高压灭菌器;Bag Mixer 400均质机;CLASS II A2生物安全柜;HWS-100G恒温恒湿箱;Transferpette S移液枪;YQX生化培养箱;V20三维V型混料机。
1.3 方法
1.3.1 益生菌配方粉的生产工艺
采用干混法向婴儿配方粉中添加益生菌。
每种菌株以现有的生产工艺生产并检测各个生产阶段益生菌的存活数量,同一批次同一水分活度的基粉每份做三个平行样。
(1)预混料。在进行预混料时添加益生菌,预混料时间为20 min,混料间的温度为25℃,湿度为50%,采用三维“V”型混料机。干混后检测益生菌存活量。
(2)混料。预混料之后,经传送带送至混料间混料,混料时间为3 min,混料目的是保证基粉与营养素充分混匀。
(3)包装。混料之后,奶粉进入包装车间,奶粉依次经过罐装(罐装采取铁罐充氮气罐装)、充氮、金属检测,产品合格后,取样进行活菌检测。
(4)贮藏。将合格样品做稳定性试验,稳定性试验存放条件根据菌种加速试验结果而定,相对湿度不高于70%~85%为准,定期检测模拟货架期下益生菌的存活量[9]。
1.3.2 加速温度的确定
以菌种A作为预实验菌种,将该菌种与配比好的基粉和营养素混料,罐装,将样品分别置于60,45,37,25℃等4个不同温度下进行加速试验,并且定期检测样品中益生菌的活菌量。
1.3.3 不同益生菌稳定性的确定
以一段、二段、三段奶粉作为基粉,向其中分别加入菌种A,菌种B,菌种C,菌种D,将4种益生菌在37℃存放两个月,测定其活菌量,评价其加速试验条件下,储存时间对益生菌稳定性的影响[10-11]。
益生菌活菌量的检测采用GB 478935-2010中的方法进行[12]。
2 结果与讨论
2.1 加速温度的选择
温度是影响益生菌奶粉稳定性的重要因素,不管是在生产、运输还是服用时都要注意温度的控制,温度过高容易导致益生菌死亡,有研究表明,乳酸菌在37℃生长良好,在80℃高温条件下5 min其活菌量将减少70%~80%[13-14]。针对温度对益生菌的影响程艳薇等人曾将嗜酸乳杆菌高温驯化,驯化后的嗜酸乳杆菌可以在45℃高温条件下生长[15]。
温度对益生菌稳定性的影响,加速试验设计以菌种A作为试验添加菌种,在加速试验温度分别为60,45,37,25℃条件下,以益生菌的活菌量为指标进行研究并做图,如图1~图4所示。
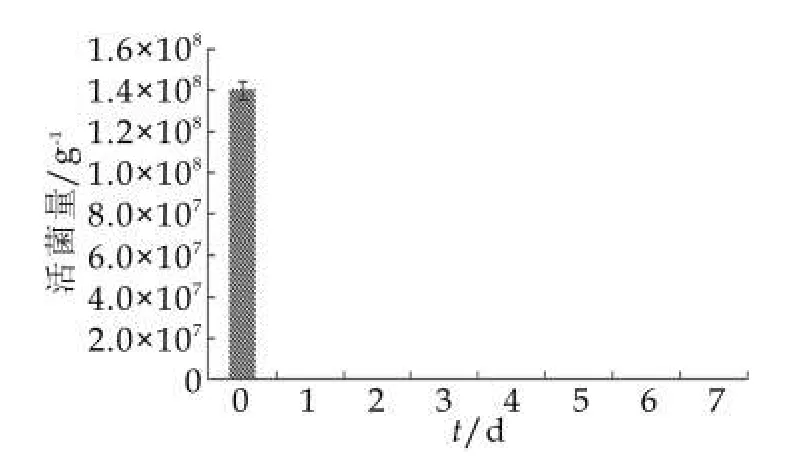
图1 60℃加速试验下的菌种A活菌量
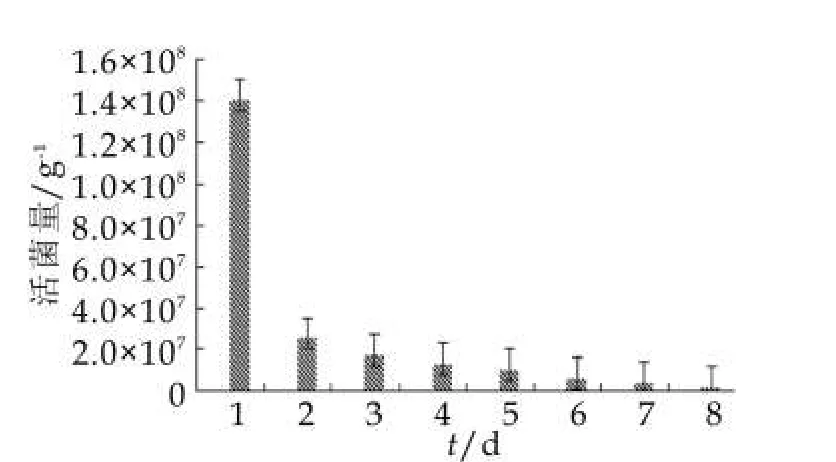
图2 45℃加速试验下的菌种A活菌量
益生菌加速试验是指在保证不改变益生菌产品失效机理的前提下,通过强化温度试验条件,使受试益生菌加速失效,以便在较短时间内获得必要益生菌稳定性,来评估益生菌在正常条件下的可靠性或寿命指标。
由图1可以看出,益生菌在60℃时,样品在第2天检测菌种A的量就由当天的1.40×108g-1下降小于100 g-1,菌种活菌量下降迅速,由于益生菌的活性随着储存温度升高而不断死亡,使奶粉中中益生菌活力丧失,所以60℃不适合做为加速试验的加速温度。
由图2可以看出,样品在45℃条件下存放时,菌种A的活菌量下降明显,样品在第2天检测菌种A的含量就由当天的1.40×108g-1下降为2.0×107g-1。说明菌株死亡速度较快,因此45℃不利于进行菌株间稳定性的比较,不宜作为加速实验的实验温度。

图3 37℃加速实验下的菌种A活菌量

图4 25℃加速实验下的菌种A活菌量
由图3可以看出,益生菌在37℃贮存期间,菌种A的活菌量含量从当天的1.40×108g-1下降到到第35天的4.40×107g-1。在35 d内出现活菌量的降低,同时这种降低趋势明显,符合加速实验的要求,利于进行后续的实验分析。
由图4可以看出,在25℃储存条件下,益生菌菌株长时间活菌量没有明显的降低,从实验的初始到第105天活菌量由1.40×108g-1只下降到1.2×108g-1,菌含量变化趋势并不明显,不符合加速试验的目的,在短时间内不能很快检测菌株的稳定性。
综合考虑各种加速试验的条件,温度为37℃较为合理,试验时间不会太长而且还能看到菌株明显的衰减,可快速判断不同菌株的稳定性。
2.2 益生菌在婴儿配方粉储存过程中的稳定性变化
2.2.1 菌种A储存稳定性的变化
在37℃加速实验条件下,菌种A储存两个月内活菌量的变化如图5所示。
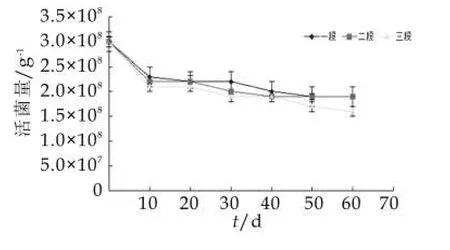
图5 37℃储存条件下菌种A活菌量的变化

图6 37℃储存条件下菌种B活菌量的变化
由图5可以看出,一段、二段和二段奶粉中菌种A在37℃的加速实验中10 d内都出现了活菌量明显的降低。一段奶粉中菌种A由投料量的3.0×108g-1在10 d内降到了2.3×108g-1,随后活菌量处于缓慢降低的趋势,总体变化平稳,在保存了60 d时活菌量仍高达1.9×108g-1,表现了比较好的稳定性。二段奶粉中菌种A的活菌量10 d内由2.2×108g-1降到了2.1×108g-1,在随后的保存时间里比一段中菌种A的活菌量下降稍快些,但在保存的第60天两段中活菌量一致,菌种稳定性良好。三段奶粉中菌种A的活菌量10 d内较一、二段中活菌量下降明显从3.0×108g-1降到了2.1×108g-1,后期的活菌量也呈现了明显的下降趋势,60 d时,活菌量降到了1.6×108g-1,比一、二段奶粉中的活菌量下降明显,说明奶粉水分质量分数的不同对菌种A的存活有影响。从一段到三段水分活度越来越高,水分活度越高越不利于益生菌保持其稳定性,水分活度越低益生菌活菌量降低的越慢,有利于保持其稳定性[16]。
总体来看菌种A在加速试验中表现了良好的稳定性。
2.2.2 菌种B储存稳定性的变化
在37℃加速实验条件下,菌种B储存两个月内活菌量的变化如图6所示。由图6可以看出,菌种B在37℃储存初期活菌量的减少较明显,储存10 d之后总菌量缓慢降低,且三个不同水分含量奶粉中菌种B的活菌量变化各不相同,一段乳粉中菌种B的活菌量十天内由6.2×108g-1下降到4.6×108g-1,随后缓慢下降,在第60天时活菌量降到3.5×108g-1,活菌量减少了近1/2。二段乳粉中活菌量10 d内由6.2×108g-1下降到4.1×108g-1,较一段下降的明显,在随后的加速试验中活菌量呈现缓慢的下降趋势,在第60天降低到3.3×108g-1,总体比一段中的活菌量下降明显。三段奶粉中活菌量由开始的6.2×108g-1在第十天下降到3.8×108g-1,总体呈现下降趋势,在第60天降到2.8×108g-1比一、二段奶粉中的活菌量下降的更明显。三个不同段的奶粉中活菌量的降低具有显著性(P<0.05),说明菌种B对水分活度较敏感,总体来说,菌种B的稳定性还是比较理想的,可以考虑作为益生菌奶粉的备选菌株,适合在水分活度较低的乳粉中添加。
2.2.3 菌种C储存稳定性的变化
在37℃加速试验条件下,菌种C储存两个月内活菌量的变化如图7所示。

图7 37℃储存条件下菌种C活菌量的变化
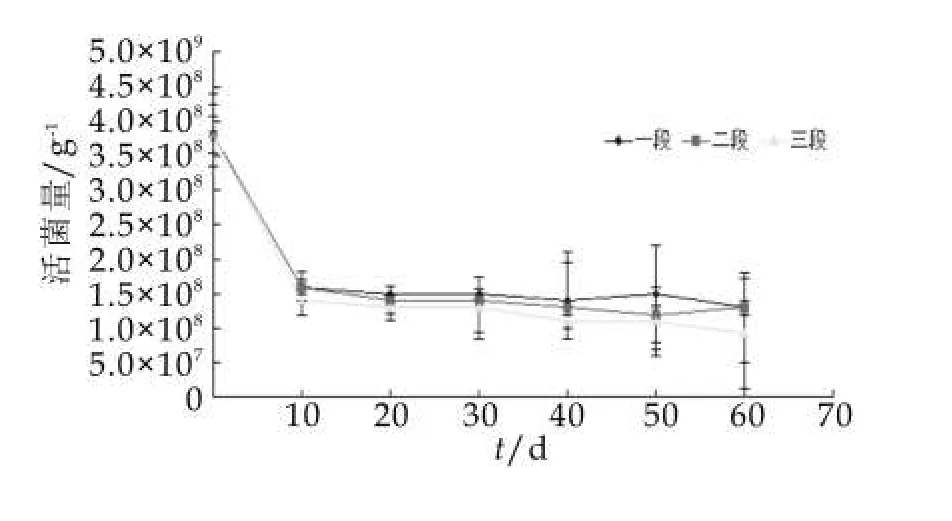
图8 37℃储存条件下菌种D活菌量的变化
由图7可以看出,菌种C在37℃加速试验的储存条件下,衰亡非常迅速,投料的活菌量在4.0×108g-1,但活菌量在30 d内呈现明显的下降趋势,当储存至30 d时活菌量下降到1.0×106g-1以下,说明此菌种在婴儿配方粉中的稳定性不佳,不适合添加到乳粉中。
2.2.4 菌种D储存稳定性的变化
在37℃加速试验条件下,菌种D储存两个月内活菌量的变化如图8所示。由图8可以看出,一、二、三段奶粉中菌种D益生菌在加速实验的前10 d活菌量下降的非常快,一、二段奶粉中的活菌量由开始的3.8×108g-1降到1.6×108g-1,三段奶粉中的活菌量由3.8×108g-1降到1.4×108g-1,在随后的实验过程中一二段奶粉中的益生菌活菌量下降程度基本相同,在第60天时都降到了1.3×108g-1,但是三段奶粉中活菌量降到了9.2×107g-1,较一二段奶粉中的益生菌衰亡的较快。说明实验初期菌种D受外界影响比较明显,菌种失活快,但后期活菌量较稳定。因此建议在适当加大投料量菌种D还是可以作为备选菌株添加在奶粉中,但是具体生产还要考虑到成本问题。
3 结论
益生菌作为营养添加剂到婴幼儿奶粉中,其加速试验结果表明最适温度为37℃,实验时间不会太长而且还能看到菌株明显的衰减,可快速判断不同菌株的稳定性。
本研究筛选了4种益生菌添加到婴儿配方粉中,结果表明在37℃存放两个月,菌种A稳定性最好,除加速试验外,在常温存放了5个月奶粉中活菌量由投料量的3.0×108g-1衰减到2.7×108g-1,活菌量几乎没有衰减,在加速实验5个月后,活菌量只降到添加时活菌量的1/2;其次比较稳定的是菌种B和菌种D,这两种菌株在加速试验两个月后活菌量衰减到添加时的1/2;而相比较菌种C较差。因此,菌种A具有较好的稳定性,更适宜于作为益生菌添加到婴幼儿乳粉中。
[1]郭本恒.益生菌[M].北京:化学工业出版社,2004:29-37,74-84.
[2]许飞利,李志刚,付萍.益生菌生理作用的最新进展[J].卫生研究,2011,40(3):277-278.
[3]田洪涛,张篪,王占武,等.影响双歧杆菌微生态制剂菌体存活的因素[J].中国乳品工业,2000,28(1):23-25.
[4]SAZAWAL S,HIREMATH G,DHINGRA U,et al.Efficacy of probiotics in prevention of acute diarrhoea:a meta-analysis of masked,randomised,placebo-controlled trials[J].Lancet Infect Dis,2006,6(6):374-382.
[5]刘艳芳.婴幼儿益生菌配方粉在中国市场占有率已近两成.中国食品报,2013(006).
[6]关于公布可用于婴儿食品的菌种名单的公告.中华人民共和国国家卫生和计划生育委员会,2011.
[7]LEYER G J,LI S G,MUBASHER M E,et al.Probiotic Effects on Cold and Influenza-Like SymptomI in Children[J].PEDIATRICS,2009,124(2):e172-e179.
[8]GILL H S,RUTHERFURD K J,CROSS M L,et al.Enhancement of immunity in the elderly by dietary supplementation with the probiotic Bifidobacterium lactis HN019[J].The American Journal of Clinical Nutrition,2001,74(6):6833-6839.
[9]梁燕,安颖,靳烨,等.益生菌奶粉货架期预测加速试验影响因素的研究[J].食品科技,2009,34(11):39-43.
[10]高保军,王占东,吕文君,等.不同益生菌株在奶粉中存活的研究[J].食品工业科技,2005(01):85-88.
[11]成妮妮.提高益生菌食品中活菌含量的方法[J].食品研究与开发,2003,24(5):92-94.
[12]GB4789.34/35.食品安全国家标准,食品微生物学检验,菌落总数测定.2010.
[13]张岩春,潘丽娜.婴幼儿奶粉中益生菌在不同温度下活菌数的变化[J].农产品加工,2013,9(329):70-72。
[14]张和平,张勇.世界益生菌及相关产品的立法和管理[J].中国食品学报,2009,10(5):1-6.
[15]程艳薇,刘春梅,谭书明.嗜酸乳杆菌菌粉的加工技术研究[J].食品科技,2010,35(9).
[16]何光华,姜慧萍,黄焘,等.益生菌配方奶粉中水分活度的控制[J].中国乳品工业,2012,40(2)2:30-32.

