奶山羊催乳素受体基因CDS区的克隆和序列分析与腺病毒干扰载体的构建
赵旺生,罗军,邱思源,王紫骞
(西北农林科技大学动物科技学院,陕西省农业分子生物学重点实验室,陕西杨凌712100)
奶山羊催乳素受体基因CDS区的克隆和序列分析与腺病毒干扰载体的构建
赵旺生,罗军✽,邱思源,王紫骞
(西北农林科技大学动物科技学院,陕西省农业分子生物学重点实验室,陕西杨凌712100)
本文旨在克隆奶山羊催乳素受体(PrlR)基因CDS序列,在此基础上构建针对奶山羊PrlR的腺病毒干扰载体,为研究PrlR在奶山羊乳腺乳脂合成代谢中的功能与调控作用提供有效的RNA干扰工具。首先从西农萨能羊乳腺组织RNA中扩增得到完整CDS区序列,其CDS长为1 746 bp,包含581个氨基酸序列,GenBank登录号为JF966783;测序后进行序列分析和功能预测,奶山羊PrlR基因CDS区与其他反刍动物相应序列具有较高的同源性,其跨膜区为第236~258位氨基酸;然后根据测序得到的CDS序列,在线设计合成奶山羊PrlR的sh RNA序列并成功构建重组干扰腺病毒载体;将这些载体在293细胞系中进行包装和扩繁,最终获取高滴度的腺毒,使用TCID50法检测病毒滴度为5.19×108PFU/mL。
催乳素受体;克隆;腺病毒;shRNA;奶山羊
山羊奶中乳蛋白、乳脂含量高,且具有脂肪酸不饱和度高、短中链脂肪酸含量高等特点,这些特点使得山羊奶成为具有优良营养价值和独特风味的动物食品[1-2]。研究山羊乳腺乳脂代谢尤其是乳脂生物合成的调控机制,对进一步了解乳腺泌乳过程的调控网络,研究利用乳腺生物反应器都有重要意义。研究表明,催乳素受体在乳脂合成代谢中有重要的调控作用[3-5]。催乳素受体(prolactin receptor,PrlR)是单次跨膜蛋白,属于Ⅰ类细胞因子超家族。乳腺细胞膜表面的PrlR与其配体结合后,可开启细胞内信号通路,与泌乳相关的下游基因作用,从而增加乳蛋白和乳脂含量,最终促进泌乳。PrlR可通过Ark-1等转录因子信号通路,调控与乳脂合成相关基因的表达[6-8]。自从PrlR第1次被分离克隆后[9],多个物种上的PrlR基因的mRNA序列已经得到[10-13]。尽管蛋白的基本结构相同,其核苷酸和氨基酸序列在不同物种的长度和组成都有差异,其在染色体上的定位也各不相同。到目前为止,尚无完整的山羊PrlR基因CDS序列,对研究其功能和调控机制造成了一定的障碍。本研究以乳腺泌乳调控中起主要作用的PrlR作为研究对象,从泌乳盛期乳腺组织中克隆山羊PrlR基因CDS区序列,对其进行生物信息学分析,并构建腺病毒干扰载体,为进一步的功能研究提供理论基础和依据。
1 材料与方法
1.1 实验材料
1.1.1 样品实验羊来自西北农林科技大学萨能羊原种场,选取健康的纯种西农萨能羊(第2胎,泌乳52 d),手术法采集乳腺组织样。
1.1.2 主要试剂RNA提取试剂盒、cDNA第1链合成试剂盒、TOP10感受态细胞和DNA凝胶纯化回收试剂盒均购自天根生化科技(北京)有限公司;3′RACE试剂盒购自大连宝生物(TaKaRa)有限公司;5′RACE试剂盒、TRIZOL购自Invitrogen公司;DNA质粒提取和凝胶回收试剂盒购自北京博大泰克(BioDev)公司;T4连接酶和pGM-T Easy载体购自Promega公司;PCR引物由上海捷瑞有限公司合成,shRNA模板由上海生工公司合成;穿梭载体pENTR/CMV-GFP/ U6质粒及腺病毒骨架载体pAd/PL-DEST质粒由深圳大学苟德明教授惠赠;293细胞系由本实验室传代保存。
1.2 实验方法
1.2.1 引物设计与合成根据NCBI已公布的绵羊PrlR基因CDS序列和牛PrlR基因cDNA序列设计合成PrlR克隆引物PrlR-U1和PrlR-L1,最终得到PCR扩增产物1 463 bp,扩增PrlR上、下游CDS区序列所用引物参照试剂盒说明书进行设计。
根据克隆得到的西农萨能羊PrlR序列,利用siRNA在线设计程序(http://jura.wi.mit.edu/bioc/ siRNAext/home.php)设计PrlR的siRNA序列。通过序列比对分析,筛选针对奶山羊长型PrlR mRNA胞内区的siRNA。在siRNA基础上,添加发夹环序列间隔(GAGTACTG),BamHⅠ和XhoⅠ酶切位点,和TTTTTT终止信号,即得到编码目的基因shRNA的单链DNA寡核苷酸正、反义链模板。
1.2.2 奶山羊PrlR基因CDS克隆采用Trizol法提取西农萨能羊乳腺组织总RNA。利用引物PrlR-U1和PrlR-L1扩增得到奶山羊PrlR基因的部分CDS区片段。利用引物PrlR-3I1和PrlR-5I3进行RACE PCR扩增得到奶山羊PrlR基因的上、游CDS区片段。将目的片段切胶回收纯化,连接T载体,转化大肠杆菌TOP10进行蓝白斑筛选,挑取阳性单克隆提取质粒,酶切鉴定正确后进行测序。
1.2.3 生物信息学分析采用NCBI中的nucleotide blast程序(http://blast.ncbi.nlm.nih.gov/Blast.cgi)对测序获得的PrlR基因核苷酸序列进行同源性比对和分析;利用BioXM 2.6软件对PrlR基因的蛋白质分子量及等电点进行预测以及不同物种间氨基酸序列的比对;利用ExPASy网站的ProtScale程序(http://web. expasy.org/protscale/)对PrlR的氨基酸序列进行疏水性预测;通过CBS Prediction Servers(http://www.cbs. dtu.dk/services/)中的SignalP和TMHMM程序分别对PrlR的信号肽结构和跨膜区域进行分析。
1.2.4 重组腺病毒载体的构建将合成的单链shRNA稀释后进行退火,得到双链寡核苷酸序列,稀释到工作浓度后与BamHⅠ和XhoⅠ双酶切的穿梭载体pENTR/CMV-GFP/U6进行连接,连接产物转化感受态TOP10,卡那霉素抗性筛选后,提取阳性质粒进行酶切鉴定和测序。将带有shRNA序列的穿梭载体与骨架载体pAd/PL-DEST进行同源重组,酶切鉴定正确后测序。重组质粒用于转染HEK 293细胞。
1.2.5 腺病毒的包装与扩增重组腺病毒载体经PacⅠ酶切线性化,纯化回收后用于转染生长融合度为80%~90%的293细胞系。在倒置荧光显微镜下观察绿色荧光的多少,以显示腺病毒的包装与扩繁程度。当约50%细胞从培养瓶底部脱落时即可收毒。重复“感染-冻融-收集”,大量扩增重组腺病毒。
1.2.6 腺病毒滴度的测定采用TCID50法(50%组织培养感染剂量法)测定腺病毒滴度。

表1 特异引物的名称及序列
2 结果
2.1 奶山羊PrlR基因CDS克隆经比对拼接,得到奶山羊长型PrlR基因CDS区序列,全长1 746 bp,编码581个氨基酸,GenBank登录号JF966783。
2.1.1 奶山羊PrlR基因CDS区的同源性分析BLAST同源性比对结果显示奶山羊(JF966783)与牛(NM_001039726)、绵羊(AF041257.1)、人(AK313270)和小鼠(NM_011169)PrlR基因CDS区序列的核苷酸同源性分别为95%、97%、81%和80%;氨基酸序列同源性分别为91%、94%、67%和62%,见图4。
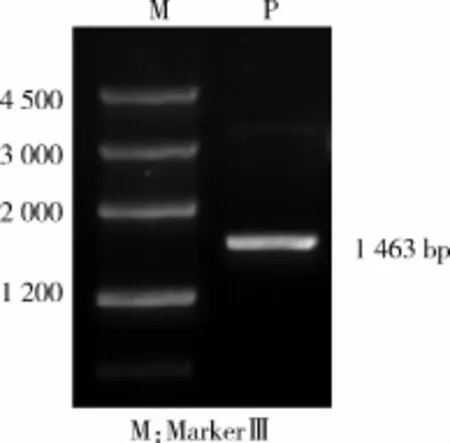
图1 PrlR基因CDS区PCR产物
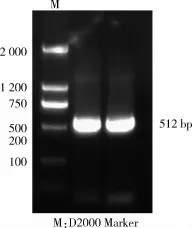
图2 PrlR基因3′RACE PCR产物

图3 PrlR基因5′RACE PCR产物

图4 山羊、牛、绵羊、人和小鼠PrlR氨基酸序列同源性比对
2.1.2 奶山羊长型PrlR的跨膜结构预测奶山羊PrlR氨基酸序列前24位为信号肽(见图5)。Tmpred跨膜结构预测共发现4个可能的跨膜结构,N端在膜外侧;其中分值最高的是从氨基酸236~258位,方向为由外向内(见图6)。肽链N端以强疏水性氨基酸开始,大约在230~260位氨基酸处存在1个强疏水性区域,与预测的最大可能跨膜结构区域重合(图7)。三维结构预测发现奶山羊长型PrlR的立体构象是由一个α-螺旋跨膜区连接的L形蛋白,胞外区和胞内区各由反向平行的β折叠片组成,包含一些转角和不规则卷曲(图8)。
2.1.3 奶山羊PrlR的功能预测翻译后修饰预测奶山羊长型PrlR上存在9个可能的酪氨酸磷酸化位点,其中4个在胞内区,是启动STAT5信号传递的磷酸化位点。在N端胞外区有2个潜在的纤连蛋白Ⅲ型功能域(28~112,127~215);蛋白上存在4个潜在的酪氨酸激酶磷酸化位点,5个蛋白激酶C磷酸化位点,1个cAmp/cGMP依赖性蛋白激酶磷酸化位点,4个糖基化位点和10个酪蛋白激酶Ⅱ磷酸化位点。显示了此蛋白具有活跃的生物学功能。
奶山羊PrlR是一个不稳定蛋白,化学式为C2949H4535N739O878S25,分子量65 u,理论等电点为5.20。
2.2 腺病毒干扰载体的构建
2.2.1 pENTR/CMV-GFP/U6-shRNA载体的构建测序结果表明,载体pENTR/CMV-GFP/U6-shRNA中插入的序列与所设计的shRNA原序列完全一致,证明载体构建成功(图9)。
2.2.2 重组腺病毒载体的构建重组质粒经过氨苄青霉素/氯霉素双重筛选,提取阳性克隆质粒进行电泳检测,见图10。进一步用ScaⅠ酶切后,以0.6%的琼脂糖凝胶电泳检测,见图11。测序结果显示,重组序列与pENTR/CMV-GFP/U6-shRNA中的shRNA序列完全一致,证明重组腺病毒载体构建成功。
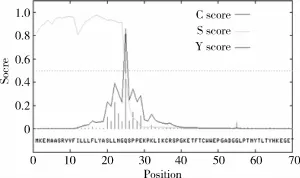
图5 山羊PrlR蛋白信号肽预测

图6 山羊PrlR蛋白跨膜结构分析

图7 山羊长型PrlR蛋白疏水结构预测

图8 山羊长型PrlR的三级结构预测

图9 重组腺病毒的包装与扩增(×100)
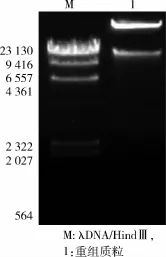
图10 重组腺病毒的包装与扩增(×100)

图11 重组腺病毒的包装与扩增(×100)
2.2.3 腺病毒的包装、扩增及滴度测定pAd/PLDEST/CMV-GFP/U6-shRNA重组质粒经PacⅠ线性化后,转染293细胞系。转染12 d后GFP大量表达,收集病毒,得到第1代病毒原液。以病毒上清反复感染细胞3次后,获得高滴度的腺病毒,经TCID50法计算滴度为5.19×108U/mL(图10)。
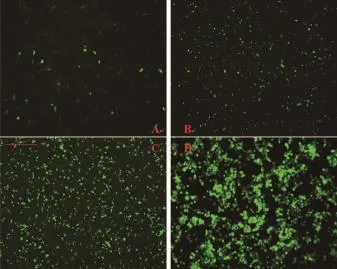
图12 重组腺病毒的包装与扩增(×100)
3 讨论
3.1 奶山羊PrlR长型CDS的同源性分析本研究首次克隆得到了山羊PrlR基因的CDS区全长序列,共1 746 bp,编码581个氨基酸残基。山羊PrlR基因与绵羊和牛的PrlR氨基酸和核苷酸序列长度一样,同源性很高(>95%);与人和小鼠长型PrlR的序列同源性较差。这显示PrlR基因的同源性与物种进化亲缘关系相关。山羊长型PrlR与绵羊的序列相似度最高,此前的报道显示,绵羊催乳素能够用于山羊的体外研究[14],这2个物种间序列的高相似性间接提供了理论依据,因为相似的受体能够结合相似的配体。整体来看,PrlR基因不同物种间的相似性可以用于预测物种进化的根据。奶山羊长型PrlR上存在9个可能的酪氨酸磷酸化位点,这些位点可能与JAK-STAT5和AKT通路的信号转导通路的激活有关。
3.2 奶山羊长型PrlR的跨膜结构SignalP 3.0 Server分析山羊PrlR氨基酸序列N端有信号肽结构存在的可能性为0.924,长度为24个氨基酸。TMpred跨膜结构预测奶山羊PrlR基因的氨基酸序列发现,PrlR基因有4个可能的跨膜区域,分别位于第8~12、98~119、236~258和433~454位氨基酸之间,其中氨基酸236~258位的跨膜结构分值高于另外3个结构的得分总和,其长度包含23个氨基酸序列,跨膜方向从膜外到膜内,这与已知的PrlR结构特点是相符的,初步判断此处为奶山羊长型PrlR蛋白的跨膜区。与傅泽红等[15]在人,牛和小鼠上的报道一致。序列分析表明,此段氨基酸序列与牛和绵羊的相应序列完全一致,保守性极高。相同区段有较强的疏水性;3级结构预测此处为一个α-螺旋。这些结果符合此处为跨膜区的判断。另外,在这段区域的上游紧邻的氨基酸第215~219位,发现了催乳素受体胞外域近膜处的特征性“WS结构”(WSEWS)[4],进一步验证了此处为蛋白质的跨膜区。据此得出奶山羊PrlR的ECD长235个氨基酸,ICD长323个氨基酸。同时PrlR的3级结构的膜外区有7条β折叠股组成一个三明治结构,其他为转角和不规则卷曲,与在人上关于PrlR的3级结构的报道一致[16]。
3.3 shRNA的设计小发夹RNA编码序列的设计,是影响RNA干扰效果的前提条件。本研究利用NCBI的在线BLAST进行初筛,得到了针对PrlR基因的4对shRNA,分别在奶山羊PrlR基因编码区起始密码子(ATG)后不同范围(393、70、860、1156)的19 bp序列。通过对绵羊和牛的长短型PrlR的CDS序列发现,长型受体比短型受体多一个胞内区。因此本研究选择位于胞内区的shRNA-1106,用于构建腺病毒载体以保证其能特异性地位于长型PrlR基因的CDS区,从而避免对其他类型PrlR的作用。
4 结论
奶山羊PrlR基因CDS区全长1746 bp,编码581个氨基酸残基,与反刍动物相应序列的同源性较高。奶山羊PrlR基因为单次跨膜蛋白,跨膜区域在236~258个氨基酸,含有催乳素受体蛋白的典型特征和多个潜在的功能位点。
本研究成功构建了奶山羊PrlR基因的介导shRNA的腺病毒载体,然后转染293细胞系进行腺病毒的包装和扩繁,最终获得了高滴度的腺病毒原液,从而为下一步在奶山羊乳腺细胞上研究PrlR基因对乳脂的调控提供基础。
[1]罗军,单翠燕,刘拉平,等.不同胎次西农萨能羊鲜乳中链和短链脂肪酸组成的初步研究[J].西北农林科技大学学报(自然科学版),2005,33(3):24-28.
[2]Haenlein G F W.Goat milk in human nutrition[J].Small Ruminant Res,2004,51:155-163.
[3]Mohammad M A,Haymond M W.Regulation of lipid synthesis genes and milk fat production in human mammary epithelial cells during secretory activation[J].Am J Physiol Endocrinol Metab, 2013,305(6):E700-E716.
[4]Rudolph M C,Russell T D,Webb P,et al.Prolactin-mediated regulation of lipid biosynthesis genes in vivo in the lactating mammary epithelial cell[J].Am J Physiol Endocrinol Metab,2011, 300(6):E1059-E1068.
[5]Bentley J Varghese.Mechanisms of the downregulation of prolactin receptor and their role in cell proliferation[D].Univ Pennsyl,2010.
[6]Soboleva T K,Vetharaniam I,Nixon A J,et al.Mathematical modelling of prolactin-receptor interaction and the corollary for prolactin receptor gene expression in skin[J].J Theoret Biol,2005, 234:289-298.
[7]Chen C C,Boxer R B,Stairs D B,et al.Akt is required for Stat5 activation and mammary differentiation[J].Breast Cancer Res,2010,12(5):R72.
[8]Creamer B A,Sakamoto K,Schmidt J W,et al.Stat5 promotes survival of mammary epithelial cells through transcriptional activation of a distinct promoter in Akt1[J].Mol Cell Biol,2010, 30(12):2957-2970.
[9]Boutin J M,Jolicoeur C,Okamura H,et al.Cloning and expression of the rat prolactin receptor a member of the growth hormone/ prolactin receptor gene family[J].Cell,1988,53:69-77.
[10]Shirota M,Banville D,Ali S.Expression of two forms of PRL receptor in rat ovary and liver[J].Mol Endocrinol,1990,4:1136-1143.
[11]Moore R C,Oka T.Cloning and sequencing of the cDNA encoding the murine mammary gland long-form prolactin receptor[J].Gene,1993,134:263-265.
[12]Trott J F,Hovey R C,Koduri S,et al.Alternative splicing to exon 11 of human prolactin receptor gene results in multiple isoforms including a secreted prolactin-binding protein[J].J Mol Endocrinol,2003,30:31-47.
[13]曹新,王强,颜景斌,等.牛催乳素基因组及其cDNA全长序列的分子克隆和分析[J].遗传学报,2002,(9):768-773.
[14]Pantschenko A G,Woodcock-Mitchell J,Bushmich S L,et al. Establishment and characterization of a caprine mammary epithelial cell line(CMEC)[J].In Vitro Cell Dev Biol Anim, 2000,36:26-37.
[15]傅泽红,邢光东,刘铁铮,等.鹅催乳素受体基因cDNA 5′端序列克隆[J].江苏农业学报,2007,23(3):213-217.
[16]Ding W,Wu W.Multiple human prolactin receptors and signaling[J].African J Biotech,2010,9(7):940-949.
Cloning,Sequence Analysis of PrlR CDS and Construction of Adenovirus Vector for RNA Interference in Dairy Goat
ZHAO Wang-sheng,LUO Jun*,QIU Si-yuan,WANG Zi-qian
(College of Animal Science and Technology,Northwest A&F University,Shanxi Yangling 712100,China)
To provide effective tool to study the role of PrlR in regulation of milk fat synthesis in mammary gland,the present study cloned the coding regions(CDS)of PrlR from mammary gland of Xinong Saanen goat and constructed RNA interfering adenovirus vectors targeting goat PrlR upon CDS sequence.First,complete CDS sequence was amplified from extracted RNA in mammary gland of Xinong Saanen goat and PrlR CDS(GenBank No.JF966783)is 1746 bp in length,coding 581 amino acid residues;Sequence analysis and functional prediction was performed after sequencing and found there was high homologies among goats and some other ruminants and the transmembrane region of PrlR locates at 236~258 amino acid residues;Then,shRNA sequences of PrlR gene was designed online and recombinant adenovirus vectors carrying shRNA targeting goat PrlR was successfully constructed according to the CDS sequences from sequencing;Finally,these adenovirus vectors were packaged and amplified in 293 cell line and hightitered adenovirus(5.19×108 PFU/mL)was obtained after multiple infection with TCID50 method.
dairy goat;PrlR;cloning;adenovirus;shRNA
S827.2
A
0258-7033(2015)09-0056-06
2014-05-24;
2014-11-12
转基因生物新品种培育重大专项(2014ZX08009-051B);公益性行业(农业)科研专项(201103038)
赵旺生(1983-),男,河南焦作人,博士研究生,主要从事奶山羊乳脂代谢相关研究,E-mail:genetics@nwsuaf.edu.cn
*通讯作者:罗军,E-mail:luojun1@yahoo.com

