启动子和PolyA序列对水牛乳腺特异性表达载体表达效率的影响
罗婵,任艳萍,屈春凤,李海洋,李湘萍,石德顺
(广西大学动物繁殖研究所,亚热带农业生物资源保护与利用国家重点实验室,广西南宁530004)
启动子和PolyA序列对水牛乳腺特异性表达载体表达效率的影响
罗婵,任艳萍,屈春凤,李海洋,李湘萍,石德顺*
(广西大学动物繁殖研究所,亚热带农业生物资源保护与利用国家重点实验室,广西南宁530004)
为了获得能有效表达促乳素的乳腺特异性表达载体,本研究系统比较了不同长度的启动子和有/无PolyA序列对乳腺特异性表达载体表达标记基因绿色荧光蛋白(GFP)和目的基因促乳素(PRL)的影响。将不同载体瞬时转染Bcap37细胞后,分别用实时定量PCR和流式细胞仪检测PRL和GFP的表达水平。结果表明:长度为5.2 kb的β-酪蛋白(Beta casein,BCN)启动子启动PRL的表达量显著高于长度为3.8 kb启动子,前者的表达量约为后者的6倍;在BCN启动子长度均为5.2 kb情况下,添加PolyA的载体p5.2BCN-PRL-PolyA-CMV-GFP-Neo组PRL的相对表达量为8.17,p5.2BCN-PRL-PolyA-CMV-GFP组PRL的相对表达量为17.84,均显著高于p5.2BCNPRL-CMV-GFP-Neo组,可见添加PolyA后,PRL的表达量均显著增加;进一步比较发现,含PolyA的载体中GFP的表达水平也显著高于不含PolyA的载体。对比以上结果发现,添加PolyA能够有效解除启动子之间的转录干扰,使标记基因的启动子CMV和目的基因的启动子BCN均能顺利启动基因表达。经过优化的载体启动目的基因PRL表达的效率更高,可应用于下一步的研究工作中。
启动子;PolyA序列;促乳素;绿色荧光蛋白;基因表达;水牛
水牛奶具有独特的醇香味,其乳脂率和蛋白质含量都比黄牛奶高,在市场上供不应求。因此,如何提高水牛产奶量成为亟待解决的重要问题。催乳素(prolactin,PRL)是脑垂体分泌的激素之一,参与启动和维持泌乳,对乳蛋白、乳糖和乳脂的合成起主要的调控作用[1-2]。因此,利用分子育种技术,构建PRL乳腺特异性表达载体,用于转基因水牛的生产,理论上可以增加水牛的产奶量。
构成表达载体的调控元件不同,其启动基因表达的效率差异显著。首先,启动子的调控序列对外源基因的表达效率和组织定位起重要作用。β-酪蛋白(Beta casein,BCN)是动物乳汁中的主要蛋白,因此,其启动子区域常被选为乳腺特异性表达载体的启动子。现有研究表明,BCN启动子长度不同,驱动目的基因表达的效率也相应发生显著变化[3]。其次,在原核细胞中,同一载体的含多个启动子时,不同启动子间存在竞争机制,从而发生转录干扰[4-5]。本实验室的前期研究发现,在真核细胞中也存在转录干扰现象。已有研究表明,在2个启动子之间增加ployA序列可显著减弱转录干扰[4]。因此,本研究拟探讨含不同调控元件的水牛乳腺特异表达载体表达标记基因GFP和目的基因PRL的效率,筛选有效表达PRL的载体,为后期生产转基因水牛提供实验依据。
1 材料与方法
1.1 材料Bcap37细胞购自上海生化细胞所;本研究所用的载体由任艳萍同学构建、保存。
质粒纯化试剂盒购自天根生化科技有限公司;限制性内切酶、Real time PCR试剂盒(SYBR Premix Ex TaqTM)为大连宝生物工程有限公司产品;EasyScript Firs-strand cDNA synthesis supermix试剂盒购自北京全式金生物技术有限公司;细胞培养液基础液为Gibco RPMI 1640;脂质体为Invitrogen公司的Lipofectamine LTX;其他试剂为Sigma公司产品。
1.2 方法
1.2.1 载体的转化、提取和鉴定将本实验室保存的载体质粒分别进行转化、提取和鉴定。质粒的转化参照《分子克隆实验指南》操作,将1 μg质粒加入到50 μL感受态细胞中,孵育、热激后接种到含氨苄的LB固体培养板,37℃培养12~16 h,挑取单个克隆菌落到含Amp的LB培养液中,37℃摇床过夜培养。次日挑取阳性单菌落,接种于20 mL氨苄抗性LB培养液中,37℃培养12 h后收集细菌,参照天根质粒提取试剂盒的说明书提取质粒。将提取好的质粒电泳进行初步鉴定,随后分别用限制性内切酶Sac I、Kpn I、Bam HI进行酶切鉴定。
1.2.2 细胞的瞬时转染参照Lipofectamine LTX使用说明书,提前1 d将细胞接种到6孔板,调整细胞密度至5×105/孔。转染当天,细胞密度约为70%~80%。去除孔内的培养基,用无血清DMEM培养基漂洗后加入2 mL Opti-MEM培养基。在1.5 mL EP管中准备溶液A和溶液B,A液是2 μg质粒用250 μL Opti-MEM培养基稀释,充分混匀后室温静置5 min,B液为250 μL Opti-MEM培养基中加入5 μL脂质体Lipofectamine LTX,轻轻混匀,室温静置5 min。然后将A、B液混合,室温静置30 min后均匀加入6孔板,轻轻摇晃使混合物与细胞均匀接触,放入CO2培养箱培养。24 h后观察转染效率。
1.2.3 标记基因绿色荧光蛋白的表达检测Bcap37细胞转染48 h后,去除培养基,用PBS洗涤1次,加入0.25%Trysin消化细胞,1 200 r/min速离心3 min收集细胞,离心后去上清液,用PBS洗涤3次。最后用PBS重悬细胞样品,采用流式细胞仪检测表达GFP的细胞数,流式细胞仪的激发波长为488 nm,发射波长为530 nm。试验以未转染的Bcap37细胞为阴性对照。用BD Accuri C6软件分析结果,试验重复3次。
1.2.4 PRL基因mRNA表达丰度的检测转染48 h后提取细胞RNA,反转录后Q-PCR检测各个载体PRL基因的mRNA表达丰度。试验以未转染的Bcap37细胞和水为阴性对照。
RNA的提取:细胞的收集与1.2.3所述相同。采用Trizol法提取细胞的总RNA,步骤简述如下:细胞离心后去除上清液,每个样品内加入1 mL Trizol,冰上放置5 min,让细胞充分裂解;然后加0.2 mL氯仿,用力震荡15 s,冰上放置5 min后,12 000 r/min(2~8℃)离心15 min;取上层水相置于新EP管中,加入0.5 mL异丙醇,冰上放置5 min后,12 000 r/min(2~8℃)离心15 min;弃上清,用1 mL 75%乙醇洗涤沉淀,7 500 r/min(2~8℃)离心5 min,弃上清;让沉淀的RNA在室温自然干燥;最后,用无RNA酶的水溶解RNA沉淀。
参照试剂盒使用说明书合成cDNA第1链。以反转录产物为模板,以β-actin为内参基因,进行Q-PCR检测PRL基因的相对表达量。PRL基因、β-actin基因引物如表1所示。Q-PCR反应体系:cDNA 1μL,10 μmol/L正、反向引物0.6 μL,PCR预混反应液10 μL,参照染料Rox 0.4 μL,加纯水至20 μL反应体系。试验重复3次。
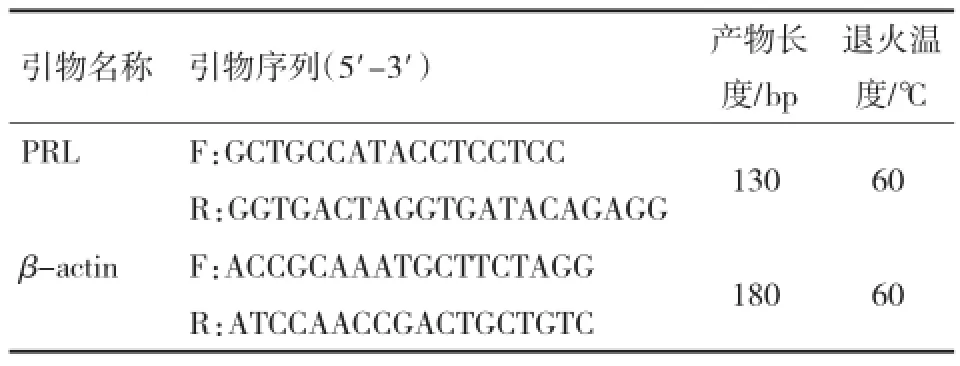
表1 PRL和β-actin引物
1.2.5 统计分析使用公式2-△△Ct计算PRL基因的相对表达量[6]。差异的显著性采用软件SPSS 17.0的单因素方差分析进行统计,当P<0.05时,统计学上为差异显著。
2 结果与分析
2.1 载体结构的鉴定对4个含不同调控元件的质粒(p5.2BCN-PRL-PolyA-CMV-GFP-Neo,p3.8BCNPRL-PolyA-CMV-GFP,p5.2BCN-PRL-PolyA-CMVGFP,p5.2BCN-PRL-CMV-GFP-Neo;载体结构见图1)分别进行酶切鉴定,用Kpn I和BamH I对质粒进行双酶切可获得大小约800 bp的PRL基因片段,用Kpn I和Sac I对质粒进行双酶切可获得大小约1 100 bp的BCN polyA片段(图2)。结果表明各质粒的结构、大小与预期相符,证明在保存、转化过程中并未发生突变,可用于下一步实验。
2.2 启动子长度对PRL基因表达效率的影响将拷贝数相同的质粒p5.2BCN-PRL-PolyA-CMV-GFP和p3.8BCN-PRL-PolyA-CMV-GFP分别转染Bcap37细胞,检测5.2 kb和3.8 kb 2种长度的牛β-酪蛋白启动子启动PRL表达的效率。转染48 h后提取细胞总RNA进行反转录,进行Q-PCR反应。Q-PCR反应各产物特异性强,熔解温度均一,熔解曲线为尖锐的单一峰(图3)。以瞬时转染p3.8BCN-PRL-PolyA-CMV-GFP的细胞样品中PRL基因的表达为参照,设定其表达量为1,β-actin为内参基因,用2-△△Ct法统计数据,结果显示,p5.2BCN-PRL-PolyA-CMV-GFP组PRL的相对表达量为6.04,显著高于p3.8BCN-PRL-PolyA-CMV-GFP组(图4),说明启动子的长度与其启动目的基因的效率密切相关。

图1 表达载体的线性化结构示意图

图2 表达载体结构的酶切鉴定

图3 目的基因和内参基因的熔解曲线

图4 含不同长度启动子的载体瞬时转染后PRL的相对表达水平
2.3 PolyA序列对其上、下游基因表达效率的影响将相同拷贝数的质粒p5.2BCN-PRL-CMV-GFP-Neo、p5.2BCN-PRL-PolyA-CMV-GFP-Neo和p5.2BCNPRL-PolyA-CMV-GFP分别转染Bcap37细胞,检测PolyA序列对其上游基因PRL、下游基因GFP表达效率的影响。转染24 h后观察发现,添加PolyA序列的2个载体转染Bcap37细胞后GFP阳性细胞数明显多于无PolyA序列组(图5)。转染48 h后收集细胞,采用流式细胞仪检测表达GFP的细胞数,结果与转染24 h后观察到的现象吻合(图6A、B)。以瞬转p5.2BCNPRL-CMV-GFP-Neo的细胞样品中PRL基因的表达为参照,设定其表达量为1,β-actin为内参基因,用2-△△Ct法统计数据,结果显示,p5.2BCN-PRL-PolyACMV-GFP-Neo组PRL的相对表达量为8.17,p5.2BCN-PRL-PolyA-CMV-GFP组PRL的相对表达量为17.84,均显著高于p5.2BCN-PRL-CMV-GFPNeo组,可见添加polyA后,PRL的表达量均显著增加(图7)。进一步比较以上结果发现,添加polyA后,其上下游基因的表达水平均升高,说明不同启动子的转录干扰被解除;经过优化后的载体PRL表达水平较高,可用于下一步研究工作。此外,p5.2BCN-PRLPolyA-CMV-GFP组GFP、PRL的相对表达量也显著高于p5.2BCN-PRL-PolyA-CMV-GFP-Neo组(图6、7),可能是由于后者增加的筛选基因Neo(新霉素抗性基因)对GFP、PRL的表达也存在转录干扰,具体原因仍有待进一步探究。
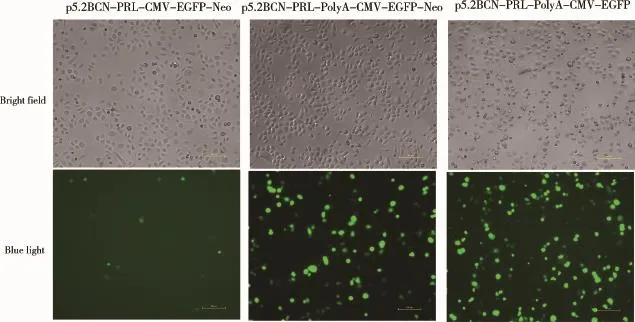
图5 PolyA序列对GFP表达水平的影响
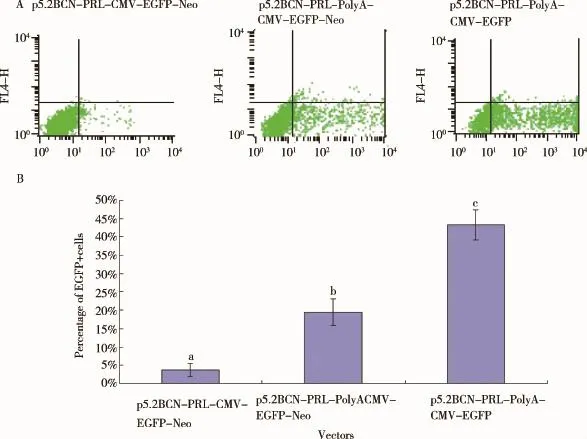
图6 转染48 h后Bcap37细胞中GFP的表达情况

图7 PolyA序列对PRL相对表达水平的影响
3 讨论
目前,国内、外的研究团队通过转基因克隆技术先后获得了一批转基因的猪[7-8]、牛[3,9]、羊[10]新品种,转基因克隆技术已成为动物育种的新方法。上述转基因动物能够通过乳腺分泌人类医疗需要的药用蛋白,在实际生产和应用中具有极大的潜能。本研究的最终目的是充分利用PRL调控泌乳的生物学功能,构建PRL乳腺特异性表达载体,通过体细胞核移植或受精卵注射的方法生产高产奶量的转基因水牛。虽然PRL具有促进乳腺发育、启动与维持泌乳的功能,但过量的表达PRL会增加乳腺癌的发病率[11]。因此,本研究试探讨不同的载体构造元件下,PRL基因在细胞中的表达变化规律,筛选适度表达PRL的载体用于转基因水牛的生产。
乳腺特异表达载体,是指在乳腺特异性调控元件的调控下,能启动外源基因在泌乳期的乳腺细胞中表达的一种载体。乳腺特异表达载体能实现时空性表达的关键是启动子,它一般由乳腺特异分泌的乳蛋白启动子承担。牛乳汁中含量最高的蛋白是酪蛋白,主要包括αs1-酪蛋白(αs1-Casein)、β-酪蛋白(β-Casein,BCN)、κ-酪蛋白(κ-Casein)、αs2-酪蛋白(αs2-Casein)。本研究中,选用乳汁中表达丰度最高的BCN启动子构建乳腺表达载体。成功的表达载体必须包含足够的应答元件。理论上,包含的元件越多,启动子的特异性或者启动的效率越高。本研究对不同长度的BCN启动子启动PRL的效率进行探讨,结果发现5.2 kb BCN启动子的效率显著高于3.8 kb启动子,与Brophy等[3]的报道一致。Narus等[12]比较了1.8 kb与3.1 kb的牛β-酪蛋白启动子的启动效率,则发现2个启动子在效率上差异不显著,但1.8 Kb的启动子存在乳腺组织以外其他组织中的泄露性表达。由此推测,5.2 kb BCN已经包含了特异性调控下游基因高水平表达的各类调控元件,更适合作为乳腺特异表达载体的启动子。
转录干扰是指一个基因在其转录的过程中,直接或者顺式的抑制另一个基因转录[13]。目前研究发现,转录干扰现象也存在于由2个表达元件构成的转基因载体中,其启动外源基因表达的效率显著低于仅含有一个表达元件的载体。前期研究工作中,对所构建载体的真核表达效率进行检测,发现由CMV启动子驱动的标记基因能顺利表达,而乳腺特异启动子BCN驱动的目的基因却不表达,推测是由于转录干扰导致的。PolyA序列是具有转录终止作用和使转录的mRNA加尾的DNA序列,常在载体构建中用作加尾信号。本研究中,拟利用PolyA序列具有转录终止的作用,探讨在2个表达元件之间添加PolyA序列能否消除转录干扰现象。结果显示,添加polyA后,其上游基因EGFP和下游基因PRL的表达水平均显著升高,说明不同启动子的转录干扰被解除,与Callen等[4]的研究结果一致。Greger等[14]研究认为,插入PolyA序列可以显著降低上游基因对下游基因表达的抑制作用,但无法彻底消除这种干扰现象[15]。本研究中,载体的转录干扰现象是否得到彻底消除仍有待进一步研究;但经过优化后的载体PRL表达水平得到显著提高,已可用于下一步的研究工作中。
综上所述,目的基因的表达水平与启动子长度密切相关,长度为5.2 kb的BCN启动子比3.8 kb启动子更适合用于乳腺特异表达载体的构建;在2个表达元件间添加polyA序列可以有效解除转录干扰;经过优化的载体可用于后续工作。本研究为获得高产奶量的转基因水牛新品种奠定了工作基础。
参考文献:
[1]Lacasse P,Lollivier V,Dessauge F,et al.New developments on the galactopoietic role of prolactin in dairy ruminants[J].Domest Anim Endocrinol,2012,43(2):154-160.
[2]Kelly P A,Bachelot A,Kedzia C,et al.The role of prolactin and growth hormone in mammary gland developmen t[J].Mol Cell Endocrinol,2002,197(1-2):127-131.
[3]Brophy B,Smolenski G,Wheeler T,et al.Cloned transgenic cattle produce milk with higher levels of beta-casein and kappa-casein[J].Nat Biotechnol,2003,21(2):157-162.
[4]Callen B P,Shearwin K E,Egan J B.Transcriptional interference between convergent promoters caused by elongation over the promoter[J].Mol Cell,2004,14(5):647-656.
[5]Rollins R A,Korom M,Aulner N,et al.Drosophila nipped-B protein supports sister chromatid cohesion and opposes the stromalin/Scc3 cohesion factor to facilitate long-range activation of the cut gene[J].Mol Cell Biol,2004,24(8):3100-3111.
[6]Livak K J,Schmittgen T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T))Method[J].Methods,2001,25(4):402-408.
[7]Cho S K,Hwang K C,Choi Y J,et al.Production of transgenic pigs harboring the human erythropoietin(hEPO)gene using somatic cell nuclear transfer[J].J Reprod Dev,2009,55(2):128-136.
[8]Zhang P,Zhang Y,Dou H,et al,Handmade cloned transgenic piglets expressing the nematode fat-1 gene[J].Cell Reprogram, 2012,14(3):258-266.
[9]Monzani P S,Sangalli J R,De Bem T H,et al.,Breeding of transgenic cattle for human coagulation factor IX by a combination of lentiviral system and cloning[J].Genet Mol Res, 2013,12(3):3675-3688.
[10]Zhang P,Liu P,Dou H,et al.Handmade cloned transgenic sheep rich in omega-3 Fatty acids[J].PLoS One,2013,8(2): e55941.
[11]Wennbo H,Kindblom J,Isaksson O G,et al.Transgenic mice overexpressing the prolactin gene develop dramatic enlargement of the prostate gland[J].Endocrinology,1997,138(10):4410-4415.
[12]Naruse K,Yoo S K,Kim S M,et al.Analysis of tissue-specific expression of human type II collagen cDNA driven by different sizes of the upstream region of the beta-casein promoter[J]. Biosci Biotechnol Biochem,2006,70(1):93-98.
[13]Proudfoot N J.Transcriptional interference and termination between duplicated alpha-globin gene constructs suggests a novel mechanism for gene regulation[J].Nature,1986,322(6079): 562-565.
[14]Greger I H,Demarchi F,Giacca M,et al.Transcriptional interference perturbs the binding of Sp1 to the HIV-1 promoter[J].Nucleic Acids Res,1998,26(5):1294-1301.
[15]Padidam M,Cao Y.Elimination of transcriptional interference between tandem genes in plant cells[J].Biotechniques,2001,31(2):328-330.
Impact of Promoters and PolyA Sequence on Expression Efficiency of Buffalo Mammary Gland Specific Expressing Vectors
LUO Chan,REN Yan-ping,QU Chun-feng,LI Hai-yang,Li Xiang-ping,SHI De-shun*
(Animal Reproduction Institute,State Key Laboratory for Conservation and Utilization of Subtropical Agro-bioresources,Guangxi University,Guangxi Nanning 530005,China)
To investigate the impact of promoters and PolyA sequence on the expression of exogenous genes in Bcap37 cells,two different length of Beta casein(BCN)promoters and PolyA sequences were used in the constitute of buffalo mammary gland specific expressing vectors.Real-time PCR and flow cytometry analysis were used to detect the expression levels of marker gene green fluorescent protein(GFP)and target gene prolactin(PRL)in Bcap37 cells transfected with different vectors.The result showed that the expression level of PRL was significant higher in the cells transfected with vector contained a 5.2 Kb length of BCN promoter than vector contained 3.8 Kb length of BCN promoter.It indicated that the expression of exogenous was positively correlated to the length of the promoters. Moreover,both the expression of GFP and PRL were improved remarkably when inserting PolyA sequence between promoter CMV and BCN,the results showed that the inserted PolyA sequences could eliminate the transcription inhibition inducing by promoter CMV and BCN.The modified vectors which driven the expression of PRL more effectively can be utilized in the subsequent work.
promoter;polyA sequence;prolactin;green fluorescent protein;gene expression;buffalo
S823.2
A
0258-7033(2015)09-0062-06
2014-09-08;
2014-10-30
国家“863”重大专项(2011AA100607);广西亚热带生物资源保护利用重点实验室开放课题(SB1002)
罗婵(1981-),女,广西北流人,助理研究员,主要从事发育生物学和转基因动物研究,E-mail:luochan@gxu.edu.cn
*通讯作者:石德顺,研究员,博士生导师,E-mail:ardsshi@gxu.edu.cn

