DNA条形码技术在食蚜蝇科系统发育中的应用
DNA条形码技术在食蚜蝇科系统发育中的应用
陈春琳,霍科科
(陕西理工学院 生物科学与工程学院, 陕西 汉中 723000)
[摘要]随着食蚜蝇科昆虫系统学研究的深入,单纯的形态学特征分类方法已显得不足,DNA条形码技术已为食蚜蝇科系统学研究提供了一条新途径并获得了较为广泛的应用。对国内外学者利用线粒体COI、18S rRNA和28S rRNA基因序列,以及ITS序列等在食蚜蝇科系统发育中的应用研究进行了总结。
[关键词]DNA条形码;食蚜蝇科;系统发育
[文章编号]1673-2944(2015)04-0059-05
[中图分类号]Q969.2
收稿日期:2015-01-20
基金项目:陕西省教育厅科学研究计划项目(14JS017)
作者简介:陈春琳(1982—),女,安徽省合肥市人,陕西理工学院硕士研究生,主要研究方向为动物分子生物学;[通信作者]霍科科(1962—),男,陕西省扶风县人,陕西理工学院教授,硕士生导师,博士,主要研究方向为昆虫学。
食蚜蝇科(Syrphidae)隶属双翅目(Diptera)环裂亚目(Cyclorrhapha),分布地区广泛[1],分为食蚜蝇亚科(Syrphinae)、管蚜蝇亚科(Eristalinae)和巢穴蚜蝇亚科(Microdontinae)3个亚科[2],全世界记载的食蚜蝇科昆虫约230属6 000余种[3],中国记录的食蚜蝇科昆虫有18族97属783种[4]。传统的系统分类方法对昆虫进化关系研究较为成熟,但形态鉴定对一些特征相似种、雌雄差异和虫态变化等情况,准确鉴定比较困难[5-6],需要新的方法弥补形态学鉴定的不足。
DNA条形码由加拿大动物学家Paul Hebert[7]2003年首次提出。DNA条形码指生物体内能够代表该物种标准的、有足够变异的且易扩增和相对较短的DNA片段,DNA条形码技术可实现对物种进行简洁、快速的鉴定[8]。通过DNA条形码技术对物种进行系统进化研究可避免受到物种不同生长阶段形态特征差异、性别以及个体破坏等问题的影响[9-10]。DNA条形码为物种区分与鉴定、新种描述以及隐存种界定提供了简便的物种鉴定方法[11-13]。DNA条形码技术已在昆虫纲31个目物种鉴定中得到应用,包括石蛃目、蜚蠊目、鞘翅目、双尾目、双翅目、纺足目、蜉蝣目等[13],在双翅目中,DNA条形码(COI(Cytochrome c oxidase subunit I)基因,18S rRNA与28S rRNA基因,ITS(Internal transcribed spacer)序列,Cyt b(Cytochrome b)基因等)很好地解决了长角亚目和短角亚目不同阶元的分类问题[10]。目前,在食蚜蝇科系统发育应用较多的DNA条形码主要有COI基因、18S rRNA与28S rRNA基因、ITS序列、Cyt b基因等。本文将就DNA条形码技术对食蚜蝇科系统发育研究作一总结。
1线粒体COI基因在食蚜蝇科分类中的应用
COI基因是线粒体基因编码中结构功能最保守的基因[14-15],其特有的序列特征在物种鉴定上具有可靠、低成本、高效率的特点,是动物物种鉴定的重要常用基因之一[16]。Ståhls[17]等对黑蚜蝇属(Cheilosia)中24个分类群进行COI基因序列测定,并对结果进行简约性分析,得出黑蚜蝇属是单系群,且与鼻颜蚜蝇属(Rhingia)互为姊妹群;进一步利用COI基因序列分析研究区分了希腊莱斯沃斯岛的齿腿蚜蝇(Merdon)的大部分种[18]。对于一直因缺少种间鉴定特征的毛食蚜蝇属(DasysyrphusEnderlein)分类界限问题,通过COI基因分析与形态特征相结合,实现了该问题的解决[19]。此外,基于COI基因序列分析的8种韩国的长角食蚜蝇系统分类结果,支持形态学的Chrysotoxumsapporense和Chrysotoxumgraciosum种间和种内存在差异,从而为东亚地区这2物种形态鉴定提供了依据[20]。
在新种的确认上,利用黑带食蚜蝇属(Episyrphus)COI基因序列验证了澳大利亚记录种(E.viridaureus)和两新种(E.oliviaeWright与E.glaberWright)的重要形态特征鉴定结果,并依据形态特征编制了检索表[21]。所用引物如表1所示。

表1 用于测序的COI基因片段引物
因而,线粒体COI基因与形态学相结合,可很好地实现食蚜蝇科单系群划分、新种的鉴定以及物种的分类问题。
218S rRNA、28S rRNA基因在食蚜蝇科分类中的应用
18S rRNA和28S rRNA均为rRNA结构的一部分,其基因序列较长,进化速度慢,使其适合研究属以上的分类阶元[22-23]。在实际的分类研究上,将18S rRNA和28S rRNA基因同COI基因结合在一起研究较多见,用于分析争议种的鉴定问题。Ståhls等[24-25]利用28S rRNA和线粒体COI基因序列特点,并结合形态特征,对51个食蚜蝇科昆虫分类群地位进行组合分析,结果显示:巢穴蚜蝇族(Microdontini),包括棒巴蚜蝇属(Spheginobaccha),位于食蚜蝇科类群分支的基部,缩颜蚜蝇族(Pipizini)是食蚜蝇亚科姊妹群,并且缩颜蚜蝇族中多数属为单系群。Mengual等[26]系统地研究了98个食蚜蝇亚科分类群的28S rRNA基因片段和线粒体COI基因,认为:(1)Toxomeini族是单系群;(2)巴蚜蝇族(Bacchini)分出5个进化分支;(3)小蚜蝇族(Paragini)是一个单系群,并为异巴蚜蝇属(Allobaccha)的姊妹群。同年,进一步利用18S rRNA和28S rRNA基因以及COI基因序列,对异食蚜蝇属(Allograpta)、细腹食蚜蝇属(Sphaerophoria)和Exallandra属的系统进化关系研究发现,异食蚜蝇属是并系群,而Exallandra属嵌入细腹食蚜蝇属,且细腹食蚜蝇属、Exallandra属和异食蚜蝇属拥有一个共同的进化史[27]。对新世界高度多样化的Ocyptamus属和Toxomerus属的系统关系进行分析,确定了Toxomerini族是单系群,但不能确定Ocyptamus属的单系性[28]。
此外,为阐明巢穴蚜蝇亚科的系统进化关系和其不确定种的分类问题,Reemer等[29]选取巢穴蚜蝇亚科具代表性的28属90个分类群,通过18S rRNA和28S rRNA基因的序列研究,结果支持棒巴蚜蝇属是巢穴蚜蝇亚科的姊妹群。所用引物如表2所示。

表2 用于测序的28S rRNA和18S rRNA基因片段引物
可见,18S rRNA和28S rRNA基因在食蚜蝇科分类鉴定,尤其在姊妹群、单系群、并系群的划分上得到应用。
3ITS序列在食蚜蝇科分类中的应用
内转录间隔区序列(internal transcribed spacer,ITS)是核糖体RNA上的一个非编码区域,分为ITS1和ITS2序列,以其长度适中、易于扩增、进化速度快以及变异性高等优点应用于昆虫的分类鉴定[23]。成新跃等[30]对缩颜蚜蝇族和3种不同食性食蚜蝇科昆虫的核糖体内转录间隔区(ITS)进行序列分析,并结合其形态特征分析得出:缩颜蚜蝇族与捕食性类群亲缘关系较近,与腐食性类群关系较近,说明缩颜蚜蝇族属于食蚜蝇亚科,解决了缩颜蚜蝇族分类地位混乱的问题。Haarto等[31]依据ITS2序列信息和形态特征的研究,将分布在欧洲北部地区墨食蚜蝇属(Melanostoma)分成方斑墨食蚜蝇(Melanostomamellinum)、M.certum、M.mellarium和M.scalare4大类群。所用引物如表3所示。
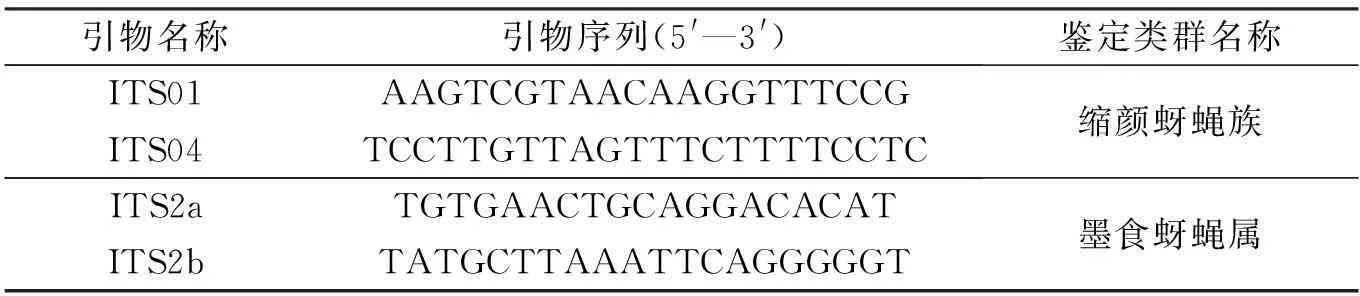
表3 用于测序的ITS基因片段引物
因而,利用ITS序列系统发育分析,能很好地解决形态学观测上难以解决的一些食蚜蝇种属的分类问题。
4其他基因在食蚜蝇科分类研究中的应用
细胞色素b(Cytochrome b,Cyt b)基因是线粒体DNA基因结构中一种蛋白质编码基因,其进化速度和序列变异等特点适合研究种内、种间以及科间的系统发育关系[32-33]。张宏杰和霍科科[33]根据管蚜蝇族(Eristalini)的7种食蚜蝇线粒体基因组的Cyt b基因序列分析得出:管蚜蝇属(Eristalis)和斑目蚜蝇属(Lathyrophthalmus)系统发育关系较近,与条胸蚜蝇属(Helophilus)存在一定遗传距离,而与宽盾蚜蝇属(Phytomia)关系最远;并进一步证实这4个属的系统发育为单系群。在单系群与并系群研究上,Skevington等[34]还根据线粒体12S rDNA和16S rDNA的序列数据支持了食蚜蝇亚科和巢穴蚜蝇亚科是单系群,而管蚜蝇亚科是并系群。所用引物如表4所示。

表4 用于测序的Cyt b,12S rDNA和16S rDNA基因片段引物
5问题与展望
目前,DNA条形码技术运用于食蚜蝇研究尚处于起步阶段,它解决了一些形态学上难以界定的分类问题。而其获得的结果经常与形态学鉴定结果产生矛盾,如何清楚的界定两者的区别,需要进一步分析。在此,不妨采用多种DNA条形码结果相互检验的方式,尝试其它类群昆虫系统分类研究上出现的分子标记技术,如随机扩增多态性DNA标记(Random amplified polymorphic DNA,RAPD),简单重复序列分子标记(Inter-simple sequence repeat,ISSR)等简单、快捷的DNA多态性分类技术[35-37],同时结合形态学观测结果,获得可信的试验数据[25-26]。此外,DNA条形码技术对基因克隆与基因序列测定的要求较高,试验中应该防止基因组污染,规范操作过程,避免试验结果的人为误差。同时应该加强国内外的合作,共享DNA条形码序列信息,便于更加高效、科学的系统研究。
[参考文献]
[1]陈玉宝,宗翔,王重舒,等.松花湖区食蚜蝇科昆虫区系研究[J].北华大学学报:自然科学版,2014,15(1):95-100.
[2]THOMPSON F C,VOCKEROTH J R.Family Syrphidae in:Evenhuis,N.L.(edit):catalog of the Diptera of the Australasian and Oceanian regions[M].Honolulu:Bishop Museum Press & E J Brill,1989:437-537.
[3]霍科科,郑哲民,张宏杰.中国食蚜蝇科(Syrphidae)的研究进展[J].汉中师范学院学报:自然科学版,2002,20(1):70-75.
[4]黄春梅,成新跃.中国动物志-昆虫纲-第五十卷-双翅目-食蚜蝇科[M].北京:科学出版社,2012:69-701.
[5]CONTRERAS G M A,VIVERO R J,VELEZ I D,et al.DNA barcoding for the identification of sand fly species(Diptera,Psychodidae,Phlebotominae) in Colombia[J].PLoS ONE,2014,9(1):1-9.
[6]REEMER M,STÅHLS G.Generic revision and species classification of the Microdontinae(Diptera,Syrphidae)[J].Zookeys,2013(288):1-213.
[7]HEBERT P D N,CYWINSKA A,BALL S L,et al.Biological identifications through DNA barcodes[J].Proc R Soc Lond B,2003(270):313-321.
[8]WEITSDCHEK E,FISCON G,FELICI G.Supervised DNA Barcodes species classification:analysis,comparisons and results[J].Bio Data Min,2014,7(1):4-21.
[9]赵广宇,李虎,杨海林,等.DNA条形码技术在昆虫学中的应用[J].植物保护学报,2014,41(2):129-141.
[10]王诗迪,赵喆,张春田.常用核基因序列在双翅目昆虫系统学中的研究进展[J].环境昆虫学报,2012,34(1):220-228.
[11]HEBERT P D N,PENTON E H,BURNS J M,et al.Ten species in one:DNA barcoding reveals cryptic species in the neotropical skipper butterfly Astraptes fulgerator[J].PNAS,2004,101(41):14812-14817.
[12]SHRUBOVYCH J,SCHNEIDER C,D’HAESE C.Description of a new species of Acerentulus Berlese,1908(Protura:Acerentomata:Acerentomidae) with its barcode sequence and a key to the confinis group[J].Ann Soc Entomol Fr,2012,48(1/2):1-7.
[13]宋南,刘杰彩,万志,等.DNA条形码在昆虫分类中的应用[J].四川动物,2013,32(3):470-474.
[14]BEARD C B,HAMM D M,COLLINS F H.The mitochondrial genome of the mosquitoAnophelesgambiae:DNA sequence,genome organization,and comparison with mitochondrial sequences of other insects[J].Insect Mol Biol,1993(2):103-124.
[15]GENNIS R B.Site-directed mutagenesis studies on subunit I of the aa3-type cytochrome coxidase ofRhodobactersphaeroides:a brief review of progress to data[J].Biochim biophys Acta,1992(1101):184-187.
[16]LEASI F,NORENBURG J L.The necessity of DNA taxonomy to reveal cryptic diversity and spatial distribution ofMeiofauna, with a focus on Nemertea[J].PLoS ONE,2014,9(8):1-15.
[17]STÅHLS G,NYBLOM K.Phylogenetic analysis of the genusCheilosia(Diptera,Syrphidae) using mitochondrial COI sequence data[J].Mol Phylogenet Evol,2000,15(2):235-241.
[18]STÅHLS G,VUJIC A,Pérez-Baon C,et al.COI barcodes for identification ofMerodonhoverflies(Diptera,Syrphidae) of Lesvos Island,Greece[J].Mol Ecol Resour,2009(9):1431-1438.
[19]LOCKE M M,SKEVINGTON J H.Revision of NearcticDasysyrphusEnderlein (Diptera:Syrphidae)[J].Zootaxa,2013,3660(1):1-80.
[20]SUK S W,HAN H Y.Clarification of previously confusedChrysotoxumsapporenseandChrysotoxumgraciosum(Insecta:Diptera:Syrphidae) in East Asia based on morphological and molecular data[J].Animal Cells and Systems,2013,17(4):277-289.
[21]WRIGHT S G,SKEVINGTON J H.Revision of the subgenusEpisyrphus(Episyrphus) Matsumura(Diptera:Syrphidae) in Australia[J].Zootaxa,2013,3683(1):51-64.
[22]王宝庆,葛菁萍,平文祥.18S rRNA在系统进化研究中的应用[J].黑龙江医药,2005,18(4):251-252.
[23]马婷婷,陈光,刘春香.ITS序列的特点及其在昆虫学研究中的应用[J].应用昆虫学报,2011,48(3):710-715.
[24]STÅHLS G,HIPPA H,ROTHERAY G,et al.Phylogeny of Syrphidae(Diptera) inferred from combined analysis of molecular and morphological characters[J].Syst Entomol,2003(28):433-450.
[25]VUJIC A,STÅHLS G,ACANSKI J,et al.Systematics ofPipiziniand taxonomy of EuropeanPipizaFallen: molecular and morphological evidence(Diptera,Syrphidae)[J].Zool Scr,2013(42):288-305.
[26]MENGUAL X,STÅHLS G,ROJO S.First phylogeny of predatory flower flies(Diptera,Syrphidae,Syrphinae) using mitochondrial COI and nuclear 28S rRNA genes:conflict and congruence with the current tribal classification[J].Cladistics,2008(24):543-562.
[27]MENGUAL X,STÅHLS G,ROJO S.Molecular phylogeny ofAllograpta(Diptera,Syrphidae) reveals diversity of lineages and non-monophylyof phytophagous taxa[J].Mol Phylogene Evol,2008(49):715-727.
[28]MENGUAL X,ROJO S.Is the mega-diverse genusOcyptamus(Diptera,Syrphidae) monophyletic? Evidence from molecular characters including the secondary structure of 28S rRNA[J].Mol Phylogenet Evol,2012,62(1):191-205.
[29]REEMER M,STÅHLS G.Phylogenetic relationships ofMicrodontinae(Diptera:Syrphidae) based on molecular and morphological characters[J].Syst Entomol,2013(38):661-688.
[30]成新跃,吕静,黄春梅.基于形态和分子数据确定缩颜蚜蝇的系统分类地位[J].中国科学,1999,29(6):645-654.
[31]HAARTO A,STÅHLS G.When mtDNA COI is misleading:congruent signal of ITS2 molecular marker and morphology for North EuropeanMelanostomaSchiner,1860(Diptera,Syrphidae)[J].Zookeys,2014(431):93-134.
[32]牛京京,张守纯,金谷,等.线粒体基因及其Cyt b基因与昆虫分子系统学研究[J].生物技术通报,2011(4):52-55.
[33]张宏杰,霍科科.管蚜蝇族7种食蚜蝇Cyt b基因序列差异及系统进化关系[J].汉中师范学院学报:自然科学版,2004,22(2):54-59.
[34]SKEVINGTON J H,YEATES D K.Phylogeny of the Syrphoidea(Diptera) Inferred from mtDNA Sequences and Morphology with Particular Reference to Classification of the Pipunculidae(Diptera)[J].Mol Phylogenet Evol,2014(431):93-134.
[35]孟子烨,陈晓琴,江世宏,等.RAPD技术在昆虫分类学研究中的应用[J].重庆师范大学学报:自然科学版,2009,26(2):33-38.
[36]LEHR M A,KILPATRICK C W,WILKERSON R C,et al.Cryptic species in theAnopheles(Nyssorhynchus) albitarsis (Diptera:Culicidae) complex:incongruence between random amplified Polymorphic DNA-polymerase chain reaction identification and analysis of mitochondrial DNA COI gene sequences[J].Ann Entomol Soc Am,2005,98(6):908-917.
[37]SKODA S R,POMKULWAT S,FOSTER J E.Random amplified polymorphic DNA markers for discriminatingCochliomyiahominivoraxfrom C.macellaria(Diptera:Calliphoridae)[J].Bull Entomol Res,2002,92(1):89-96.
[责任编辑:李 莉]
Application of DNA barcoding technology in the research
of Syrphidae systematics
CHEN Chun-lin,HUO Ke-ke
(School of Bioscience and Engineering, Shaanxi University of Technology,
Hanzhong 723000, China)
Abstract:With further research, the simple morphological classification methods were inadequate to research Syrphidae systematics. Recently, DNA barcoding technology provided a new method for studying Syrphidae systematics, and was used widely. This paper reviewed the application of DNA barcoding technology in the research of Syrphidae systematics by domestic and overseas scholars, including mitochondrial COI, 18S rRNA, 28S rRNA, and ITS sequences.
Key words:DNA barcode;Syrphidae;systematics

