新型吡虫啉类化合物的合成*
李 琳,马潇潇,王克良,李 静(六盘水师范学院化学与化学工程系,贵州六盘水 553000)
新型吡虫啉类化合物的合成*
李琳,马潇潇,王克良,李静
(六盘水师范学院化学与化学工程系,贵州六盘水553000)
摘要:以6-氯-3-氯甲基吡啶为原料,经水解和氧化制得6-氯-3-醛基吡啶(3); 3与丙二腈反应制得关键中间体——2-(6-氯-3-亚甲基吡啶)丙二腈(4); 4与杂环烯酮缩胺经加成-异构化-环化反应合成了5个新型的吡虫啉类化合物,其结构经1H NMR,13C NMR,IR,HR-EI-MS和MS表征。
关键词:吡虫啉;衍生化;药物合成
吡虫啉是烟碱类高效低毒杀虫剂[1-2]。近几年来,由于吡虫啉的抗药性和对环境生物的影响使其应用受到限制[3-5]。合成新型的吡虫啉类似物,以期从中找到具有生物活性的新化合物具有重要意义。
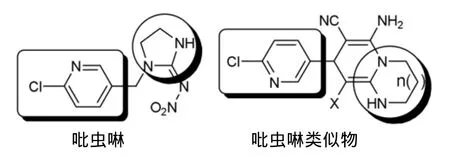
Chart 1
通过对吡虫啉和其他烟碱类化合物的结构分析发现,它们都具有一些类似的结构片断(Chart 1)。本文以以6-氯-3-氯甲基吡啶(1)为原料,经水解和氧化制得6-氯-3-醛基吡啶(3); 3与丙二腈反应制得关键中间体——2-(6-氯-3-亚甲基吡啶)丙二腈(4); 4与杂环烯酮缩胺(5a~5e)经加成-异构化-环化反应合成了5个新型的吡虫啉类化合物(6a~6e,Scheme 1),其结构经1H NMR,13C NMR,IR,HR-EI-MS和MS表征。
1 实验部分
1.1仪器与试剂
X-4型数字显微熔点仪(温度未校正); Bruker AV 300 MHz型核磁共振仪(CDCl3为溶剂,TMS为内标); JASCO FT/IR 480 plus型红外光谱仪(KBr压片); Bruker Daltonics inc.APEX II FTICR MS型高分辨质谱仪。
2-(6-氯-3-亚甲基吡啶)丙二腈(4,收率93%,m.p.110℃)[8]; 1a~1e(收率80%~88%)[9-10]按文献方法制备;其余所用试剂均为国产或进口化学纯或分析纯;柱色谱所用硅胶200目~300目,薄层色谱用硅胶板涂层为60 F254(厚200 um),烟台维启化工厂。
1.2合成
(1)6-氯-3-羟甲基吡啶
(2)的合成[6-7]

Scheme 1
在单口瓶中加入150 g(0.3 mol)和蒸馏水300 mL,搅拌下于25℃~40℃分批加入碳酸钠49 g(0.46 mol),加毕,回流反应4 h(TLC检测)。冷却至室温,分液,水相用乙酸乙酯(3×150 mL)萃取,合并有机相,用无水硫酸钠干燥,过滤,滤液经减压柱层析[洗脱剂:A=V(石油醚)∶V(乙酸乙酯)=2∶1,Rf=0.26]纯化得黄色固体2 40 g,产率93%,m.p.72℃;1H NMR δ:4.00(s,1H,OH),4.69(s,2H,CH2),7.28~7.31(m,1H,ArH),7.66~7.70(m,1H,ArH),8.27(s,1H,ArH);13C NMR δ:61.41,124.19,135.70,137.89,147.93,150.14; IR ν:820,1 021,1 462,1 569,2 853,2 875,3 048 cm-1。
(2)6-氯-3-醛基吡啶(3)的合成
在三口瓶中加入2 5 g(35 mmol)和干燥DCM 120 mL,搅拌使溶解;加入氯铬酸吡啶盐(PCC)21 g(0.1 mol),氩气保护下于室温反应4 h(TLC检测,展开剂:A=1∶1,Rf=0.73)。反应液经减压硅胶柱层析(洗脱剂:DCM)纯化(收集洗脱液,用无水硫酸钠干燥,浓缩)得白色固体3 4.3 g,产率87%,m.p.67℃~69℃;1H NMR δ:7.52(d,J=8.16 Hz,1H),8.15(q,J=10.15 Hz,1H),8.93(d,J=8.47 Hz,1H),9.91(s,1H);13C NMR δ:125.31,131.23,138.13,152.56,153.02,190.08; IR ν:839,1016,1 286,1 460,1 588,1 697,3 040 cm-1。
(2)6a~6e的合成通法
在双口瓶中加入5a~5e 1.5 mmol,搅拌下加入4 285 mg(1.5 mmol)和无水乙醇30 mL,回流反应8 h~12 h。过滤,滤饼用乙醇洗涤,合并滤液与洗液,浓缩后经柱层析[洗脱剂:V(乙酸乙酯)∶V(甲醇)=20∶3]纯化得淡黄色固体6a~6e。
6a(Rf=0.76):收率77%,m.p.278℃~280℃;1H NMR δ:3.75~3.95(m,4H),4.39(s,1H),6.43(s,2H),6.98(d,J=5.79 Hz,2H),7.17~7.39(m,6H),9.43(s,1H);13C NMR δ:38.06,42.75,43.56,57.55,85.50,121.56,123.94,125.74,127.96,128.44,137.91,142.06,142.94,147.26,147.51,150.33,155.08,190.60; IR ν:1 296,1 381,1 446,1 638,2 183,3 202,3 331 cm-1; MS m/z(%):377(26),272(73),265(100),236(21),105(25); HR-EI-MS m/z:Calcd for C20H16N5OCl[M+]377.104 3,found 377.104 6。
6b(Rf=0.74):收率87%,m.p.268℃~270℃;1H NMR δ:3.76~3.92(m,8H),4.50(s,1H),6.43(s,2H),6.84~7.49(m,7H),9.34(s,1H);13C NMR δ:38.16,42.68,43.58,55.13,57.36,85.58,113.30,121.69,124.02,127.73,134.47,137.88,143.03,147.22,147.55,150.53,154.97,159.50,190.21; IR ν:1 434,1 639,1 669,2 168,3 141,3 300 cm-1; MS m/z(%):407(41),295(67),272(100),236(21),187(35),135(39); HR-EI-MS m/z:Calcd for C21H18N5O2Cl[M+]407.114 9,found 407.115 4。
6c(Rf=0.74):收率89%,m.p.277℃~279℃;1H NMR δ:3.45(s,1H),3.78~3.84(m,2H),3.97~4.04(m,2H),4.69(s,1H),6.60(s,2H),7.43(d,J=8.16 Hz,1H),7.70(d,J=10.68 Hz,1H),8.28(s,1H),9.54(s,1H);13C NMR δ:38.08,43.35,44.64,55.00,104.73,120.58,123.94,138.42,139.62,148.21,148.72,149.62,151.43; IR ν:1 102,1 335,1 469,1 639,1 666,2 184,3 194,3 333 cm-1; MS m/z(%):318(7),282(100),206(13); HR-EI-MS m/z:Calcd for C13H11N6O2Cl[M+]318.063 2,found 318.063 6。
6d(Rf=0.73):收率86%,m.p.279℃~281 ℃;1H NMR δ:1.95~2.13(m,2H),3.31~3.86(m,4H),4.74(s,1H),6.53(s,2H),7.42(d,J=8.16 Hz,1H),7.66(d,J=10.74 Hz,1H),8.25(s,1H),11.54(s,1H);13C NMR δ:19.40,36.80,38.37,43.12,59.53,107.05,120.34,124.09,138.18,139.06,148.33,148.37,150.18,151.23; IR ν:1 113,1 316,1 349,1 618,1 658,2 188,3 331 cm-1; MS m/z(%):332(3),296(100),270(84); HR-EI-MS m/z:Calcd for C14H13N6O2Cl[M+]332.078 9,found 332.079 1。
6e(Rf=0.78):收率70%,m.p.268℃~270℃;1H NMR δ:1.92~2.12(m,2H),2.30(s,3H),3.30~3.72(m,4H),4.19(s,1H),6.34(s,2H),6.91(d,J=7.83 Hz,2H),7.13(d,J=7.80 Hz,2H),7.22~7.54(m,2H),7.55(s,1H),12.42(s,1H);13C NMR δ:20.39,20.83,36.66,37.58,42.32,59.48,87.12,121.44,124.24,125.99,128.56,137.33,137.62,139.27,142.37,146.83,147.61,151.99,154.10,188.74; IR ν:1 159,1 386,1 631,1 662,2 187,3 306,3 340 cm-1; MS m/z(%):405(12),285(100),205(17); HR-EI-MS m/z:Calcd for C22H20N5OCl [M+]405.135 6,found 405.135 9。
2 结果与讨论
2.1合成
(1)2的合成
在2的合成中,对文献[6]方法进行改进,结果见表1。由表1可见,2在氢氧化钠的乙醇溶液中回流反应12 h,得到一个纯净的产物,通过IR鉴定,没有所期待的羟基特征峰,而只有醚的特征峰,说明没有生成预期产物2。后改用氢氧化钠的水溶液,检测结果产物比较复杂,柱层析分离得2,产率65%。产物复杂的原因是由于溶液的碱性太大造成的。所以,换成碳酸钠水溶液时,产率达93%。
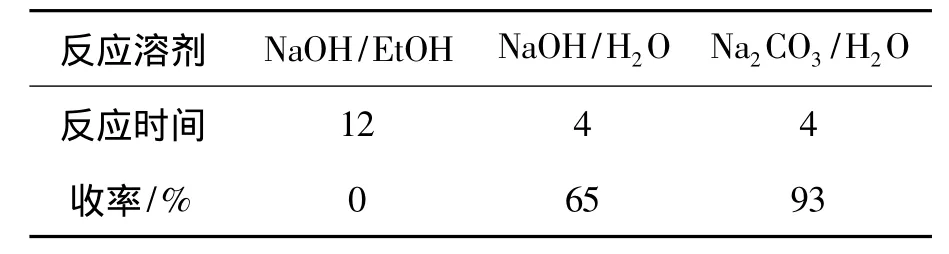
表1 水解条件对2收率的影响*Table 1 Effect of hydrolysis conditions on yield of 2
(2)3和4的合成
在3的合成中,选用PCC为氧化剂,产率87%。在4的合成中,采用无溶剂反应[8],温度严格控制在60℃。因为无溶剂反应对温度比较敏感。由于反应中使用了催化剂氯化锌,在后处理时一定要用少量的乙醇和水洗涤,以除去氯化锌杂质。
(3)6的合成
选择杂环烯酮缩胺的原因是:一方面,其分子中存在一个较大的共轭系统,即氨基-(碳-碳双键)-吸电子基团形成共轭体系。在分子中氨基的给电子作用和R基团的吸电子作用,使得碳-碳双键发生了极化,所以电子云密度向α-碳偏移,大大增加了α-碳的反应活性[11]。所以杂环烯酮缩胺是一个很好的亲核试剂。另一方面,它具有与吡虫啉类似的一些结构片断,并且一些杂环烯酮缩胺化合物及其衍生物本身还显示出一定的生理活性,已引起农药科研人员的重视。杂环烯酮缩胺和亲电试剂的反应历程[12]是:首先进行Michael加成,然后是亚胺-烯胺异构,环化反应,最终得到1,4-二氢吡啶并1,3-二氮杂环化合物6(Scheme 2)。
2.2构效关系
由Scheme 1的实验结果可知,五元环和六元环的反应活性相似。当吸电子取代基R不同时,产率由吸电子基的吸电子能力所决定。当R为硝基时产率最高,当R中有推电子基(如甲基),产率就有所下降。4与5的反应规律与杂环烯酮缩胺的性质是一致的。即当吸电子基R的吸电子能力强时,杂环烯酮缩胺分子中的α-碳的反应活性就高;当吸电子基R的吸电子能力弱时,α-碳的反应活性就降低。
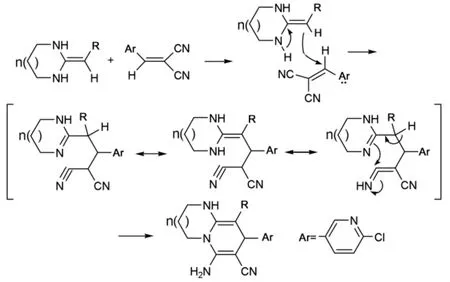
Scheme 2
3 结论
合成了5个未见报道的结构新颖的吡虫啉类化合物。一方面丰富了烟碱类杀虫剂的化合物库,另一方面研究了不同类型的杂环烯酮缩胺和相同的亲电试剂的反应机理。
在现有文献基础上,优化了合成2的反应条件,即:以Na2CO3/H2O为溶剂,回流反应4 h,收率93%。
参考文献
[1]卢伦,巨修练,葛艳丽,等.吡虫啉衍生物的合成[J].合成化学,2009,17(1):84-87.
[2]王圣印,刘永杰,周仙红,等.新烟碱类杀虫剂吡虫啉的研究进展[J].江西农业学报,2012,24(3):76-79.
[3]Nauen R,Elbert A.Resistance of Bemisia tabaci(Homoptera:aleyrodidae)to insecticides in southern Spain with special reference to neonicotinoids[J].Pest Mang Sci,2000,56(1):60-64.
[4]Gorman K,Wren J,Denholm I.Characterization of neonicotinoid resistance in Bemisia tabaci from Spain [J].Crop Sci Technol,2004,34(4):321-329.
[5]史晓斌,王鹏.吡虫啉的抗性现状及其机理研究进展[J].农药研究与应用,2010,14(2):1-3.
[6]Ganesh Pandey,Trusar D Bagul,Akhil K Sahoo.[3 +2]Cycloaddition of nonstabilized azomethine ylides.7.Stereoselective synthesis of epibatidine and analogues[J].J Org Chem,1998,63:760-768.
[7]余勇,王凯,巨修练.6-氯吡啶-3-亚甲基取代杂环化合物的合成[J].合成化学,2008,16(3):277-281.
[8]Munoz-Hernandez M A,Sannigrahi B.Five-coordinate,solvent-free aluminum cations[J].J Am Chem Soc,1999,121:6747-6748.
[9]Abdolali Alizadeh,Javad Mokhtari,Mehdi Ahmadi.Synthesis of the novel pyrimido[1,6-a]pyrimidine and imidazo[1,2-c]pyrimidine derivatives based on heterocyclic ketene aminals[J].Tetrahedron,2012,68:319-322.
[10]Yan S J,Niu Y F,Huang R,et al.Synthesis of bicyclic pyridones via cyclocondensation of heterocyclic ketene aminals with β-ketoester enol tosylates[J].Synlett,2009,(17):2821-2824.
[11]王梅祥,黄志镗.杂环烯酮缩胺反应研究新进展[J].自然科学进展,1999,9:971-973.
[12]廖江鹏.多羟基杂环烯酮缩胺的合成及杂环烯酮缩胺的反应研究[D].北京:中国科学院化学研究所,2006.
·综合评述·
Synthesis of Novel Nicotinamide Derivatives
LI Lin,MA Xiao-xiao,WANG Ke-liang,Li Jing
(Department of Chemistry and Chemical Engineering,Liupanshui Normal University,Liupanshui 553000,China)
Abstract:A key intermediate,2-[(6-chloropyridin-3-yl)methylene]malononitrile(4),was prepared by a three-step reaction of hydrolysis,oxidation and then reacting with malononitrile,using 6-chloro-3-(chloromethyl)pyridine as raw material.Five novel imidacloprid compounds were synthesized by addition-isomerization-cyclization reaction of 4 with heterocyclic ketene aminals.The structures were characterized by1H NMR,13C NMR,IR,HR-EI-MS and MS.
Keywords:imidacloprid; derivatization; drug synthesis
作者简介:李琳(1983-),女,汉族,贵州六盘水人,硕士,讲师,主要从事有机合成的研究。E-mail:jianzi20100@163.com
基金项目:贵州省科技厅科学技术基金项目{黔科合J字[2012]2307号}
收稿日期:2015-04-27
DOI:10.15952/j.cnki.cjsc.1005-1511.2015.06.0560 *
文献标识码:A
中图分类号:O626.32; R914.5

