阳离子胆固醇的合成及其基因传递性能研究
王文喜,洪 璐,蔡 婷,郑海丽,朱 淼,陈丽娜
(浙江工业大学 药学院,浙江 杭州 310014)
阳离子胆固醇的合成及其基因传递性能研究
王文喜,洪璐,蔡婷,郑海丽,朱淼,陈丽娜
(浙江工业大学 药学院,浙江 杭州 310014)
摘要:采用琥珀酸将N,N-二甲基乙二氨偶联到胆固醇上,合成新型的阳离子胆固醇衍生物——N-(N′,N′-二甲基)乙基丁二酸单胆固醇酯单酰胺(DC-CHEMS),并考察其作为基因载体的可行性.以DC-CHEMS和磷脂为膜材采用薄膜分散法制备脂质体,透射电镜显示其形态规整,粒径均匀;激光粒度测定仪测得其平均粒径为136 nm,Zeta电位为25 mV.琼脂糖凝胶电泳显示当+/-电荷比大于4∶1时,脂质体能将DNA完全结合,且能保护DNA免受DNase I酶的降解.溶血试验和MTT细胞毒性试验结果显示,所得脂质体具有较低的毒性.细胞摄取和基因转染实验表明:所得脂质体能显著促进HepG2细胞对F-ODN的摄取;当+/-电荷比为1∶1,1∶2时,基因转染效果强于市售的转染试剂Lipfectamine®2000.因此,DC-CHEMS作为基因载体,具备了高效低毒的优势,值得进一步的深入研究.
关键词:阳离子胆固醇衍生物;阳离子脂质体;基因载体
如何安全有效地将外源基因药物递送至细胞内是基因治疗广泛应用急需解决的瓶颈问题之一[1-2].非病毒载体因具有低毒、基因携载率高、免疫原性小和制备方便等优点,越来越受到国内外研究者的青睐[3].其中阳离子脂质体为研究最多且最为成熟的非病毒类载体,已有多种产品上市[4].这些阳离子脂质体主要由阳离子型脂质和胆固醇混合制备而得,由于阳离子脂质价格昂贵,合成工艺复杂,作为药物载体则不利于市场推广.为了解决这一问题,近年来有许多学者尝试在胆固醇上进行修饰,制备各种阳离子型的胆固醇衍生物用作基因载体,也获得了较高的转染效率[5-8].与脂肪烃链组成的阳离子脂质相比,胆固醇因其刚性、生物降解性及膜融合能力使复合物有更好的稳定性,在真核细胞中表达出更好的转染效率[9].其中最引人关注的是3β[N-(N,N,-二甲氨基乙烷)-氨甲酰基]胆固醇(DC-Chol),常被用作阳性对照试剂用于基因载体的研究中[10].因此,本实验通过琥珀酰基将N,N-二甲基乙二胺接到胆固醇上合成一种新的阳离子胆固醇衍生物——N-(N′,N′-二甲基)乙基丁二酸单胆固醇酯单酰胺,将其与磷脂混合制备脂质体,测定其理化性质和生物学性质,并以反义寡核苷酸和绿荧光蛋白质粒DNA为基因药物模型,考察其作为基因药物载体的可行性.
1试剂与仪器
1.1试剂
N,N-二甲基乙二胺、N-羟基琥珀酰亚胺购自于阿拉丁试剂(上海)有限公司;二环己基碳二亚胺、胆固醇购自于国药集团化学试剂有限公司;绿荧光蛋白质粒DNA和FITC-寡核苷酸购自于上海生工技术服务有限公司;磷酸盐缓冲液(PBS)、胎牛血清、胰酶和DMEM购自于吉诺生物医药有限公司;大豆卵磷脂S100购自于德国Lipoid公司;MTT购自于美国Sigma公司;其他试剂均为分析纯.
1.2仪器
ANANCEⅢ(500M)核磁共振波普仪(瑞士Bruker公司); SpectraMax M2e多功能酶标仪(美国分子仪器公司);DelsaNano激光粒度测定仪(Beckman公司);J-25型高速冷冻离心机(Beckman公司);JY92超声细胞粉碎机(宁波新芝科技研究所);311二氧化碳恒温培养箱(Thermo ELECTRON 公司);FC500MCL流式细胞仪(Beckman公司); REV-52CS旋转蒸发仪(上海亚荣生化设备仪器有限公司);JEM透射电子显微镜(日本电子公司);ECLIPSE-Ti显微镜(Nikon公司).
2实验方法
2.1DC-CHEMS的合成与表征
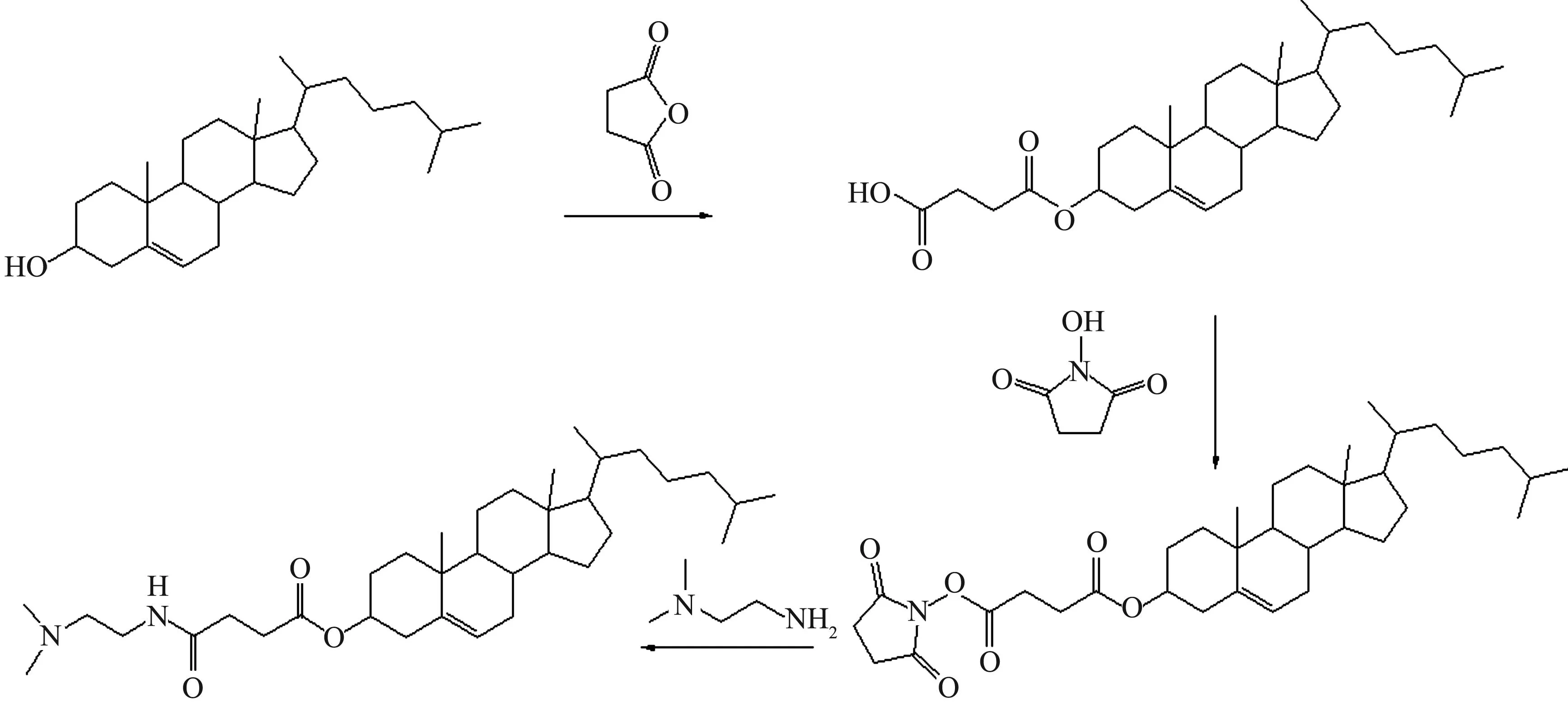
将5 g胆固醇、4 g丁二酸酐、150 mL四氢呋喃和40 mL三乙胺置于圆底烧瓶中,80 ℃回流搅拌48 h.反应结束后,40 ℃旋转蒸干,所得的固体溶解在60 mL无水乙醇中,加入100 mL蒸馏水快速搅拌,冰水浴析出白色固体,抽滤得粗产物胆固醇琥珀酸单酯(CHEMS).采用丙酮重结晶法纯化CHEMS,N-羟基琥珀酰亚胺(NHS)活泼酯法活化CHEMS上的羧基形成活泼酯.0.5 g活泼酯溶于20 mL二氯甲烷中形成溶液A,冰水浴准备.120 μL N,N-二甲基乙二胺溶于10 mL预冷的二氯甲烷中形成溶液B.将溶液B逐滴加入到溶液A中,冰水浴反应1 h.反应结束后,常温旋干,加3 mL异丙醇溶解固体,冰水浴使初产物析出,所得固体用乙醚纯化,真空抽干乙醚,得产物,通过薄层色谱法、核磁共振法和质谱法对该产物进行表征.其合成路线为
2.2DC-CHEMS脂质体的制备与表征
采用薄膜分散法制备脂质体.称取适量的摩尔比为2∶1的大豆卵磷脂S100和DC-CHMES,溶于10 mL氯仿中,30 ℃真空旋转蒸干,加5 mL 磷酸缓冲液(PBS)摇晃,待梨型瓶壁上的薄膜消失,再置于37 ℃水浴锅中水化2 h.探头超声200次(超声功率400 W,工作时间2 s,间歇2 s),得磷脂终质量浓度为10 mg/mL的脂质体[11].
脂质体适当稀释后,用透射电子显微镜观察其形态,并用纳米粒径仪测定脂质体的粒径及Zeta电位.
2.3脂质体与质粒DNA结合率以及保护DNA能力的测定
采用琼脂糖凝胶电泳阻滞实验来判断脂质体/质粒DNA复合物的形成情况.配制脂质体5个梯度,控制+/-电荷比分别为1∶1,2∶1,4∶1,8∶1,16∶1.取质粒DNA 10 μL(100 μg/mL)和样品5 μL 37 ℃孵育0.5 h,以同质量浓度的纯质粒DNA作对照组.取15 μL样品与3 μL 6×DNA电泳加样缓冲液混匀,将各样品上样于0.8%的琼脂糖凝胶电泳上样孔中,140 V,20 min,置于紫外灯下观察,并用凝胶成像系统拍照保存.
采用同样的方法来考察脂质体保护DNA的能力.配制3个梯度的脂质体,控制+/-电荷比分别为2∶1,4∶1,8∶1.取质粒DNA10 μL和样品5 μL于37 ℃孵育0.5 h,另取相同量的质粒DNA加5 μL PBS稀释.每份样品加5 μL DNaseI酶(2.5 U/μL)置37 ℃恒温水浴20 min.将样品转移到80 ℃水浴中放置5 min灭活DNaseI酶,再加2 μL体积分数为10%的Triton X-100溶液破坏脂质体[12].以同质量浓度的质粒DNA作为对照组.将各样品上样于0.8%的琼脂糖凝胶电泳,140 V,20 min,置于紫外灯下观察,并用凝胶成像系统拍照保存.
2.4溶血试验
用生理盐水配置2%大鼠血红细胞悬液.按表1配比生理盐水和脂质体,轻轻混合均匀,置37 ℃水浴锅中1 h,3 000 r/min离心5 min,取上清液2 mL,加10% Triton X-100溶液0.3 mL破乳.在550 nm下测吸光度.以生理盐水组离心前加曲拉通样品为阳性对照,生理盐水组离心得上清液加Triton X-100样品为阴性对照,计算溶血百分率为
溶血百分率=(A样品-A2)/(A1-A2)×100%
式中:A样品为样品的吸光度;A2为阴性对照组吸光度;A1为阳性对照组吸光度.
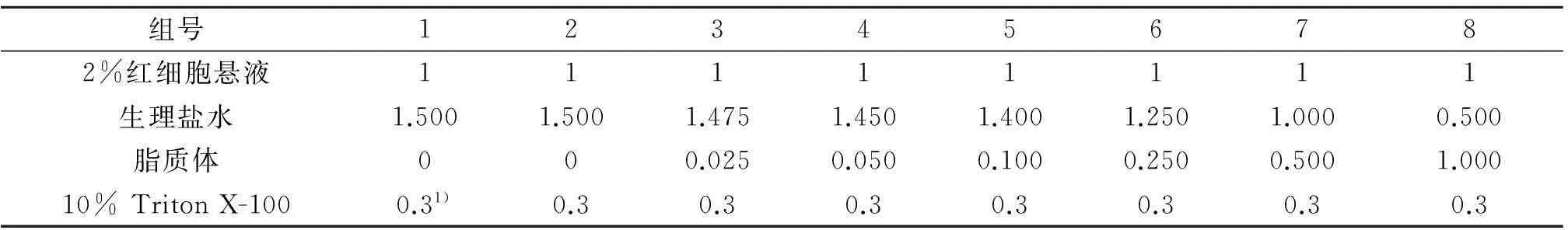
表1 不同质量浓度脂质体溶血试验
注:1) 为离心前加Triton X-100,其余为离心后加.
2.5细胞毒性
采用溴化四氮唑比色法(MTT Assay)测定阳离子脂质体的细胞毒性[13].取对数生长期的HepG2细胞,接种于96孔板中(5×103个/孔),于37 ℃,5% CO2培养箱中培养过夜.每孔加入150μL DMEM稀释的空白DC-CHEMS脂质体,其磷脂质量浓度分别为0.01,0.25,0.5,0.1,0.2 mg/mL,每个质量浓度设置6个副孔.置培养箱中培养5 h后,每孔加入20 μL MTT溶液(5 mg/mL),再继续培养4 h.小心吸弃培养基,每孔加入150 μL二甲基亚砜,平行摇动使甲瓒晶体溶解并测量其在490 nm处的吸光值,计算细胞存活率为
细胞存活率=A490样品/A490对照×100%
式中:A490样品为不同磷脂质量浓度样品的吸光度;A490对照为对照孔的吸光度.
2.6脂质体对F-ODN在HepG2细胞摄取的促进作用
将呈对数生长的HepG2细胞胰酶消化后,以5×103个/孔的密度接种于96孔板中培养过夜.分别按+/-电荷比1∶1,4∶1,8∶1,16∶1制备含荧光标记的寡核苷酸(F-ODN)脂质体复合物.用无血清DMEM培养基稀释,控制寡核苷酸终质量浓度为1μg/mL,同时设立单用寡核苷酸和Lipofectamine®2000(加入量按说明书上配置)做对照.倾去培养液,每孔加入150 μL脂质体复合物,每个比例设3个副孔.5 h后,吸除上清液,200 μL/孔PBS洗3次,加40 μL胰酶消化2~3 min,加40 μL血清终止消化,离心,收集细胞,经流式细胞仪检测细胞的阳性染色率以及细胞内平均荧光强度,以两者的乘积作为胞内荧光总量.每份样品分析的细胞数为104个.
2.7脂质体的基因转染效率
将呈对数生长的HepG2细胞胰酶消化后,以5×103个/孔的密度接种于96孔板中培养过夜.分别按+/-电荷比1∶8,1∶4,1∶2,1∶1,4∶1制备带有绿荧光基因的质粒DNA脂质体.用无血清培养基稀释,控制质粒DNA质量浓度为1 μg/mL,同时设立单用质粒DNA和Lipofectamine®2000(加入量按说明书上配置)做对照.倾去培养液后,每孔加入150 μL稀释后的脂质体复合物,每个比例设3个副孔.5 h后,去除培养基,换成质量分数为10%的血清完全培养基培养48 h,用荧光显微镜进行荧光拍照.
3结果与讨论
3.1DC-CHEMS的表征
图1(a)为DC-CHEMS的质谱图,从图1可看出:在质荷比m/z为557.5[M+H+]处有一个很大的峰,该峰为DC-CHEMS的质子化物.图1(b)为的DC-CHEMS的1H NMR(CDCl3,500 MHz)谱图.化学位移δ0.64~1.49,δ4.56~4.59,δ5.35是胆固醇上的特征峰.δ2.67是—N(CH3)2的特征峰,δ2.47是—NHCH2CH2N(CH3)2的特征峰.

图1 DC-CHEMS的质谱图和1H核磁共振图Fig.1 Mass Spectrometryand 1H NMR spectra of DMAPA-CHEMS
3.2DC-CHEMS脂质体的表征
激光粒度测定仪测定DC-CHEMS脂质体在pH7.2的PBS中的Zeta电位为25.37 mV,为阳离子脂质体.图2显示了脂质体粒径分布情况,从图2可以看出:脂质体的大小较为均一,呈较好的正态分布,平均直径为136 nm.图3是为磷钨酸负染后脂质体的透射电镜图,从图3可看出:脂质体形态较规整,几乎都呈圆形,而且颗粒大小较均一,与激光粒度仪所测得的粒径相近.
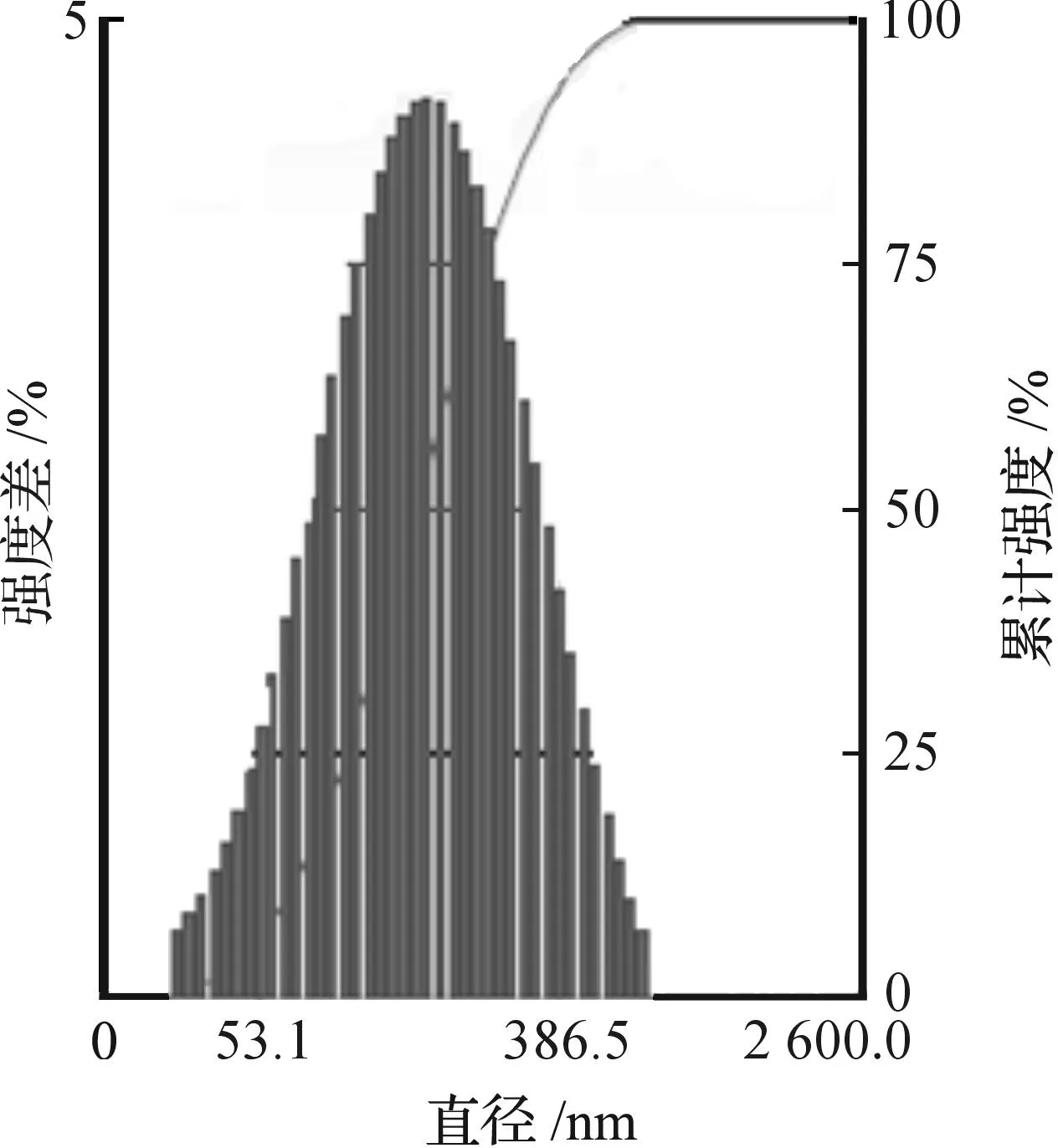
图2 DC-CHEMS脂质体粒径分布Fig.2 The size distribution of liposomes

图3 DC-CHEMS脂质体透射电镜图Fig.3 Transmission electron micrograph images of liposomes
3.3脂质体与质粒DNA结合率以及保护DNA能力的测定
DNA脂质体复合物的琼脂糖凝胶电泳结果如图4所示,从图4可看出:当+/-电荷比较低时,只有部分质粒DNA被阻滞在点样口,随着+/-电荷比的升高,结合在加样孔的质粒逐渐增加,加样孔上方琼脂糖胶面上的条带逐渐减弱.当+/-电荷比超过4∶1时,DNA全部被阻滞在加样孔,胶面上观察不到亮条带,说明在+/-电荷比大于4∶1时DC-CHEMS脂质体与质粒DNA能完全结合.

1—纯质粒;2~6—分别表示+/-电荷比为16∶1,8∶1,4∶1,2∶1,1∶1图4 DC-CHEMS脂质体与质粒DNA结合率实验Fig.4 Agarose gel electrophoresis of DC-CHEMS liposomes/pDNA complexes
为了考察脂质体对DNA的保护作用,将DNA脂质体复合物与DNaseI酶作用20 min,再加曲拉通破坏脂质体,使DNA游离后电泳,结果见图5.从图5可看出:游离的质粒DNA与DNaseI酶作用20 min后,已被全部降解,与对照组相同位置处已无条带,而脂质体复合物组在相应位置处有类似对照组的强量条带,说明DC-CHEMS脂质体能有效地质粒DNA使其免受DNaseI酶的降解.

1—纯质粒;2—质粒+酶,作用时间20 min;3~5—分别表示+/-电荷比为8∶1,4∶1,2∶1图5 DC-CHEMS脂质体保护DNA能力Fig.5 pDNA protection from DNase I by DC-CHEMS liposmes
3.4细胞溶血试验
阳离子型两亲性物质常具有较强的细胞膜破坏作用而呈现较大的毒性[14-15].为此,首先通过测量抗红细胞破裂实验来评价DC-CHEMS脂质体的细胞毒性,结果如图6所示.从图6可看出:即使当脂质的终质量浓度高达4 mg/mL,脂质体的溶血百分率小于2%.说明所得脂质体没有溶血作用,细胞毒性较小[16].
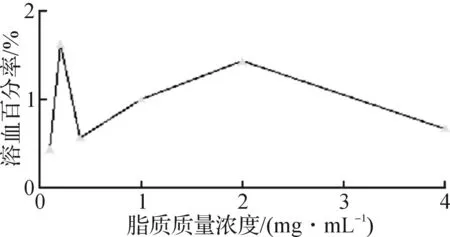
图6 DC-CHEMS脂质体的溶血性能Fig.6 Hemolytic activity of DC-CHEMS liposomes
3.5细胞毒性评价
采用MTT法测得各种质量浓度脂质体对HepG2细胞的毒性结果如图7所示,在磷脂质量浓度小于0.2 mg/mL时,HepG2细胞存活率几乎都为100%,说明DC-CHEMS具有很低的细胞毒性.因此,在摄取与转染实验中,将磷脂质量浓度控制在这一范围之内即可.
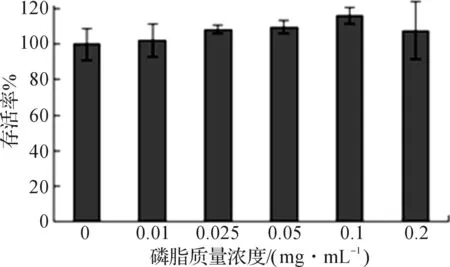
图7 DC-CHEMS脂质体的细胞毒性Fig.7 Cell toxicity of DC-CHEMS liposomes
3.6脂质体对F-ODN在HepG2细胞摄取的促进作用
HepG2细胞与F-ODN脂质体复合物共同孵育5 h后,收集3个平行孔细胞合成1管,用流式细胞仪测定带荧光的阳性细胞率和胞内平均荧光强度,将两者的乘积作为细胞内荧光总量,考察脂质体用量对细胞内荧光总量的影响,如图8所示.结果发现:DC-CHEMS脂质体各质量浓度组的胞内荧光总量远高于市售转染试剂Lipofectamine®2000对照组,+/-电荷比为1∶1的F-ODN脂质体复合物组的荧光总量为Lipofectamine®2000对照组的3倍多.
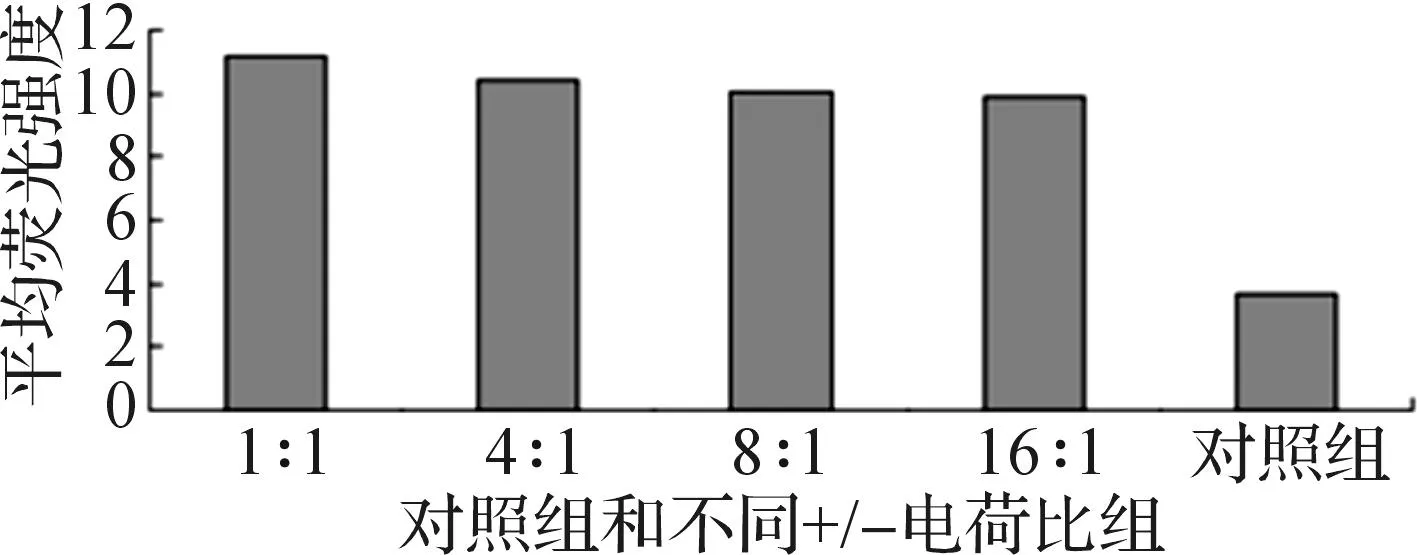
图8 DC-CHEMS脂质体细胞摄取Fig.8 Cells uptake of DC-CHEMS liposomes
3.7脂质体的转染效果
进入细胞只是基因药物要发挥作用的第一步,入胞后的命运及细胞内的分布对基因转染至关重要.因此,一个良好的基因载体不仅能促进基因的入胞,更重要的是能有效地控制基因在细胞内的释放和转运[17-18].为了评价DC-CHEMS所制脂质体作为基因载体的可行性,采用绿荧光蛋白质粒DNA为报告基因,考察其转染效果.结果发现,在缺乏DOPE等辅助磷脂的情况下,虽然DC-CHEMS脂质体的细胞摄取较好,但基因转染效率较低,与Koynova等研究结果类似[19].将磷脂换成DOPE后制备DC-CHEMS脂质体,结果发现转染效率显著提高,各种电荷比DC-CHEMS脂质体表现出的转染活性要高于DC-Chol脂质体对照组,如图9所示.从图9中可看出:当脂质体的质量浓度较低时(+/-电荷比1∶8),细胞内的荧光强度较弱,随着脂质体质量浓度的增加,细胞内的荧光强度显著增加.当+/-电荷比为1∶2和1∶1时,DC-CHEMS脂质体组表现了很高的转染效率,细胞内的荧光强度超过了Lipfectamine®2000对照组.继续增加脂质体的量,其转染效率反而下降,这可能是由于内吞饱和所致.当脂质体过多时,有一部分复合物没有机会与细胞作用,使得这部分复合物上的质粒DNA或寡核苷酸不能进入到细胞.

图9 脂质体复合物的细胞转染Fig.9 Transfection efficiency of GFP-pDNA complexed with liposomes
4结论
采用N-羟基琥珀酰亚胺活化胆固醇琥珀酸单酯能将N,N-二甲基乙二胺接到胆固醇上合成一种新的阳离子胆固醇衍生物——DC-CHEMS,将其和磷脂混合可制得性能良好的阳离子脂质体.该阳离子脂质体具有较低的溶血性和细胞毒性,对DNA有很强的包裹能力并能保护DNA免受核酸酶的降解,能显著地促进DNA的入胞,提高基因转染效率,基因转染效率可高于含酯酰基DC-CHOL脂质体和市售基因转染试剂Lipfectamine®2000,故为一个极有发展前途的非病毒类基因载体.
参考文献:
[1]SHIRAZI R S, EWERT K K, LEAL C,et al.Synthesis and characterization of degradable multivalent cationic lipids with disulfide-bond spacers for gene delivery[J].Biochimica et Biophysica Acta, 2011, 1808(9):2156-2166.
[2]王文喜,代凯,唐岚.八聚精氨酸修饰的载ASODN脂质体的构建及体外评价[J].浙江工业大学学报,2014,42(3):334-337.
[3]SHIM G, KIM M, PARK J Y, et al.Application of cationic liposomes for delivery of nucleic acids[J].Asian journal of pharmaceutical sciences, 2013, 8(2):72-80.
[4]RADCHATAWEDCHAKOON W, WATANAPOKASIN R, KRAJARNG A, et al.Solid phase synthesis of novel asymmetric hydrophilic head cholesterol-based cationic lipids with potential DNA delivery[J].Bioorganic & Medicinal Chemistry, 2010, 18(1):330-342.
[5]SINGHM,BORAINJ,NOOR-MAHOMEDN,etal.Theeffectofpegylationonthetransfectionactivityoftwohomologouscationiccholesterylcytofectins[J].AfricanJournalofBiotechnology, 2011, 10(8):1400-1407.
[6]DORASAMYS,NARAINPERSADN,SINGHM,etal.Noveltargetedliposomesdeliversirnatohepatocellularcarcinomacellsinvitro[J].ChemicalBiology&DrugDesign, 2012, 80(5):647-656.
[7]NARAINPERSADN,SINGHM,ARIATTIM.Novelneoglycolipid:formulationintopegylatedcationicliposomesandtargetingofDNAlipoplexestothehepatocyte-derivedcelllineHepG2[J].NucleosidesNucleotidesNucleicAcids, 2012, 31(3):206-223.
[8]SEWBALASA,ISLAMRU,ARBUTHNOTP,etal.EnhancementoftransfectionactivityinHEK293cellsbylipoplexescontainingcholesterylnitrogen-pivotedaza-crownethers[J].MedicinalChemistryResearch, 2013, 22(6):2561-2569.
[9]LIL,NIEY,ZHUR,etal.Preparationandgenedeliveryofalkalineaminoacids-basedcationicliposomes[J].ArchivesofPharmacalResearch,2008,31(7):924-931.
[10]KEARNSMD,PATELYN,SAVVAM.Physicochemicalcharacteristicsassociatedwithtransfectionofcationiccholesterol-basedgenedeliveryvectorsinthepresenceofDOPE[J].ChemistryandPhysicsofLipids, 2010, 163(8):755-764.
[11]程序,宋必卫,张春丽,等.含气脂质体的超声波介导体外基因输送的实验研究[J].浙江工业大学学报,2010,38(5):503-507.
[12]YUB,TANGC,YINC.Enhancedantitumorefficacyoffolatemodifiedamphiphilicnanoparticlesthroughco-deliveryofchemotherapeuticdrugsandgenes[J].Biomaterials, 2014, 35(24):6369-6378.
[13]唐岚,赵亚,单海峰,等.甜瓜蒂中葫芦素类成分分离及体外抗癌活性研究[J].浙江工业大学学报,2012,40(4):388-391.
[14]PAECHAROENCHAIO,NIYOMTHAMN,LEKSANTIKULL,etal.Nonionicsurfactantvesiclescomposedofnovespermine-derivativecationiclipidsasaneffectivegenecarrierinvitro[J].AmericanAssociationofPharmaceuticalScientists, 2014, 15(3):722-730.
[15]NIEY,JIL,DINGH,etal.Cholesterolderivativesbasedchargedliposomesfordoxorubicindelivery:preparation,invitroandinvivocharacterization[J].Theranostics, 2012, 2(11):1092-1103.
[16]PAECHAROENCHAIO,NIYOMTHAMN,LEKSANTIKULL,etal.Nonionicsurfactantvesiclescomposedofnovelspermine-derivativecationiclipidsasaneffectivegenecarrierinvitro[J].AmericanAssociationofPharmaceuticalScientists,2014,15(3):722-730.
[17]SUNXY,WEILL,CHENHL,etal.Advancesinthestudyoforganellestargetingnanocarriers[J].ActaPharmacologicaSinica, 2009, 44(8):838-844.
[18]DOMINSKAM,DYKXHOORNDM.Breakingdownthebarriers:SiRNAdeliveryandendosomeescape[J].JournalofCellScience, 2010, 123(8):1183-1189.
[19]KOYNOVAR,TENCHOVB.Cationiclipids:molecularstructure/transfectionactivityrelationshipsandinteractionswithbiomembranes.[J].TopicsinCurrentChemistry, 2010, 296:51-93, 2010, 296:51-93.
(责任编辑:陈石平)
Synthesis and characterization of a novel cationic
cholesterol derivatives for gene delivery
WANG Wenxi, HONG Lu, CAI Ting, ZHENG Haili, ZHU Miao, CHEN Lina
(College of Pharmaceutical Science,Zhejiang University of Technology,Hangzhou 310014,China)
Abstract:To synthesis and evaluate the feasibility as a gene carrier of a novel cationic cholesterol derivative , N,N-dimethylethylenediaminyl succinyl cholesterol (DC-CHEMS), which N,N-Dimethyl-1,2-ethanediamine was coupled to cholesterol by Succinate. The liposome was made of DC-CHEMS and phosphatide by film dispersion method, which showed sphere and uniform morphology under transmission electron microscopy( TEM). The size of liposome was 136 nm and Zeta potential was 25 mV determined by a laser particulate size analyser. Agarose gel electrophoresis demonstrated that the liposome could condense and protect plasmid DNA completely when the +/- charge ratio was more than 4∶1.The results of hemolysis test and MTT test showed that liposome was low toxic. Cellular uptake and gene transfeciton experiments showed that the liposome could enhance the uptake of F-ODN in HepG2 cells significantly ; when +/-charge ratio was 1∶1 or 1∶2, the gene transfection efficiency was stronger than the commercially available transfection reagent Lipfectamine®2000.Therefore, DC-CHEMS has the advantage of high efficiency and low toxicity as a gene carrier and is worthy of further research.
Keywords:cationic cholesterol derivatives ; cationic liposomes; gene carrier
文章编号:1006-4303(2015)04-0383-06
中图分类号:R944
文献标志码:A
作者简介:王文喜(1977—),男,浙江苍南人,副教授,博士,硕士生导师,主要从事新型给药系统研究,E-mail:yjw@zjut.edu.cn.
基金项目:国家自然科学基金资助项目(81102396)
收稿日期:2015-01-30