奶牛乳房炎金黄色葡萄球菌裂解性噬菌体裂解酶LysIMEP5基因的克隆及序列分析
张倩,张湘莉兰,孙耀强,于会举,张培生,刘鸽,屈勇刚*,童贻刚*,李岩
(1.石河子大学动物科技学院,新疆石河子 832003;2.军事医学科学院微生物流行病研究所,北京 100071;3.新疆生产建设兵团畜牧兽医工作总站,乌鲁木齐 830063)
奶牛乳房炎金黄色葡萄球菌裂解性噬菌体裂解酶LysIMEP5基因的克隆及序列分析
张倩1,张湘莉兰2,孙耀强1,于会举1,张培生1,刘鸽1,屈勇刚1*,童贻刚2*,李岩3
(1.石河子大学动物科技学院,新疆石河子 832003;2.军事医学科学院微生物流行病研究所,北京 100071;3.新疆生产建设兵团畜牧兽医工作总站,乌鲁木齐 830063)
为了克隆奶牛乳房炎金黄色(葡萄球菌裂解性噬菌体裂解酶LysIMEP5基因,分析其生物信息学特性,以本实验室分离的奶牛乳房炎金黄色葡萄球菌裂解性噬菌体vB_SauS_IMEP5 为材料,根据其全基因组学信息,获取裂解酶基因序列,应用Primer 5.0设计特异性引物。采用PCR方法扩增并克隆LysIMEP5基因,通过BLAST进行序列比对分析,利用在线软件对蛋白结构进行预测。成功克隆到裂解酶LysIMEP5基因,测序结果通过DNAMAN比对与原序列完全匹配,无任何基因突变,同源性分析显示,与已报道的金黄色葡萄球菌噬菌体裂解酶相似性最高为83.1% ;裂解酶LysIMEP5 基因序列全长1371 bp,共编码456个氨基酸,为亲水性蛋白,分子质量为51.717 kDa,理论等电点为9.70; LysIMEP5同时存在CHAP片段和Amidase-3片段;该蛋白无跨膜区,无信号肽,以无规则卷曲为主。从奶牛乳房炎金黄色葡萄球菌裂解性噬菌体中成功克隆出LysIMEP5基因,通过对该蛋白的结构预测分析为后续克隆表达及开发新型绿色抑菌剂奠定了基础。
奶牛乳房炎;金黄色葡萄球菌噬菌体;裂解酶;克隆;蛋白结构
噬菌体裂解酶(Bacteriophage lysins)是噬菌体在感染细菌后期表达的一类细胞壁水解酶,可分解宿主菌细胞壁肽聚糖上的酰胺键或肽内氨基酸残基间的连接键,故这类酶又被称为内溶素或溶胞壁酶,为双链噬菌体独有[1]。因其作用于细菌细胞壁的肽聚糖,破坏细菌的保护层可作为一种特殊的生物杀菌物,有着其他化学药物所没有的优势:专一性强、安全性高、高效快速、基因修饰简单。裂解酶已作为一种新型杀菌制剂被广泛运用于化脓链球菌、肺炎链球菌、金黄色葡萄球菌感染的治疗[2-4]。由于裂解酶专一性强,不易产生耐药性的特点和如今滥用抗生素的现状,裂解酶作为新型抗菌药物的研发越来越受到科研工作者的关注,尤其是对裂解酶裂解耐药菌株及不宜治疗的细菌性感染病原体的研究。有些研究者还基于此研究方向进行了基础应用研究,例如对裂解酶结构蛋白的预测研究[5-7]与裂解酶相关的穿孔素分子作用机制的研究[8]。噬菌体裂解酶在结构上具有相似性,均含有两个结构域,即一个决定该酶催化活性的N-端结构域(催化域)和一个决定细胞结合位点的C端结构域,它们之间由一个小片段连接。同一类裂解酶的催化域高度保守,而细胞结合域可变。这表明裂解酶的结合域的特殊糖类是决定噬菌体特异性的关键。因此,裂解酶作为新型抗菌药物具有一定的优势。近年来的研究使人们对噬菌体裂解酶的结构特征、抗菌机制及抗菌活性等有了一定的认识。目前国内外已有一些利用噬菌体裂解酶作为新型抗菌药物的试验及其成果的报道。Loeffler等[3]研究发现噬菌体裂解酶Pal可在体外高效裂解15种常见类型的肺炎链球菌,包括青霉素抗性菌株。Gong等[9]从肠球菌噬菌体中分离出能有效地杀死肠球菌(包括抗万古霉素的菌株)的一种溶菌酶lysefm5。本研究拟以奶牛乳房炎金黄色葡萄球菌噬菌体的基因组为模板,设计特异引物扩增裂解酶基因并构建裂解酶克隆菌株,结合裂解酶蛋白的结构功能预测与分析,为裂解酶的表达纯化及生产应用奠定基础。
1 材料和方法
1.1 菌株和质粒 奶牛乳房炎金黄色葡萄球菌噬菌体vB_SauS_IMEP5由本实验室分离、纯化、鉴定并由北京军事医学科学院微生物流行病研究所测序;大肠杆菌DH5a,北京全式金生物公司;pMD19-T,宝生物(大连)工程有限公司(TaKaRa)。
1.2 试剂和仪器 限制性核酸内切酶XhoⅠ和EcoRⅠ, SolutionⅠ和核酸提取试剂盒,宝生物(大连)工程有限公司(TaKaRa),Trans5K DNA Marker,北京全式金生物公司,质粒小提试剂盒和凝胶回收试剂盒,天根生化科技(北京)有限公司,氨节青霉素(Amp),北京鼎国生物工程公司;CR22E高速冷冻离心机(HITACHI),日立公司,PCR扩增仪,Bio-Rad公司,电泳凝胶成像仪,PhotoFilm 公司。
1.3 引物的设计与合成 根据奶牛乳房炎金黄色葡萄球菌噬菌体vB_SauS_IMEP5全基因序列分析的结果,针对其裂解酶基因序列,应用Primer5.0设计特异性引物,并在引物中包引入XhoⅠ和EcoRⅠ两个酶切位点,扩增片段长度为1371 bp。引物由北京六合华大基因科技股份有限公司合成,引物序列为:
LysIMEP5-F:5-CGGAATTCATGGCAGTTACAAAAACAAAAGC-3',
LysIMEP5-R:5'-CCCTCGAGTTATTTCTTCCACTTAATCTTGCC-3'
1.4 噬菌体vB_SauS_IMEP5基因组的提取 将实验室保存的噬菌体vB_SauS_IMEP5接种于已装有宿主菌的LB液体培养基中,37℃、180 r/min 摇床培养6~8 h,10000 r/min 离心10 min 取上清,参照病毒核酸提取试剂盒说明书提取噬菌体vB_SauS_IMEP5基因组DNA。提取的DNA保存于-20℃备用。
1.5 目的基因的克隆
1.5.1 目的片段PCR的扩增 以噬菌体vB_SauS_IMEP5的基因组DNA为模板,LysIMEP5-F和LysIMEP5-R为上下游引物扩增目的片段。PCR反应体系为20 μL:模板2 μL,上下游引物各1 μL,LA Taq 酶0.2 μL,10×LA buffer 2 μL, dNTP 2 μL,ddH2O 11.8 μL。PCR反应条件为:95℃ 5 min;95℃ 45 s,57.5℃ 1 min作用30 s,72℃1 min作用30 s,30个循环;72℃ 10 min。取8 μL PCR产物经1.0%的琼脂糖凝胶电泳检测结果。
1.5.2 目的片段与克隆载体的连接 将目的基因PCR回收产物与pMD-19T Vector 连接。 PCR扩增产物经琼脂糖凝胶DNA回收试剂盒回收;连接体系为:胶回收产物5 μL,SolutionⅠ4.5 μL,pMD19-T载体0.5 μL,总体积10 μL,16℃连接过夜。
1.5.3 重组质粒的转化 取一管大肠杆菌DH5a感受态细胞,放置于冰盒中完全溶解,并将10 uL 16℃连接过夜的连接产物加入其中,混匀,封口,冰浴30 min。42℃水浴热激90 s,立即冰浴5 min,加入800 μL无抗LB液体培养基,置于摇床中,37℃震荡培养1 h,离心8000 r/2 min弃上清,留约200 μL吹打混匀后均匀涂布在含Amp的LB固体培养基上,37℃培养箱倒置培养过夜,次日观察结果,阳性克隆为白色半透明菌落。
1.5.4 重组质粒的PCR检测与保菌 从转化板中挑取白色单个菌落,接种于已有800 μL的抗Amp的EP管中,同时做一个对照只加未挑菌的枪头于抗Amp的EP管中, 37℃摇床3~4 h,以该菌液为模板进行PCR检测。PCR产物经1.0%的琼脂糖凝胶电泳检测。检测阳性的菌用20%的甘油保菌。
1.5.5 重组质粒的提取与验证 取PCR检测阳性的重组菌液200 μL接种于20 mL的抗Amp的LB 液体培养基中,37℃过夜培养,将培养物严格按照质粒提取试剂盒的操作步骤进行质粒的提取。将提取的重组质粒用XhoⅠ和EcoRⅠ双酶切,酶切体系为20 μL:质粒10 μL,ddH2O 6 μL,Buffer 2 μL,XhoⅠ和EcoRⅠ各1 μL。瞬离后,37℃水浴4 h,取10 μL酶切产物经1.0%的琼脂糖凝胶电泳检测,同时将质粒送于北京六合华大基因科技股份有限公司测序,对测序结果进行同源性分析。
1.6 裂解酶的蛋白结构预测
1.6.1 跨膜区域预测 利用TMHMM v2.0服务器(http://www.cbs.dtu.dk/services/TMHMM/)对蛋白的跨膜区域进行预测,并结合 Prot Scale 程序(http://web.expasy.org/protscale/)在线预测蛋白质疏水性的结果判断跨膜区域的可信度。
1.6.2 信号肽预测 信号肽的预测采用Signal P4.1服务器(http://www.cbs.dtu.dk/services/SignalP/)在线预测该裂解酶的信号肽[10]。
1.6.3 二级结构预测 使用DNASTAR软件的protean功能对裂解酶蛋白的一维氨基酸序列特性进行预测,同时使用 SSPro 4.0 服务器预测裂解酶的二级结构[11]。
1.6.4 三级结构预测 使用在线软件SWISS-MODEL 服务器搜索与目的蛋白序列相匹配的模板,然后利用该模板构建三级结构[12]。
2 结果与分析
2.1 目的基因的扩增 以噬菌体vB_SauS_IMEP5的基因组为模板进行目的片段的扩增,PCR产物经1.0%的琼脂糖凝胶电泳检测得到1371 bp的目的片段,与预期片段大小一致,而阴性对照组无条带。结果如图1。
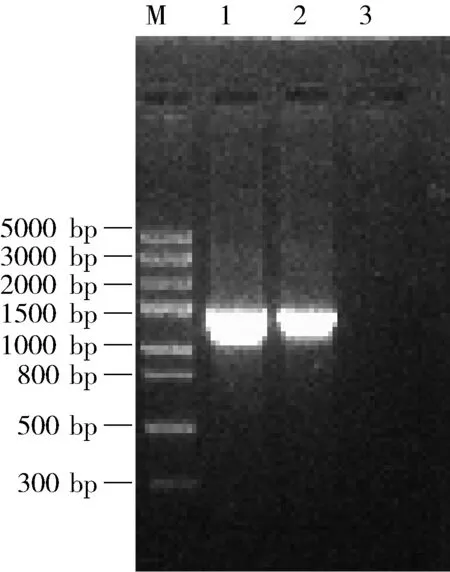
M:DNA Marker(DL5000); 1、2: LysIMEP5扩增产物; 3: 阴性对照图1 LysIMEP5 的PCR扩增结果
2.2 重组质粒pMD19T-LysIMEP5的PCR检测和双酶切鉴定 从转化板挑取的白色菌落经PCR和XhoⅠ、EcoRⅠ双酶切鉴定,均得到了与其基因大小一致的目的片段,说明克隆载体pMD19T-LysIMEP5构建成功。结果如图2。
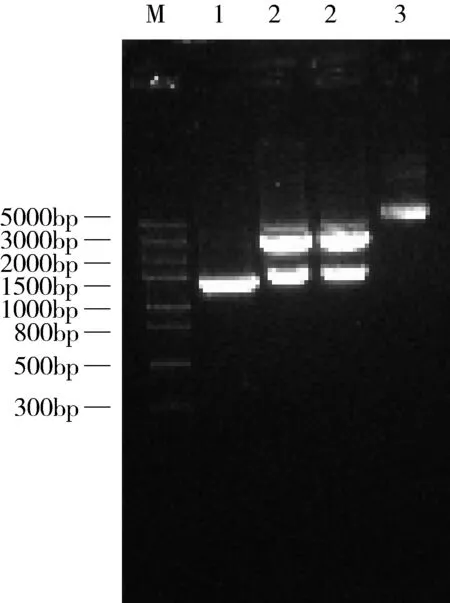
M:DNA 分子量标准准(DL5000),1、2、3:PCR鉴定、重组质粒的酶切鉴定、pMD19T-LysIMEP5重组质粒图2 重组质粒pMD19T-LysIMEP5的PCR与酶切鉴定
2.3 重组克隆质粒的测序及同源性分析 应用 NCBI 的在线软件基本局部比对搜索工具 BLAST 对测序结果进行同源性分析[13],获得相近裂解酶基因的序列和他们与该基因的同源性分析结果并利用DNAStar的MegAlign建立矩形图。测序结果表明,去除酶切位点和保护性碱基,测得的重组质粒序列与原基因序列完全匹配,无任何基因突变。同源性分析结果显示,LysIMEP5与已报道的金黄色葡萄球菌噬菌体裂解酶核苷酸序列相似性不高,编码蛋白质的氨基酸序列的相似性也不高,其中只有Lytic enzyme, amidase (plasmid)(登录号为ACZ59017.1)与LysIMEP5的同源性最高,为83.1%。BLST序列比对发现,该蛋白分子具有酰胺酶特性,能裂解细菌细胞壁的N-乙酰基和L-氨基酸之间的酰胺键。如图4所示,25~113aa属于酰胺酶家族 (NI_PC_P60 superfaimly)成员,170~347aa属于肽聚糖水解酶家族(MurNAC-LAA superfaimly)成员。该裂解酶中175~319aa为裂解酶的催化活跃区,175~255aa为金属离子结合区。
2.4 裂解酶的蛋白结构预测 使用在线工具TMHMM2.0对裂解酶氨基酸序列进行跨膜预测分析,结果显示此裂解酶蛋白无跨膜螺旋,裂解酶蛋白均处于膜外,不存在跨膜结构(图5A)。疏水最大值是1.467,最小值是-2.911,但大部分氨基酸属于亲水性氨基酸,可见该蛋白属于亲水性蛋白(图5B)。Signal P 4.0 预测结果如图5C所示,图中 C-score 表示剪切位点分值,S-score表示信号肽分值,Y-score 表示综合剪切点分值。信号肽剪切位点预测通过 Y 最大值来判断,是否为分泌蛋白通过 S 平均值来判断,若 S 平均值>0.5,则预测为分泌蛋白,存在信号肽,由此可以判断,裂解酶编码的蛋白不存在信号肽。
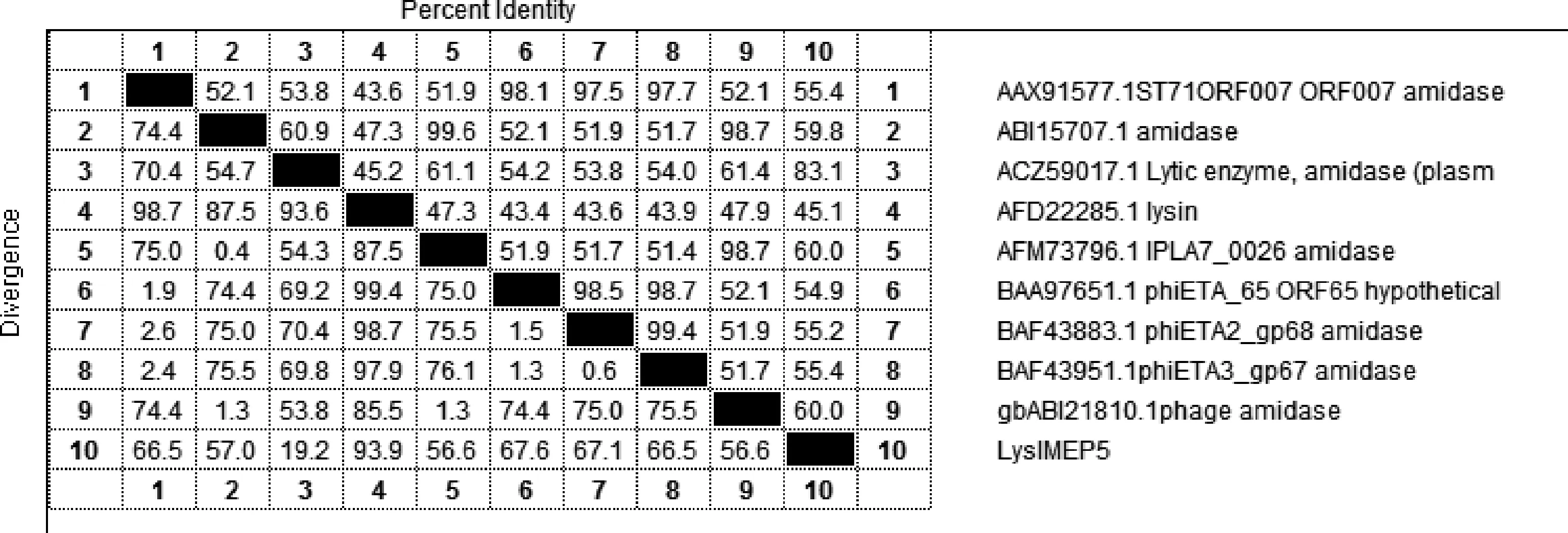
图3 裂解酶 LysIMEP5矩形图
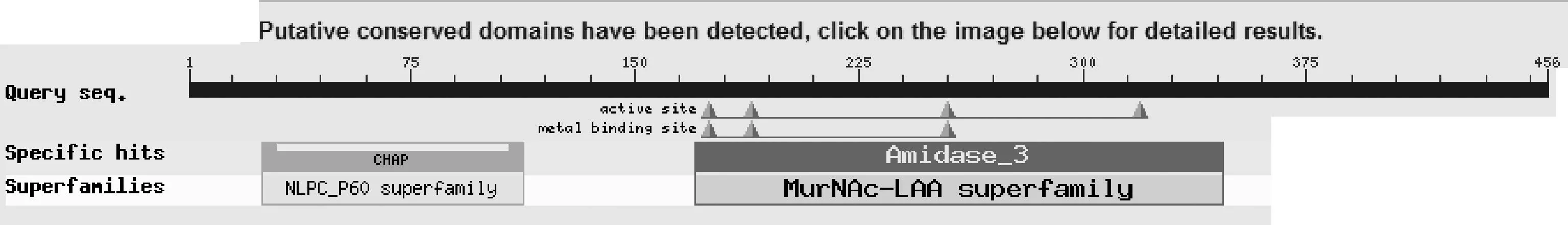
图4 裂解酶LysIMEP5的NCBI-BLAST 分析
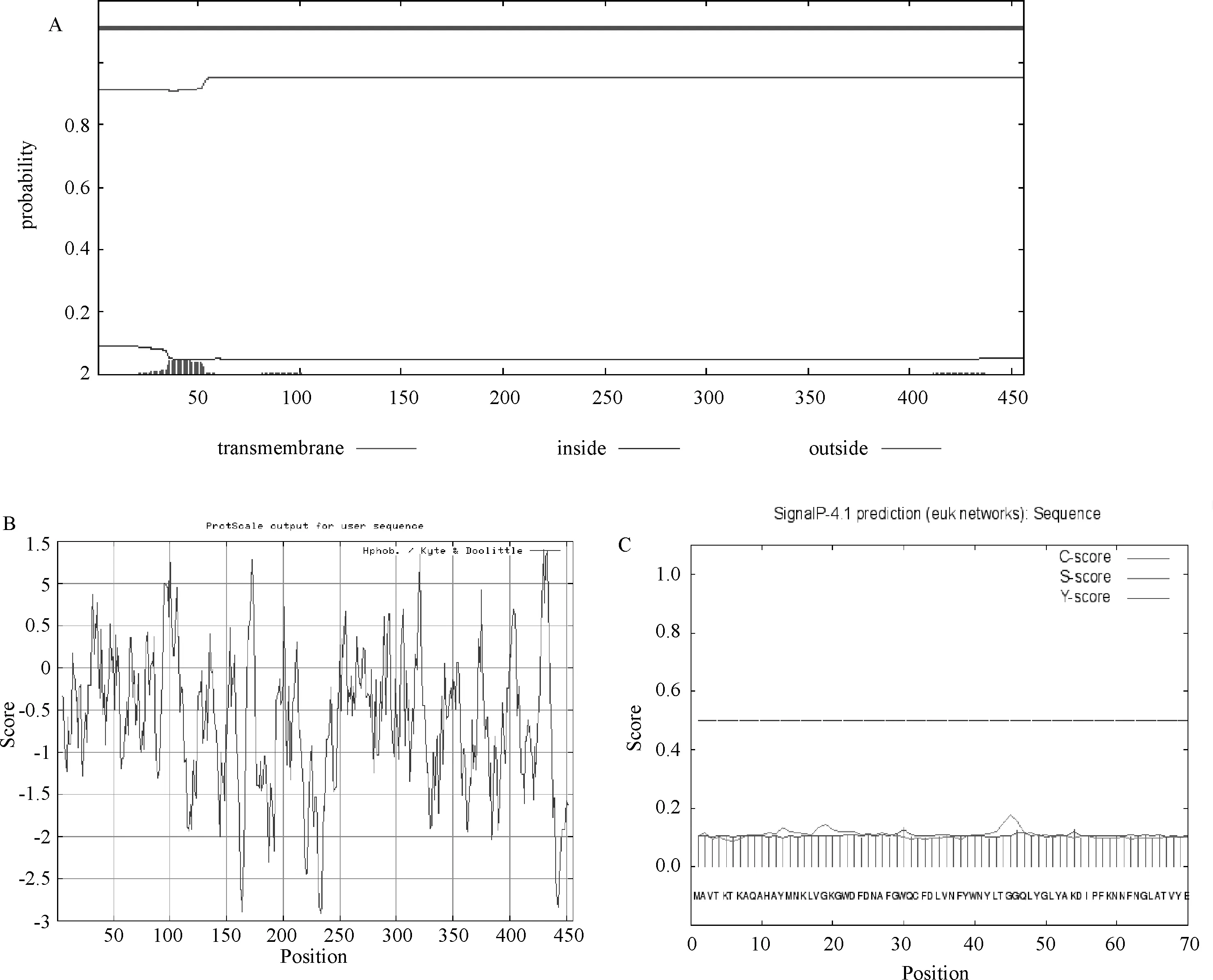
A.TMHMM预测跨膜区域;B. 疏水性预测;C.信号肽预测图5 LysIMEP5编码的裂解酶蛋白跨膜结构域预测
2.5 蛋白的二级结构预测 通过DNASTAR软件的protean功能对基因编码的裂解酶蛋白的一维氨基酸序列特性进行预测,同时SSPro 4.0 服务器预测裂解酶的二级结构,结果表明:LysIMEP5蛋白由456个氨基酸组成,相对分子质量为51717.00,等电点为9.70,其二级结构比较复杂,其中α螺旋占19.52%,β折叠占25.66%,无规则卷曲占54.82%。从预测结果可知,裂解酶二级结构组分中,以无规则卷曲为主(54.82%)。裂解酶二级结构预测结果(图6)为双行显示,上行为目的蛋白序列,下行为对应的二级结构,其中 C 表示无规则卷曲,H 表示 α-螺旋,E 表示 β-折叠。

图6 裂解酶二级结构预测结果图
2.6 蛋白的三级结构预测 Swiss-model 预测裂解酶的三级结构(图7)表明,其残基建模范围是从166到456,以X-ray 1.80A为模板,覆盖率为55%,具有一定的可信度。从三级结构图中可以清晰地看到Ca2+离子和Zn2+离子。

图7 LysIMEP5三级结构初步预测示意图
3 讨论
近年来,噬菌体作为一种特异性感染细菌的病毒,得到越来越广泛关注与应用。大部分噬菌体都是通过裂解宿主细胞来结束其感染周期。而小分子RNA和DNA噬菌体通过在不同阶段编码蛋白质干扰、抑制宿主菌胞壁的合成,从而导致宿主菌胞壁裂解,而双链DNA噬菌体则通过特异性裂解酶(lysin)系统,作用于细胞壁上的肽聚糖,从而破坏细菌细胞壁,导致细菌的裂解[14]。革兰氏阳性菌噬菌体的裂解酶结构相似,裂解效率高,且不易产生耐药菌株,所以许多革兰氏阳性菌噬菌体裂解酶开始被克隆、表达及应用于生产[15]。相比抗生素而言,裂解酶最大的优点是用量小且连续使用也不会产生抗性细菌,还可以安全高效地杀灭宿主菌而对其他菌群无影响。
试验在对奶牛乳房炎金黄色葡萄球菌裂解性噬菌体裂解酶基因进行克隆时,采用同源性分析后克隆的方法,节省了时间和科研经费。本研究中克隆的LysIMEP5基因的起始密码子是ATG,终止密码子是TAA,与绝大多数的长尾噬菌体的密码子相同。从NCBI的BLAST分析结果可以看出该裂解酶与已报导的相关裂解酶相似性不高,属于一种新发现的金黄色葡萄球菌噬菌体裂解酶,且该裂解酶的25~113aa属于CHAP片段,是酰胺酶家族的一员,而170~347aa属于肽聚糖水解酶家族(MurNAC-LAA superfaimly)成员中的Amidase。CHAP能催化GSP水解为谷胱甘肽和亚精胺,且每个CHAP分子的结构包含1-164范围的氨基酸,由3个α-螺旋,6个β-折叠和一个Ca2+组成。MurNAC-LAA superfaimly是发现于细菌和噬菌体或噬菌体的基因组中几种肽聚糖水解酶(PGHS)中的一种,参与肽聚糖的降解。一般情况下,细菌MurNAc-LAAS是细菌自溶系统的成员,并允许它们携带信号肽的N-末端穿过胞质膜。然而,噬菌体MurNAc-LAAS是内溶素,因为这些噬菌体编码的酶在噬菌体生殖周期的终端阶段分解细菌的肽聚糖。相对于自溶素,几乎所有的细胞内溶素无信号肽,被认为是在噬菌体编码的穴蛋白的帮助下通过胞质膜的。酰胺酶催化区域与另一功能模块在N-末端或C-末端的融合,代表着高亲和力的细胞壁蛋白的结合。通过之前关于裂解酶活性依赖于Ca2+的报道,如LysK,以及噬菌体phi11、B30和Ply700的裂解酶[16]和顾敬敏[5]首次对金黄色葡萄球菌噬菌体裂解酶的三维结构分析可预测,该裂解酶LysIMEP5以及其CHAP片段的裂解活性也均依赖于Ca2+的存在,且CHAP片段在LysIMEP5的活性中起关键的裂解作用。通过对Amidase-3片段的催化活跃区和金属离子结合区域的分析,可知Zn2+对Amidase-3片段发挥活性起关键作用。通过LysIMEP5的三级结构模型可以清楚地看到Ca2+和Zn2+。由此可推测该裂解酶同时具有CHAP片段和Amidase-3片段会具有较强的裂解功能,对其裂解功能的预测分析会在后续的试验中继续研究。通过对其蛋白结构的预测可知,此裂解酶属无跨膜区,无信号肽,以无规则卷曲为主的亲水性蛋白。噬菌体MurNAc-LAAS是内溶素,在噬菌体生殖周期的终端阶段分解细菌的肽聚糖。因此,将在后续的试验中对LysIMEP5编码的内溶素克隆表达,为开发新型绿色抑菌剂奠定基础。
4 结论
研究成功克隆出了1371bp的LysIMEP5基因。用BLAST软件对其进行同源性比对发现:LysIMEP5基因与已报道的金黄色葡萄球菌噬菌体裂解酶相似性不高,此基因片段中同时存在CHAP片段和Amidase-3片段,且Amidase-3片段中存在明显的金属离子结合区域,在LysIMEP5的裂解活性中起关键作用。通过对蛋白的结构预测发现此裂解酶无跨膜区,无信号肽,且以无规则卷曲为主,亲水性区域相对集中而且比例大于疏水性区域。
[1] 苏胜兵. 分枝杆菌烈性噬菌体的分离鉴定及其裂解酶基因的克隆与序列分析[D]. 长春: 吉林农业大学, 2012.
[2] Lood R, Raz A, Molina H,etal. A highly active and negatively chargedStreptococcuspyogeneslysin with a rare D-alanyl-L-alanine endopeptidase ctivity protects mice against streptococcal bacteremia[J]. Antimicrobial Agents and Chemotherapy, 2014, 58(6): 3073-3084.
[3] Loeffler J M, Nelson D, Fischetti V A. Rapid killing ofStreptococcuspneumoniaewith a bacteriophage cell wall hydrolase[J]. Science, 2001, 294(5549): 2170-2172.
[4] Pastagia M, EuLer C, Chahales P,etal. A novel chimeric lysin shows superiority to mupirocin for skin decolonization of methicillin-resistant and -sensitiveStaphylococcusaureusstrains[J]. Antimicrobial Agents and Chemotherapy, 2011, 55(2):738-744.
[5] 顾敬敏.金黄色葡萄球菌噬菌体 GH15及其裂解酶三维结构与分子作用机制研究[D].长春: 吉林大学, 2014.
[6] 李萌. 宽裂解谱沙门氏菌噬菌体的基因组学分析及其重组内溶素抑菌活性研究[D].青岛: 中国海洋大学, 2014.
[7] 杨曦. 大肠杆菌 O157 Stx 噬菌体裂解酶的原核表达及活性研究[D].上海: 上海交通大学, 2012.
[8] 史一博, 孙建和. λ噬菌体穿孔素(holin)蛋白触发裂菌的分子机制[J].微生物学报, 2015, 52(2): 141-145.
[9] Gong P J, Cheng M J, Li X W,etal. Characterization ofEnterococcusfaecium bacteriophage IME-EFm5 and its endolysin LysEFm5[J]. Virology, 2016, 492(5): 11-20.
[10]Petersen T N, Brunak S, von H G,etal. SignalP 4.0: discriminating signal peptides from transmembrane regions[J]. Nat Methods, 2011, 8(10): 785-786.
[11]Cheng J, Randall A Z, Sweredoski M J,etal. SCRATCH: a protein structure and structural feature prediction server. Nucleic Acids Research[J]. 2005, 33(Web Server issue): 72-76.
[12]Arnold K, Bordoli L, Kopp J,etal. The SWISS-MODEL workspace: a web-based environment for protein structure homology modeling[J]. Bioinformatics, 2006, 22(2): 195-201.
[13]AltschuL S F, Gish W, Miller W,etal. Basic local alignment search tool[J]. Journal of Molecular Biolgy, 1990, 215(3): 403-410.
[14]Wu Z F, Zhang W, Lu C P. Comparative proteome analysis of secreted proteins ofStreptococcussuisserotype 9 isolates from diseased and healthy pigs[J]. Microbial pathogenesis, 2008, 45(3): 159-166.
[15]杨航, 余军平, 危宏平. 裂解酶治疗的研究进展与应用前景[J]. 微生物学通报, 2015, 42(1): 178-184.
[16]Fenton M, Ross R, McAuLiffe O,etal. Characterization of the staphylococcal bacteriophage lysin CHAP(K)[J]. Journal of Applied Microbiology, 2011, 111(4): 1025-1035.
(编辑:陈希)
Cloning and Sequence Analysis of Bovine MastitisStaphylococcusaureusLytic Bacteriophage Lysin LysIMEP5 Gene
ZHANG Qian1,ZHANGXIANG Li-lan2, SUN Yao-qiang1, YU Hui-ju1,ZHANG Pei-sheng1, LIU Ge1, QU Yong-gang1*,TONG Yi-gang2*,LI Yan3
(1.CollegeofAnimalScienceandTechnology,ShiheziUniversity,Shihezi,Xinjiang832003,China;2.BeijingInstituteofMicrobiologyandEpidemiology,Beijing100071,China;3.TheGeneralStationofAnimalHusbandryandVeterinaryMedicineofXinjiangProductionandConstructionCorps,Urumqi830063,China)
Cloning and analysis the biological information of lysin LysIMEP5 gene from bovine mastitisStaphylococcusaureuslytic bacteriophage. Using the bovine mastitisStaphylococcusaureuslytic phage VB_SauS_IMEP5, which was isolated and indentified by our laboratory, and its whole genome information, analysis, we got the lysin gene sequence. Using the software Primer 5.0, a pair of specific primers was designed and the LysIMEP5 gene was amplified and cloned from the bovine mastitisStaphylococcusaureusphage by Polymerase Chain Reaction (PCR). Analysing its biological information characteristics by the BLAST and its protein structure prediction. The lysin LysIMEP5 gene was cloned successfully and its sequencing results were completely matched with the original sequence by DNAMAN, without any gene mutation. Homologous analysis showed that,the highest similarty is 83.1% compared with have reported Staphylococcus aureus phage lyase.The gene full-length of lysin LysIMEP5 was 1371 bp, encoding 456 amino acids. The lysin LysIMEP5 was hydrophilic protein, its molecular mass was 51.717 kDa, its isoelectric point was 9.70. Biological information analysis showed that, CHAP fragments and Amidase-3 fragments were existed in the LysIMEP5 at the same time. The protein was mainly random coil, but without transmembrane domain and signal peptide. The gene of LysIMEP5 was successfully cloned from the bovine mastitisStaphylococcusaureusphage and the protein structure of LysIMEP5 was prediction. The results provided foundation for the future expression of LysIMEP5 and the development of new green antibacterial agent.
bovine mastitis;Staphylococcusaureusbacteriophage;lysine;cloning;protein structure
国家自然科学基金(31560699);新疆生产建设兵团应用基础研究计划项目(2015AG012)
2016-08-26
A
1002-1280 (2016) 10-0015-07
S852.61

