高效氯氰菊酯对德国小蠊酯酶活性的影响
靖博彬,刘小闪,冯丽娟
(中国铁道科学研究院节能环保劳卫研究所,北京 100081)
站车卫生
高效氯氰菊酯对德国小蠊酯酶活性的影响
靖博彬,刘小闪,冯丽娟
(中国铁道科学研究院节能环保劳卫研究所,北京 100081)
为了探讨拟除虫菊酯类杀虫剂抗药性生化检测的标志指标,对德国小蠊施以亚致死剂量的高效氯氰菊酯。结果表明,在施药早期,乙酰胆碱酯酶和羧酸酯酶的活性受到显著抑制,但都在第3天恢复到对照组水平。在施药后第18天,乙酰胆碱酯酶、羧酸酯酶和磷酸酯酶的活性都显著高于对照组。说明上述酯酶可以作为拟除虫菊酯类杀虫剂抗药性生化检测的生物学标志。
高效氯氰菊酯; 德国小蠊; 酯酶
1 概述
德国小蠊是一种世界性分布的危害极大的卫生害虫。目前铁路站车蜚蠊的主要消杀手段还是以化学防治为主,但是在防治过程中,大量不合理的使用杀虫剂,尤其是自拟除虫菊酯广泛应用以来,蜚蠊的抗药性问题日渐突出,抗药性已成为制约化学防治效果的主要原因之一[1]。目前病媒生物的抗药性检测主要是以果酱瓶药膜法和点滴法为主的传统的生物检测方法[2],这种方法具有需要大量试虫、多次重复、准确性和灵敏性有限等局限性,已无法适应当前铁路站车复杂的用药情况和抗性治理的需要。因此,建立使用试虫少、操作简便、快速准确的抗药性生化检测方法是适应铁路站车蜚蠊抗药性检测发展的必然趋势。
拟除虫菊酯类杀虫剂,由于其高效的杀虫效果及较低的人体毒性,目前已广泛应用于铁路站车的蜚蠊消杀。拟除虫菊酯可减缓钠离子通道的激活和失活,降低钠离子通道的关闭速率,允许更多的钠离子通过去极化的中枢神经膜,从而造成神经兴奋性的传导障碍,出现中毒症状[3]。本课题以靶标抗性(乙酰胆碱酯酶)和代谢抗性(磷酸酯酶和羧酸酯酶)产生的生化机制为基础,研究亚致死剂量的高效氯氰菊酯对德国小蠊体内相关酯酶活性的影响,确定可以作为拟除虫菊酯类杀虫剂抗药性检测的生物学标志,为铁路站车蜚蠊抗药性生化检测方法提供基础。
2 材料与方法
2.1 供试虫源及施药方法
德国小蠊由中国疾病预防控制中心提供,经本实验室长期饲养,未接触杀虫剂。选用羽化后的健康成年雄虫,采用果酱瓶药膜法施药,以死亡率在30%~50%之间为施药剂量。以丙酮为溶剂,先按w/v配制成0.05%浓度(404 mg/L) 的高效氯氰菊酯母液,实验前用丙酮稀释为0.0000016%(12.9 mg/mL)的高效氯氰菊酯溶液。将试虫在施药的果酱瓶中放置24 h后转入洁净的果酱瓶中,正常饲养。分别于施药前(0天),施药后1、2、3、5、7、13和18天取虫测定酶活,每组各10只。酶活性测定前,将试虫禁食24 h。
2.2 酶活性测定
将待测德国小蠊用蒸馏水冲洗后放在滤纸上吸干,根据待测酶分别置于不同的缓冲液中冰浴匀浆,匀浆液8 000 r/min离心15 min,取上清作为酶源。乙酰胆碱酯酶在磷酸缓冲液(1.0 mol/L,pH7.5,用前加入1%的Trition-X100)中,以碘化硫代乙酰胆碱为底物,按照用Groun改进的Ellman方法[4],在412 nm波长下比色测定。以对硝基苯磷酸二钠(PNPP)作为底物,测定酸性磷酸酯酶和碱性磷酸酯酶的活性,分别加入醋酸缓冲液(0.1 mol/L,pH 4.6)或碳酸缓冲液(0.05 mol/L,pH10.0)2.3 mL,PNPP 0.5 mL,待测酶液0.2 mL,37℃水浴30 min后,加入2 mL NaOH(0.1mol/L)终止反应,在400 nm下测定吸光度。羧酸酯酶参考Valles和高希武的方法[5],测定乙酸-1-萘酯羧酸酯酶和乙酸-2-萘酯羧酸酯酶的活性。
2.3 蛋白浓度的测定
按照Bradford方法[6],测定待测酶液的蛋白含量。以小牛血清蛋白作为标准蛋白。取0.1mL酶液,加入5mL考马斯亮蓝,在595nm处测定吸光度,在标准曲线上查得其对应的蛋白浓度。根据各酶对应产物的标准曲线及蛋白含量,计算各酶的活性。
2.4 统计方法

3 结果
在亚致死剂量的高效氯氰菊酯作用于德国小蠊以后,乙酰胆碱酯酶、磷酸酯酶和羧酸酯酶的总体趋势均为显著升高,见表1。乙酰胆碱酯酶的活力在施药后先降低(第1天和第2天,P<0.001),而后极显著升高(第7天,P<0.001),最后恢复至略高于对照组水平,见图1。酸性磷酸酯酶的活性在药物作用后,先升高(第1天,P<0.05),再下降,然后在第5天(P<0.001)以后一直保持在较高水平,见图2。碱性磷酸酯酶的活性在施药后先升高(第1天和第2天,P<0.001),接着下降至对照组水平,再缓慢上升,见图3。乙酸-1-萘酯酯酶和乙酸-2-萘酯酯酶的活性在施药以后,先降低(第1天和第2天,P<0.001),随后恢复到对照组水平并呈小幅升高趋势,见图4和图5。


时间t/d乙酰胆碱酯酶nmol/(mg·min-1)酸性磷酸酯酶μmol/(mg·min-1)碱性磷酸酯酶nmol/(mg·min-1)乙酸⁃1⁃萘酯nmol/(mg·min-1)乙酸⁃2⁃萘酯nmol/(mg·min-1)01 90±0 272 21±0 5374 22±5 942 66±0 752 71±0 2410 94±0 333 47±0 7083 92±4 451 40±0 451 44±0 4220 87±0 112 34±0 3690 91±1 601 61±0 301 91±0 3231 95±0 251 67±2 3374 68±6 282 67±0 582 69±0 2553 43±0 424 96±0 8479 39±4 351 95±0 342 22±0 4173 63±0 505 20±0 5784 21±9 202 10±0 062 50±0 05132 50±0 294 09±0 9384 92±4 602 32±0 552 48±0 60182 27±0 274 13±0 4084 48±5 112 79±0 413 09±0 43F96 9729 8869 74611 85317 996P<0 001<0 001<0 001<0 001<0 001

图1 高效氯氰菊酯对乙酰胆碱酯酶活性的影响

图2 高效氯氰菊酯对酸性磷酸酯酶活性的影响

图3 高效氯氰菊酯对碱性磷酸酯酶活性的影响

图4 高效氯氰菊酯对乙酸-1-萘酯酯酶活性的影响
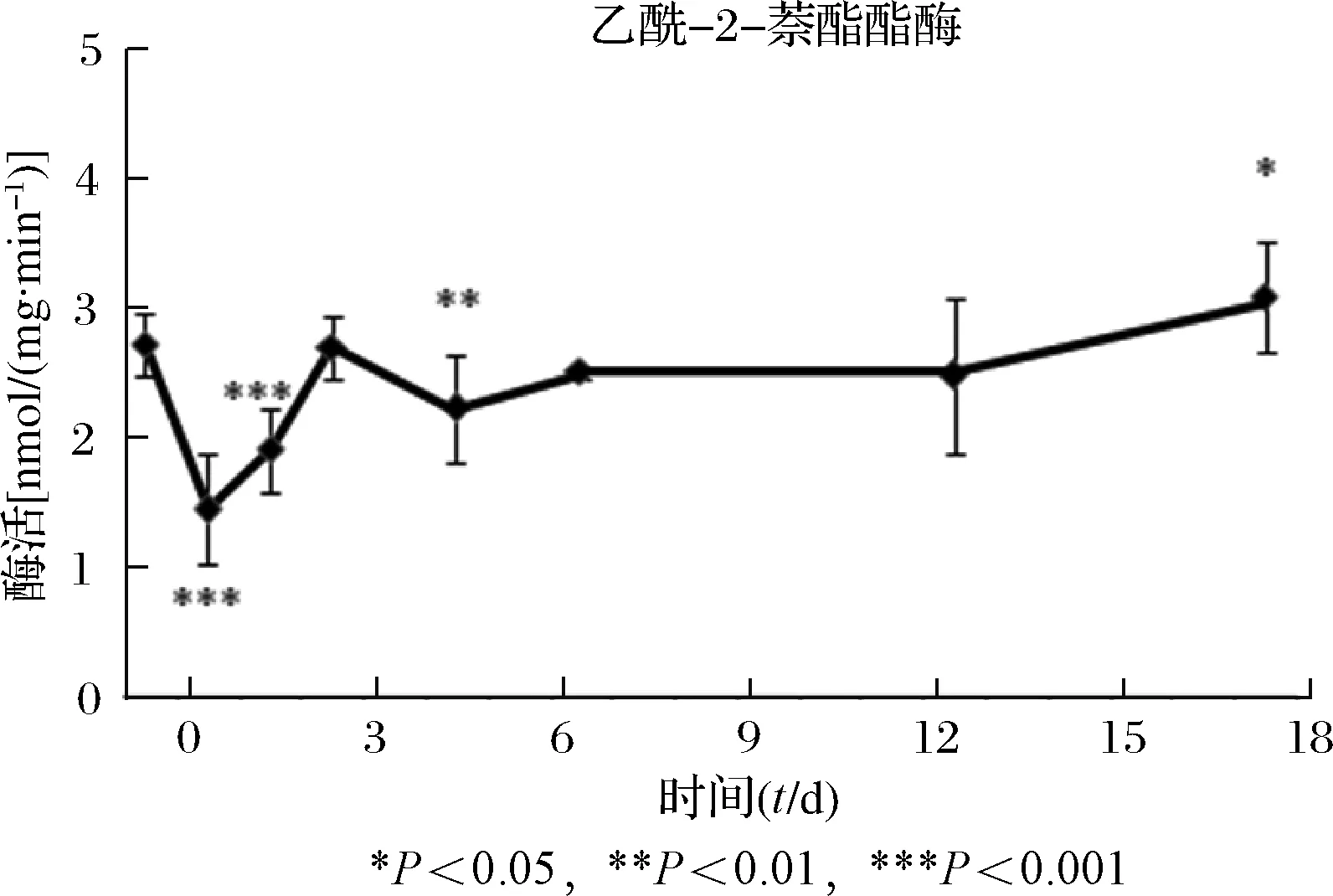
图5 高效氯氰菊酯对乙酸-2-萘酯酯酶活性的影响
4 讨论
本实验研究了亚致死剂量的高效氯氰菊酯对德国小蠊体内乙酰胆碱酯酶、酸性磷酸酯酶、碱性磷酸酯酶、乙酸-1-萘酯酯酶和乙酸-2-萘酯酯酶的影响。研究结果表明,无论各种酶在施药急性期如何变化,在施药后的第18天,其活性均有一定程度的升高。
目前普遍认为,昆虫对杀虫剂的抗性发展是指昆虫在杀虫剂的选择压力下,那些不含有抗性基因的个体被杀虫剂杀死,而带有抗性基因的个体存活下来,并繁殖使抗性逐步积累和加强,从而成为优势种群的过程[7]。德国小蠊抗药性产生的生化机制主要是靶标抗性(靶标部位敏感性的降低)和代谢抗性(解毒代谢能力的增强)[8]。乙酰胆碱酯酶(AChE)的敏感性降低是靶标抗性中抗药性产生的主要原因之一,有机磷和氨基甲酸酯等杀虫剂可以通过抑制中枢神经系统中的AChE,干扰对神经递质ACh的水解作用,从而最终阻断突触传导来杀死昆虫。抗性个体中AChE质或量的改变,降低了AChE受抑制的程度[9]。实验结果表明,对德国小蠊施以亚致死浓度的高效氯氰菊酯之后,在急性期,德国小蠊体内的AChE活性极显著降低,但在第3天便恢复到对照组水平,随后则呈现上升趋势,并在观察结束前,其活性仍显著高于对照组水平。说明严重受抑制的AChE可以重新诱导合成,改善其受抑制的程度,从而降低德国小蠊对高效氯氰菊酯的敏感性。推测尽管AChE不是拟除虫菊酯类杀虫剂的靶标酶,但是仍可以考虑作为德国小蠊对高效氯氰菊酯的抗药性生化检测的生物学标志。
代谢抗性是昆虫产生抗药性的最普遍和最主要的机制[10],代谢杀虫剂的解毒酶使有毒的外来化合物经过氧化、还原或水解后失去原有的毒性,并增高反应产物的水溶性,便于从昆虫体内排出。磷酸酯酶和羧酸酯酶等水解酶在有机磷和拟除虫菊酯杀虫剂的代谢中起着重要作用。本研究结果显示,对德国小蠊施以亚致死浓度的高效氯氰菊酯之后,酸性磷酸酯酶和碱性磷酸酯酶的活性都有显著升高;乙酸-1-萘酯酯酶和乙酸-2-萘酯酯酶的活性在早期受到抑制后,很快恢复,并也呈现出逐步升高的趋势,在观察结束前,羧酸酯酶的活性也显著高于对照组水平。研究发现,酯酶可以通过水解或结合拟除虫菊酯类杀虫剂发挥解毒作用,或水解成无毒的离子,或发生磷酰化或氨基甲酰化反应,改变了拟除虫菊酯类杀虫剂的原有性状,使其无法达到靶标部位[11]。酯酶与杀虫剂的作用是双向的,酯酶可以代谢杀虫剂,杀虫剂也可以抑制酯酶的活性,本研究中羧酸酯酶的活性变化也与此一致。推测磷酸酯酶和羧酸酯酶也可能可以作为以高效氯氰菊酯为代表的拟除虫菊酯类杀虫剂抗药性生化检测的生物学标志。
综上所述,亚致死剂量的高效氯氰菊酯可以诱导德国小蠊体内乙酰胆碱酯酶、磷酸酯酶和羧酸酯酶的活性升高,说明乙酰胆碱酯酶、磷酸酯酶和羧酸酯酶可能可以作为以高效氯氰菊酯为代表的拟除虫菊酯类杀虫剂抗药性生化检测的生物学标志。
[1] 董桂蕃.蜚蠊的抗药性及其防治对策[J].中国媒介生物学及控制杂志, 1992,3(3):5-9.
[2] 张丽.德国小蠊抗药性生化机制及抗性快速检测研究[D].南京:东南大学,2003.
[3] 余慧群, 廖艳芳, 周海,等.拟除虫菊酯杀虫剂研究进展[J].企业科技与发展,2010, 20:61-64.
[4] Gorun V, Proinov L, Baltescu V, et al.Modified Ellman procedure for assay of cholinesterases in crude enzymatic preparations [J].Analytical Biochemistry, 1978, 86(1):324-326.
[5] 高希武, 梁同庭.阿特拉津和敌敌畏对棉铃虫和家蝇羧酸酯酶及GSH-S-转移酶的诱导作用[J].昆虫学报, 1993, 36(2):167-717.
[6] Bradford MM.A rapid and sensitive method for the quantization of microgram quantities of protein utilizing the principle of protein-dye binding [J].Analytical Biochemistry, 1976, 72(1):248-254.
[7] 林永丽.德国小蠊的抗性和抗性机理研究进展[J].医学动物防制, 1998, 14(4):68-71.
[8] 邢剑飞, 刘艳, 颜冬云.昆虫对拟除虫菊酯农药的抗性研究进展[J].环境科学与技术, 2010, 33(10):68-72.
[9] 陶士强, 吴福安, 程嘉翎.昆虫的抗药性分子机制研究进展[J].中国蚕业, 2005, 26(1):11-13.
[10] 张大羽, 程家安.德国小蠊的抗药性水平和主要机制[J].中国媒介生物学及控制杂志, 1997(03):236-239
[11] 周斌芬, 唐振华, 高菊芳.昆虫代谢抗性的研究进展[J].农药, 2008, 47(5):313-323.
The Effect of Beta-cypermethrin on the Esterase Activity in Blattella Germanica
JING Bobin, LIU Xiaoshan, FENG Lijuan
(EnergySaving&EnvironmentalProtection&OccupationalSafetyandHealthResearchInstitute,ChinaAcademyofRailwaySciences,Beijing100081,China)
To explore the biochemical marker of pyrethroid insecticide resistance,Blattellagermanicawere exposed to beta-cypermethrin in the sub lethal dose .The results showed that the activity of acetylcholine esterase and carboxyl esterase were significant inhibited in the early stage after the exposure, and both returned to the control levers in the 3rdday.At the 18thday after the exposure, the activity of acetylcholine esterase, carboxyl esterase and phosphoesterase were greater than controls significantly.Thus, these esterase mentioned above could be used as the biochemical markers of pyrethroid insecticide resistance.
beta-cypermethrin;Blattellagermanica; esterase
2015-12-30;
2016-02-03
中国铁道科学研究院铁道科学技术研究发展中心科研项目计划《铁路站车重要病媒生物抗性方法研究》(J2014Z001)。
靖博彬(1982—),女,江苏铜山人,医学博士,助理研究员,主要从事铁路病媒生物防控工作。
2095-1671(2016)01-0026-04
R184.39
B

