帕金森病脑脊液和血液生物标志物的研究进展
崔丹丹,王晓良,彭 英
(中国医学科学院北京协和医学院药物研究所,北京 100050)
·创刊30年专刊——药理学研究·
帕金森病脑脊液和血液生物标志物的研究进展
崔丹丹,王晓良,彭 英
(中国医学科学院北京协和医学院药物研究所,北京 100050)

王晓良,研究员,政府特殊津贴专家,现任中国医学科学院药物研究院副院长,博士生导师;中国药学会副理事长,亚洲药学家联盟副理事长。长期从事心脑血管和神经药理学研究及创新药物临床前评价和作用机制研究。在国内率先建立了离子通道综合性研究平台,并领导建立了科技部支持的国家药效评价研究、新药筛选和开发平台。领导开发了多个抗脑缺血和老年痴呆的一类新药,发表论文200余篇,申请授权国内外发明专利近20项。
帕金森病(PD)是一种慢性神经退行性疾病。目前PD的诊断主要依据临床症状和体征及对抗PD药物的治疗反应,早期诊断的准确度不高,而灵敏度、特异度较高的生物标志物为疾病早期诊断和新药研发提供了途径。本文从PD的病理机制对脑脊液和血液来源的生物标志物研究现状进行总结,多巴胺代谢产物二羟苯乙酸、路易小体内的α-突触核蛋白及其相关蛋白、氧化应激产物8-羟基脱氧鸟苷和抗氧化剂尿酸、炎症免疫反应因子白细胞介素和神经营养因子等候选生物标志物涉及到PD不同发展阶段。为提高PD早期诊断和药物疗效评估的准确度,建议采用组合生物标志物,即不同机制的生化标志物、影像学和临床症状等手段进行综合评价。
帕金森病;生物标志物;脑脊液;血液
帕金森病(Parkinson disease,PD)是一种慢性神经退行性疾病,发病率仅次于阿尔茨海默病(Alzheimer disease,AD),也是老年人最常见的锥体外系疾病。PD由英国医生James Parkinson于1817年首次报道。临床上以静止性震颤、姿势步态异常、肌强直和运动迟缓为主要特征。美国流行病学调查显示,散发性PD的发病率随年龄增长而升高,65岁以上老人患病率为1%~2%,85岁以上升高至3%~5%[1]。中国人群PD发病率在2/10万~ 797/10万之间,高于部分发达国家[2]。
PD诊断主要依赖于病史和临床症状,因与其他运动失调疾病症状相似,易被误诊。Adler等[3]采用临床神经病理作为PD诊断的金标准,发现病程>5年的PD患者诊断正确率达88%,但是发病<5年的PD患者首次临床诊断的正确率仅为53%。研究发现,当患者出现震颤等临床运动症状时,意味着多巴胺能神经元丢失至少达50%以上,纹状体多巴胺递质含量减少80%以上[4],此时PD患者已错过早期干预时机。因此,亟需寻找生物学标志物用于PD临床前期和前驱期的早期诊断,鉴别诊断PD和其他PD综合征,提高PD诊断的准确性。
目前,PD生物标志物分为临床标志物、功能神经影像学标志物和生物化学标志物三大类。其中临床生物标志物分为非运动症状和运动症状评价,但临床症状表现存在波动,影响疾病的正确识别和评估,存在一定的误诊率。功能神经影像学包括大脑PET代谢成像、经颅超声成像和磁共振成像(magnetic resonance imaging,MRI)等技术,操作方便但特异性不高。而随着蛋白质组学、基因组学、代谢组学等平台的成熟和抗体芯片、高内涵筛选等技术的应用,涌现出越来越多的生物化学标志物。氧化应激、神经炎症、线粒体功能障碍、激酶途径和钙调节异常等机制参与了PD的发生发展。因此,在药物靶点和生物化学标志物间建立联系是寻找理想生物标志物的捷径。体液生物标志物主要来自脑脊液、血液、尿液和唾液等,其中脑脊液和血液生物标志物的研究相对成熟。本文就脑脊液和血液来源的潜在PD生物标志物进行综述。
1 神经递质相关生物标志物
PD患者黑质致密部多巴胺能神经元退化,纹状体区多巴胺含量减少,多巴胺代谢产物二羟苯乙酸(dihydroxyphenylacetic acid,DOPAC)和高香草酸的含量下降,因此理论上根据神经递质的水平可直接、便捷地进行PD诊断。但是脑脊液多巴胺的含量并不能精确指示中枢神经系统多巴胺的缺失,主要是因为多巴胺能神经元损伤时,多巴胺通过其他通路补偿性运输到终端,而且脑脊液中多巴胺含量低于常规的检测限。而纹状体中高香草酸变化与多巴胺含量并不完全一致。DOPAC是多巴胺的主要代谢产物,相比于多巴胺和高香草酸,脑脊液中DOPAC更适合作为PD诊断指标[5]。研究表明,和正常人相比,PD患者、多系统萎缩症(Mul⁃tiple system atrophy,MSA)患者脑脊液中的DOPAC含量均明显降低。PD综合征患者和正常人之间DOPAC指标的敏感度达100%,特异度达89%[6]。纹状体PET(18F-DOPA)扫描结果为阳性的散发性PD患者,其脑脊液中DOPAC的含量也是降低的。因此,脑脊液中的DOPAC可灵敏分辨PD患者,有望成为PD生物标志物。
2 路易小体蛋白相关生物标志物
原发性PD患者黑质区残存的多巴胺能神经元胞浆内形成嗜酸性包涵体即路易小体。路易小体的特征蛋白质α-突触核蛋白(α-synuclein,α-Syn)是最早被发现的PD蛋白。研究显示,酪氨酸羟化酶、β-淀粉样蛋白(β-amyloid protein,Aβ)、微管相关蛋白tau、泛素羧基末端水解酶L1(ubiquitin carboxy-terminal hydrolase L1,UCH-L1)及G蛋白偶联受体激酶等α-Syn相关蛋白质同α-Syn共定位于路易小体内[7]。
2.1 α-突触核蛋白
α-Syn主要定位于突触前神经末梢,具有调节突触可塑性、促进突触囊泡形成、调节突触处多巴胺含量等生物学功能。遗传性PD家系中发现了α-Syn基因的A53T,A30P和E46K单核苷酸突变。α-Syn磷酸化、糖化、硝基化等异常翻译后修饰和错误折叠加速寡聚体形成,之后聚集成不溶性的纤维结构,构成路易小体的组织结构单元。α-Syn分布广泛,表达于脑组织、心脏、骨骼肌、脑脊液、唾液、血液、尿液以及胃肠道等[8]。有假说认为,α-Syn以类似阮病毒的形式在细胞间传递[9]。
2.1.1 总 α-突触核蛋白
一些研究表明,PD患者和正常人脑脊液中总α-Syn的含量没有差异[10-12]。但多个研究发现,PD脑脊液总α-Syn水平降低[13-14],可能是由于a-Syn在脑组织中纤维化聚集,可进入体液循环的总α-Syn减少,导致脑脊液总α-Syn含量下降[15]。Shi等[16]发现,PD患者脑脊液α-Syn浓度明显低于正常人,诊断的敏感度和特异度分别达76.8%和53.5%。但有研究表明,脑脊液总α-Syn水平和疾病的严重程度没有相关性[17-18]。目前关于PD患者血浆中α-Syn的研究结果存在较大分歧[19-20],可能是因为含高丰度α-Syn的红细胞破裂,造成血样污染,干扰了实验结果。
2.1.2 α-突触核蛋白寡聚体
PD患者脑脊液α-Syn寡聚体水平显著高于进行性核上性麻痹(progressive supranuclear palsy,PSP)患者、AD患者以及正常人[22],并且PD患者脑脊液α-Syn寡聚体与总α-Syn的比值高于正常人[23-24]。ELISA方法检测血浆中的α-Syn寡聚体,发现PD患者的α-Syn寡聚体水平同样高于正常人,诊断PD的敏感度为52.9% ,特异度为85.2%[25]。
2.1.3 磷酸化 α-突触核蛋白
正常生理状况下,α-Syn的Ser129位点的磷酸化水平比较低;但PD病理状态下,Ser129位点几乎全部处于磷酸化修饰状态。磷酸化α-Syn可能参与黑质多巴胺能神经元的保护[26]。但α-Syn的过度磷酸化诱导异常纤维形成,协同α-Syn的其他翻译后修饰造成α-Syn聚集,引发神经元细胞死亡[27]。Wang等[28]研究发现,脑脊液中的磷酸化α-Syn水平明显高于正常人、MSA和PSP患者,且与PD的严重程度存在微弱的相关性。Foulds等[29]研究表明,PD患者血浆的磷酸化α-Syn水平同样高于正常人(P=0.053,n=30),需要扩大样本数量进行验证。
根据脑脊液或血浆中总α-Syn含量从人群中分辨出PD综合征患者,结合α-Syn寡聚体和磷酸化α-Syn的水平排除MSA,PSP和AD患者。α-Syn有可能成为诊断PD的生物标志物。
2.2 β-淀粉样蛋白42
Aβ42由42个氨基酸组成,主要来源于淀粉样前体蛋白的水解[30],可在神经元细胞外异常沉积,是AD特征性病理改变老年斑的主要成分。脑脊液Aβ42可用于鉴别PD和其他神经退行性疾病。大多研究表明,虽然PD患者脑脊液中Aβ42水平明显低于正常人[11-12,18],但下降幅度仍低于路易体痴呆(dementia with lewy bodies,DLB)和 AD患者[13,31]。然而,一些研究显示,PD患者和正常人之间Aβ42水平无差异[32]。Aβ42水平与认知功能相关,脑脊液中Aβ42水平降低预示PD患者发展为痴呆的可能性较大,敏感度达到85%以上[33]。脑脊液Aβ42是预测PD由轻度认知障碍发展为PD痴呆(PD with dementia,PDD)的早期生物标志物之一。
2.3 Tau蛋白
Tau蛋白是人脑内含量最高的微管相关蛋白,与微管蛋白结合促进微管形成,构成神经细胞骨架。Tau蛋白异常磷酸化形成神经元纤维缠结。有研究表明,tau蛋白含量在不同PD综合征间没有差异[34]。但也有研究发现,与DLB,PDD,AD和MSA患者相比,PD患者脑脊液总tau蛋白(T-tau)和磷酸化tau蛋白(p-tau)含量下降[13,35]。因此,tau蛋白可以辅助其他生物标志物更准确的鉴别典型PD患者和其他PD综合征患者。
2.4 UCH-L1
UCH-L1是泛素-蛋白酶体系统的成员,在家族性PD患者中发现UCH-L1蛋白表达异常。与正常人相比,PD,MSA和PSP患者脑脊液中UCH-L1含量均明显下降。UCH-L1用于鉴别PD患者和正常人时的受试者工作特征曲线下面积达0.89。而且PD患者脑脊液UCH-L1的水平与α-Syn水平成正相关[36]。UCH-L1可结合α-Syn作为PD的候选生物标志物。
2.5 人激肽释放酶6(human kallikrein 6,hK6)
hK6别名neurosin,是中枢神经系统丝氨酸蛋白酶家族的成员。广泛分布于脑组织和脑脊液、血浆和母乳等体液中[37],是切割α-Syn的酶之一,主要以25 ku酶原形式存在于脑脊液中[38]。α-Syn转基因小鼠脑内hK6含量下降[39]。同样PD和AD患者黑质区hK6含量低于正常人[40]。Wennström等[18]发现,PD,DLB和PDD等α-Syn病患者脑脊液中hK6水平低于正常人和AD患者,并且与α-Syn含量显著相关。AD患者血浆hK6含量下降[41],但关于PD患者和正常人之间血浆中hK6含量的比较还未见研究报道。
2.6 神经纤维细丝轻链(neurofilament light chain,NF-L)
NF是重要的结构蛋白,在神经冲动传导和维持神经元形态完整中起关键作用[42],可以作为神经退行性疾病和急性神经组织损伤所致的轴突退化的生物标志物[43]。NF由3个不同分子量亚基组成:轻链、中链和重链。NF-L形成NF的支柱并可自行组装。研究发现,PD患者脑脊液的NF-L浓度没有变化,但是MSA,PSP,DLB,AD和APD患者的脑脊液中NF-L浓度明显升高[13,31],提示这些疾病神经退化进展更加迅速。持续跟踪发现,随着疾病进展,PD综合征患者的脑脊液NF-L水平保持稳定[44]。
3 氧化应激相关生物标志物
氧化应激在PD发病机制中扮演了重要角色[45]。当机体的活性氧基团水平超过细胞抗氧化防御能力时便会导致氧化应激,直接损害或通过一系列过氧化链式反应引起DNA、蛋白质及脂质的氧化降解,影响细胞结构和功能的完整性。
3.1 DJ-1蛋白
DJ-1蛋白具有广泛的神经保护作用,保护神经元免受氧化应激损伤。DJ-1蛋白由PARK7基因编码,此基因缺陷会导致常染色体隐性遗传性PD。不同研究关于PD患者脑脊液内DJ-1含量变化的结论不一致。Herbert等[10]发现,PD患者脑脊液DJ-1含量低于MSA患者;Hong等[14]发现PD患者脑脊液DJ-1含量明显低于正常人和AD患者,但Salvesen等[46]发现,不同PD综合征之间DJ-1含量并无差异。Lin等[47]研究表明,PD患者血液的DJ-1水平和正常人相比没有变化,但是经4-羟基-2-壬烯酸(4-hydroxy-2-nonenal,4-HNE)修饰的DJ-1在晚期PD患者血液中明显降低,推测4-HNE修饰的DJ-1可能是PD晚期的候选标志物之一。
3.2 8-羟基脱氧鸟苷(8-hydroxy-2′-deoxyguano⁃sine,8-OHdG)
8-OHdG是活性氧自由基攻击DNA分子中的鸟嘌呤碱基8位碳原子而产生的氧化产物,是氧化应激的可靠标志。研究显示,在脑脊液中,非痴呆型PD患者的8-OHdG水平高于正常人[48](P=0.022)。在血液中,非痴呆型PD患者和PDD患者的8-OHdG水平均明显高于正常人[49]。
3.3 尿酸(uric acid,UA)
UA是嘌呤代谢的终末产物,能清除氧自由基,螯合金属离子,减轻体内氧化应激水平,是人体主要抗氧化剂之一。对4695位参与者持续9.4年的跟踪调查发现,血清UA水平高的人患PD的风险低[50]。Annanmaki等[51]研究表明,PD患者血浆尿酸水平低于正常人。另一研究同样发现,PD患者的血清UA水平低于正常人。脑脊液中,非痴呆型PD患者UA水平和正常人无差异,但高于PDD患者。正常人脑脊液中UA和Aβ42的总体相关系数ρ达0.67,非痴呆型PD患者的脑脊液中两者ρ达0.49。故脑脊液中UA含量和Aβ42含量正相关,推测脑脊液UA通过Aβ42相关通路参与机体认知功能的变化[52]。
3.4 辅酶Q10(coenzyme Q10,CoQ10)
CoQ10是脂溶性的抗氧化剂,是线粒体呼吸链酶复合体I的电子接受体,对多巴胺神经元具有一定的营养和保护作用。病理条件下,CoQ10与其氧化形式间的平衡关系被打破。PD患者脑脊液中氧化型CoQ10与总CoQ10的比值(%CoQ10)显著高于正常人,且比值大小与PD病程进展呈负相关。因此,%CoQ10可用于评价PD药物的治疗效果[53]。Sohmiya等[54]发现,PD患者的总CoQ10含量下降,%CoQ10高于正常人。
4 炎症免疫反应相关生物标志物
炎症免疫反应可保护机体免受内外环境病理损害,但过度炎症免疫反应会损伤宿主细胞,加速神经元的变性,是多种神经退行性疾病发病的病理基础,属于非特异性生物标志物。在PD患者黑质区检测到小胶质细胞激活和T淋巴细胞浸润[55]。在PD患者的脑脊液和血清中检测到肿瘤坏死因子α,白细胞介素(interleukin,IL)-1β,IL-6和干扰素γ等细胞因子明显增加[56]。因此,使用抗炎免疫调节药物调控炎症免疫细胞的异常活性,可一定程度上减缓PD的发展进程。
4.1 白细胞介素
IL是一种淋巴因子,激活与调节免疫细胞的增殖与分化,在炎症反应中起重要作用。Zhang等[57]报道,PD患者脑脊液中IL-8增加。另一研究发现,认知损伤的PD患者脑脊液IL-6水平明显高于正常人和非认知损伤PD患者,并且认知损伤的PD患者的IL-6水平和蒙特利尔认知评估(Montreal cogni⁃tive assessment,MoCA)量表评分呈负相关[58],提示IL-6的神经毒性影响认知损伤。Scalzo等[59]发现,PD患者血清IL-6水平显著增高,同时IL-6水平相对高的PD患者步态减慢,更易疲劳。然而另一研究表明,PD患者血清IL-6水平和正常人之间没有差异,但是PD患者血清中的肿瘤坏死因子α,IL-1β,IL-2和IL-10水平明显高于正常人[60]。
4.2 C反应蛋白(C-reactive protein,CRP)
CRP是一种主要在肝合成的微量蛋白,是急性期炎症反应的非特异性标志物。组织受损时血清中的CRP水平升高,主要受IL-6调控[61]。Lindqvist等[62]发现,在排除年龄、性别和身体状况等因素后,PDD患者脑脊液CRP水平明显高于非痴呆PD患者和正常人。在PD患病时间、年龄、性别、身体状况和痴呆程度一致的条件下,高CRP水平患者的抑郁症更加严重。PD患者血清或血浆CRP水平明显高于正常人[63-65]。Farias等[63]研究表明,PD治疗药物左旋多巴和卡比多巴联用后,患者血浆CRP的含量增加。Zhang等[65]研究表明PD患者运动功能评分与疾病严重程度均和CRP水平显著相关。
5 神经营养因子相关生物标志物
神经营养因子有营养神经元,刺激轴突再生、再髓鞘化,调节小胶质细胞的功能。神经营养因子包括神经营养素家族、胶质源性神经生长因子家族、促神经生成细胞因子家族、运动神经元神经营养因子以及非特异性神经系统类的营养因子等多个家族。神经营养因子补充疗法和基因疗法为治疗PD带来一丝希望。
5.1 脑源性神经生长因子(brain-derived neuro⁃trophic factor,BDNF)
BDNF主要是在中枢神经系统内表达,海马和皮质区的含量最高。BDNF为多巴胺能神经元提供营养支持,既是神经保护分子,又是神经调节物质。当BDNF的表达被抑制时,PD患者的黑质多巴胺能神经元受损,认知功能减退。当表达增强时,突触的可塑性提高,患者的认知功能得到一定改善[66]。Zhang等[57]研究表明,PD患者脑脊液BDNF水平下降。Pålhagen等[67]发现,伴有重度抑郁症的PD患者脑脊液的BDNF水平低于单纯的重度抑郁症患者。Salehi等[68]却发现,PD患者脑脊液BDNF含量升高,可能是因为生理条件下主要由神经元表达BDNF,但大脑受到损害时由小胶质细胞代替合成。PD患者血清BDNF含量下降[69-71],有趣的是,Costa等[69]发现,BDNF和认知能力下降存在关联;Paula等[70]发现,BDNF水平和疾病的严重程度相关。
5.2 胰岛素样生长因子1(insulin-like growth factor-1,IGF-1)
IGF是细胞增殖调控因子,包括胰岛素、IGF-1和IGF-2三类蛋白多肽。IGF-1主要在肝合成释放入血,局部组织则以自分泌和旁分泌形式产生IGF-1。其生理活性受IGF结合蛋白和IGF-1受体的调节。IGF-1可以增强神经元的代谢并且调节神经元的兴奋性,保护多巴胺能神经元免受损伤。Mashayekhi等[72]发现,PD患者脑脊液和血清IGF-1水平均明显高于正常人。研究表明,处于临床前期的PD患者血清IGF-1表达上升[73-74],并且IGF-1水平和运动功能评分显著相关,提示IGF-1是一个评估个体患PD风险的有效工具。
6 其他生物标志物
近来发现一些生物标志物同样值得关注。Lu等[75]采用蛋白质组学技术发现,PD患者血清和正常人血清相比,存在6个差异蛋白质,经Western蛋白印迹法验证了其中的3个蛋白质。发现PD患者血清中纤维蛋白原γ链和间α胰蛋白酶抑制剂重链4(inter-alpha-trypsin inhibitor heavy chain family member 4,ITI-H4)表达明显升高,血清载脂蛋白A-Ⅳ(apolipoprotein A-Ⅳ,apoA-Ⅳ)26 ku片段和ITI-H4 35 ku片段表达明显下降。进行差异蛋白功能分析,发现这3个蛋白质与炎症、脂质代谢等PD发病机制有关。后续计划扩大患者样本量,确证差异蛋白是否有望成为生物标志物。
7 结语
理想的PD生物标志物应当具备以下条件[76]:能够符合PD的分子病理特征,且在确诊的PD患者上得到验证;能应用于PD的早期诊断;诊断PD的准确率和特异度均大于80%;适用于常规的临床检验,具有可重复、非侵袭和易于操作等特点。生物标志物可用于疾病的早期诊断、疾病进程监测及药物疗效评价。反过来,在多种PD动物模型上验证来自PD患者的生物标志物,有助于深入探索PD发病机制,挖掘新的药物作用靶点。
PD患者脑脊液和血液来源的生物标志物分别总结于表1和表2。脑脊液与脑组织细胞外液直接相连,能动态反映脑组织的代谢情况及内环境稳定性,但是需经腰椎穿刺获取,且含量少,多次采集对人体有侵袭伤害。血液相对脑脊液容易获取。血液通过血液循环与机体内各组织的微环境紧密联系,理论上可反映机体各个部位的疾病变化。血液由血细胞和血浆组成,其中红细胞里也含有α-Syn和DJ-1等蛋白,若采血操作不当,则会干扰血浆生物标志物的检测。而血浆中的蛋白种类丰富,高丰度蛋白会一定程度影响低丰度蛋白的鉴定。
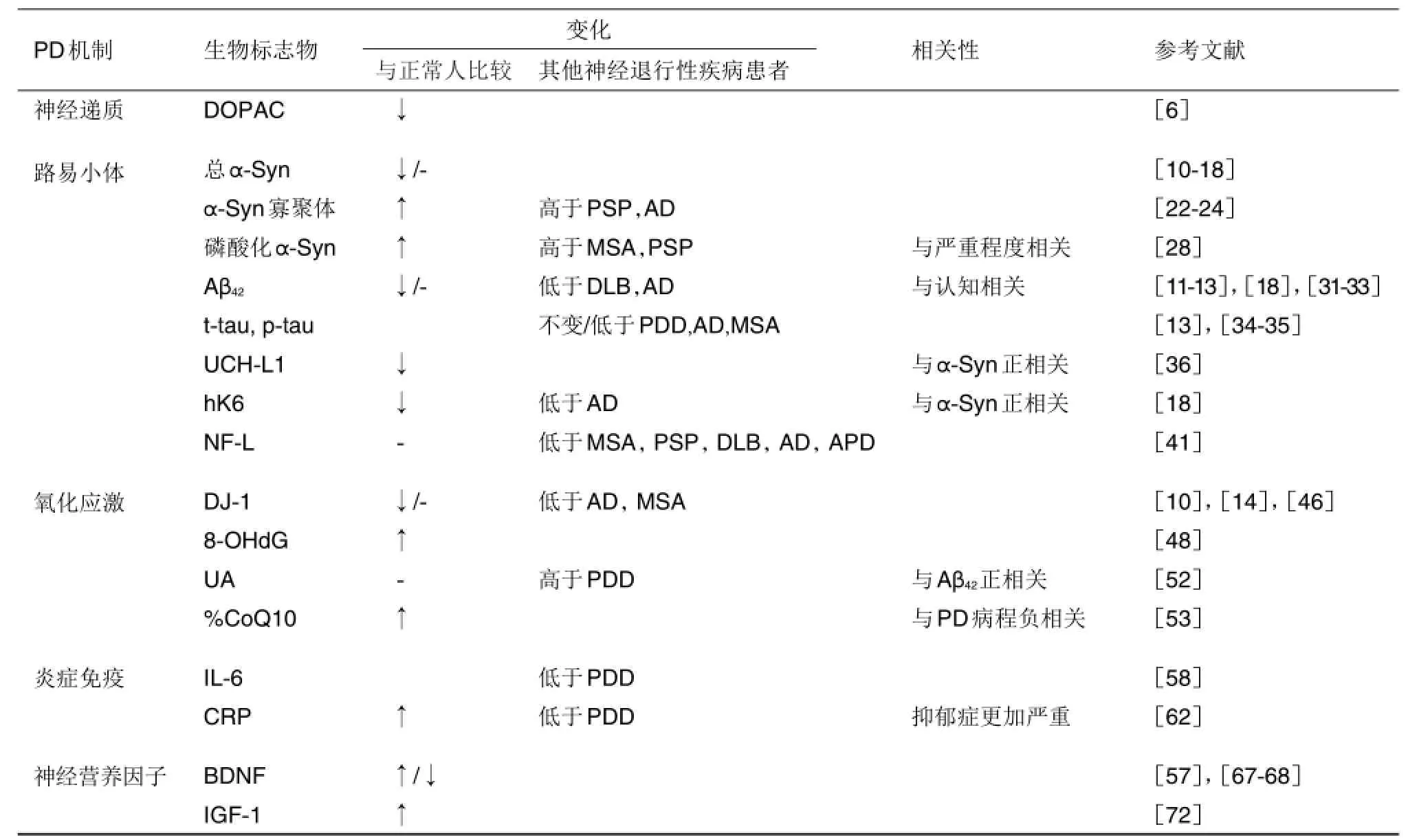
表1 帕金森病(PD)患者脑脊液候选生物标志物
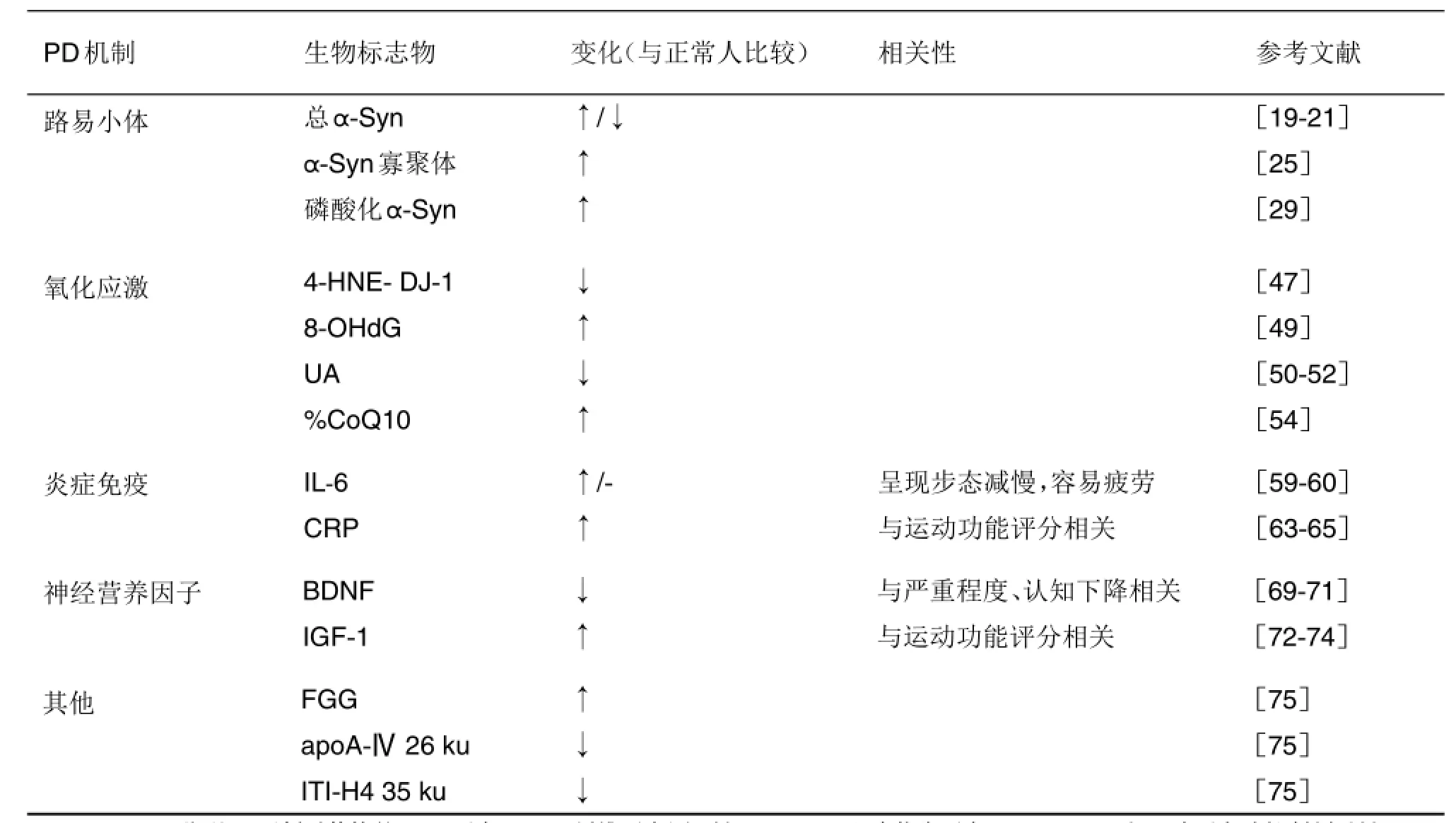
表2 PD患者血液(血浆或血清)候选生物标志物
综上所述,仅通过某个独特的生物标志物,既要高度灵敏、特异性地鉴别PD和其他神经退行性疾病,又可跟踪整个PD进展可能难以实现。因此,除了继续发现新的PD生物标志物外,有必要建立一个针对PD不同阶段的组合生物标志物体系[77],进行个体化诊断和治疗,有效提高疾病诊断的特异度和敏感度。采用大脑PET代谢成像标志物,嗅觉减退、快动眼睡眠行为障碍和自主神经功能障碍等非运动症状标志物,以及脑脊液总α-Syn或血浆UA等生化标志物,联合作为组合生物标志物用于PD的早期诊断。另外,为鉴别诊断典型PD和其他PD综合征,尝试建立胆碱能功能成像标志物和脑脊液NF-L等生化标志物相结合的组合标志物。最后为了追踪PD发展进程、监测PD药物治疗效果,建立包括MRI影像学、PD统一评定量表和脑脊液%氧化型CoQ10与总CoQ10比值等相结合的组合生物标志物[78]。
在今后的研究中,需要将组合生物标志物体系中筛选的生物标志物群在多个独立研究中进行评价和指标量化。期待在不久的将来,组合生物标志物实现基础研究与医学实践之间的转化医学研究,早日将研究成果用于PD的临床诊断和药物疗效评价,实现基础研究与临床应用之间的转化研究。
[1]Alves G,Forsaa EB,Pedersen KF,Dreetz Gjerstad M,Larsen JP.Epidemiology of Parkinson′s disease[J].J Neurol,2008,255(5):18-32.
[2]Ma L,Su L,Xie J,Long X,Wu P,Gu L.The prevalence and incidence of Parkinson′s disease in China:a systematic review and meta-analysis[J].J Neural Transm,2014,121(2):123-134.
[3]Adler CH,Beach TG,Hentz JG,Shill HA,Cavi⁃ness JN,Driver-Dunckley E,et al.Low clinical di⁃agnostic accuracy of early vs advanced Parkinson disease:clinicopathologic study[J].Neurology,2014,83(5):406-412.
[4]Fearnley JM, Lees AJ.Ageing and Parkinson′s disease:substantia nigra regional selectivity[J].Brain,1991,114(Pt 5):2283-2301.
[5]GoldsteinDS.Biomarkers,mechanisms,and potential prevention of catecholamine neuron loss in Parkinson disease[J].Adv Pharmacol,2013,68:235-272.
[6]Goldstein DS,Holmes C,Sharabi Y.Cerebrospinal fluid biomarkers of central catecholamine deficiency in Parkinson′s disease and other synucleinopathies[J].Brain,2012,135(Pt 6):1900-1913.
[7]Chen JJ,Tian MX,Li XA,Hu LS.An analysis of protein bioinformatics datasets related to Lewy bodies of Parkinson′s disease[J].Prog Biochem Biophys(生物化学与生物物理进展),2013;40(11):1100-1106.
[8]Delenclos M, Jones DR,McLean PJ,Uitti RJ. Biomarkers in Parkinson′s disease:advances and strategies[J].Parkinsonism Relat Disord,2016,22(Suppl 1):S106-S110.
[9]Henchcliffe C,Dodel R,Beal MF.Biomarkers of Parkinson′s disease and dementia with Lewy bodies[J].Prog Neurobiol,2011,95(4):601-613.
[10]Herbert MK,Eeftens JM,Aerts MB,Esselink RA,Bloem BR,Kuiperij HB,et al.CSF levels of DJ-1 and tau distinguish MSA patients from PD patients and controls[J].ParkinsonismRelatDisord,2014,20(1):112-115.
[11]Nielsen HM,Hall S,Surova Y,Nägga K,Nilsson C,Londos E,et al.Low levels of soluble NG2 in cere⁃brospinal fluid from patients with dementia with Lewy bodies[J].J Alzheimers Dis,2014,40(2):343-350.
[12] Trupp M,Jonsson P,Ohrfelt A,Zetterberg H,Obudulu O,Malm L,et al.Metabolite and peptide levels in plasma and CSF differentiating healthy controls from patients with newly diagnosed Parkinson′s disease[J].J Parkinsons Dis,2014;4(3):549-560.
[13]Hall S,Öhrfelt A,Constantinescu R,Andreasson U,Surova Y,Bostrom F,et al.Accuracy of a panel of 5 cerebrospinal fluid biomarkers in the differential diagnosis of patients with dementia and/or parkin⁃sonian disorders[J].Arch Neurol,2012,69(11):1445-1452.
[14]Hong Z,Shi M,Chung KA,Quinn JF,Peskind ER,Galasko D,et al.DJ-1 and alpha-synuclein in human cerebrospinal fluid as biomarkers of Parkinson′s disease[J].Brain,2010,133(Pt 3):713-726.
[15]Andersen AD,Binzer M,Stenager E,Gramsberg JB. Cerebrospinalfluid biomarkers for Parkinson′s disease-a systematic review[J].Acta Neurol Scand,2017,135(1):34-56.
[16] Shi M,Liu C,Cook TJ,Bullock KM,Zhao Y,Ginghina C,et al.Plasma exosomal α-synuclein is likely CNS-derived and increased in Parkinson′s disease[J].Acta Neuropathol,2014,128(5):639-650.
[17]van Dijk KD,Bidinosti M,Weiss A,Raijmakers P,Berendse HW,van de Berg WD.Reduced α-synu⁃clein levels in cerebrospinal fluid in Parkinson′s disease are unrelated to clinicaland imaging measures of disease severity[J].Eur J Neurol,2014,21(3):388-394.
[18]Wennström M,Surova Y,Hall S,Nilsson C,Minthon L,Boström F,et al.Low CSF levels of both α-synuclein and the α-synuclein cleaving enzyme neurosin in patients with synucleinopathy[J].PLoS One,2013,8(1):e53250.
[19]Duran R,Barrero FJ,Morales B,Luna JD,Ramirez M,Vives F.Plasma alpha-synuclein in patients with Parkinson′s disease with and without treatment[J].Mov Disord,2010,25(4):489-493.
[20]Gorostidi A, Bergareche A, Ruiz-Martínez J,Martí-Massó JF,Cruz M,Varghese S,et al. Αlpha-synuclein levels in blood plasma from LRRK2 mutation carriers[J].PLoS One,2012,7(12):e52312.
[21]Mata IF1,Shi M,Agarwal P,Chung KA,Edwards KL,Factor SA,et al.SNCA variant associated with Parkinson disease and plasma alpha-synuclein level[J].Arch Neurol,2010,67(11):1350-1356.
[22]Tokuda T,Qureshi MM,Ardah MT,Varghese S,Shehab SA,Kasai T,et al.Detection of elevated levels of α-synuclein oligomers in CSF from pa⁃tientswith Parkinson disease[J].Neurology,2010,75(20):1766-1772.
[23]Parnetti L,Farotti L,Eusebi P,Chiasserini D,De Carlo C,Giannandrea D,et al.Differential role of CSF alpha-synuclein species,tau,and Aβ42in Parkinson′s disease[J].Front Aging Neurosci,2014,6:53.
[24]Park MJ,Cheon SM,Bae HR,Kim SH,Kim JW. Elevated levels of α-synuclein oligomer in the cerebrospinal fluid of drug-naïve patients with Parkinson′s disease[J].J Clin Neurol,2011,7(4):215-222.
[25]El-Agnaf OM,Salem SA,Paleologou KE,Curran MD. Gibson MJ,Court JA,et al.Detection of oligomeric forms of alpha-synuclein protein in human plasma as a potential biomarker for Parkinson′s disease[J].FASEB J,2006,20(3):419-425.
[26]Gorbatyuk OS,Li S,Sullivan LF,Chen W,Kondrikova G,Manfredsson FP,et al.The phos⁃phorylation state of Ser-129 in human alpha-synu⁃clein determines neurodegeneration in a rat model of Parkinson disease[J].Proc Natl Acad Sci USA,2008,105(2):763-768.
[27]Fujiwara H,Hasegawa M,Dohmae N,Kawashima A,Masliah E,Goldberg MS,et al.alpha-Synuclein isphosphorylated in synucleinopathy lesions[J].Nat Cell Biol,2002,4(2):160-164.
[28]Wang Y,Shi M,Chung KA,Zabetian CP,Berg D,Srulijes KA,et al.Phosphorylated alpha-synuclein in Parkinson′s disease[J].Sci Trans Med,2012,4(6):1-27.
[29]Foulds PG,Mitchell JD,Parker A,Turner R,Green G,Diggle P,et al.Phosphorylated α-synu⁃clein can be detected in blood plasma and is poten⁃tially a useful biomarker for Parkinson′s disease[J].FASEB J,2011,25(12):4127-4137.
[30]Ballard C,Gauthier S,Corbett A,Brayne C,Aarsland D,Jones E.Alzheimer′s disease[J].Lancet,2011,377(9770):1019-1031.
[31]Bech S,Hjermind LE,Salvesen L,Nielsen JE,Heegaard NH,Jørgensen HL,et al.Amyloid-related biomarkers and axonal damage proteins in parkin⁃sonian syndromes[J].Parkinsonism Relat Disord,2012,18(1):69-72.
[32]SüssmuthSD,UttnerI,LandwehrmeyerB,Pinkhardt EH,Brettschneider J,Petzold A,et al. Differential pattern of brain-specific CSF proteins tau and amyloid-β in Parkinsonian syndromes[J].Mov Disord,2010,25(9):1284-1288.
[33]Alves G,Lange J,Blennow K,Zetterberg H,Andreasson U,Førland MG,et al.CSF Aβ42predicts early-onset dementia in Parkinson disease[J].Neurology,2014,82(20):1784-1790.
[34]Shi M,Bradner J,Hancock AM,Chung KA,Quinn JF,Peskind ER,et al.Cerebrospinal fluid biomarkers for Parkinson disease diagnosis and progression[J].Ann Neurol,2011,69(3):570-580.
[35]Parnetti L,Tiraboschi P,Lanari A,Peducci M,Padiglioni C,D′amore C,et al.Cerebrospinal fluid biomarkers in Parkinson′s disease with dementia and dementia with Lewy bodies[J].Biol Psychiatry,2008,64(10):850-855.
[36]Mondello S,Constantinescu R,Zetterberg H,Andreasson U,Holmberg B,Jeromin A.CSF α-synuclein and UCH-L1 levels in Parkinson′s disease and atypical parkinsonian disorders[J].Parkinsonism Relat Disord,2014,20(4):382-387.
[37]Diamandis P,Yousef M,Soosaipillai R,Grass L,Porter A,Little S,et al.Immunofluorometric assay of human kallikrein 6(zyme/protease M/neurosin)and preliminary clinical applications[J].Clin Biochem,2000,33(5):369-375.
[38]Okui A,Kominami K,Uemura H,Mitsui S,Yamaguchi N.Characterization of a brain-related serine protease,neurosin(human kaillikrein 6),in human cerebrospinal fluid[J].Neuroreport,2001,12(7):1345-1350.
[39]Spencer B,Michael S,Shen J,Kosberg K,Rockenstein E,Patrick C,et al.Lentivirus mediat⁃ed delivery of neurosin promotes clearance of wildtype α-synuclein and reduces the pathology in an α-synuclein model of LBD[J].Mol Ther,2013,21(1):31-41.
[40]Ogawa K,Yamada T,Tsujioka Y,Taguchi J,Takahashi M,Tsuboi Y,et al.Localization of a novel type trypsin-like serine protease,neurosin,in brain tissues ofAlzheimer′s disease and Parkinson′s disease[J].Psychiatry Clin Neurosci,2000,54(4):419-426.
[41]Menendez-Gonzalez M,Castro-Santos P,Suarez A,Calatayud MT,Perez-Pinera P,Martinez M,et al. Value of measuring plasmatic levels of neurosin in the diagnosis of Alzheimer′s disease[J].J Alzheimers Dis,2008,14(1):59-67.
[42]Elder GA,Friedrich VL Jr,Bosco P,Kang C,Gourov A,Tu PH,et al.Absence of the mid-sized neurofilament subunit decreases axonal calibers,levels of light neurofilament(NF-L),and neurofila⁃ment content[J].J Cell Biol,1998,141(3):727-739.
[43]Petzold A.Neurofilament phosphoforms:surrogate markers for axonal injury,degeneration and loss[J].J Neurol Sci,2005,233(1/2):183-198.
[44]Constantinescu R, Rosengren L, Johnels B,Zetterberg H,Holmberg B.Consecutive analyses of cerebrospinal fluid axonal and glial markers in Parkinson′s disease and atypical Parkinsonian disorders[J].Parkinsonism Relat Disord,2010,16(2):142-145.
[45]Jenner P.Oxidative stress and Parkinson′s disease[J].Handb Clin Neurol,2007,83:507-520.
[46]Salvesen L,Bech S,Lokkegaard A,Hjermind LE,Nielsen JE,Pakkenberg B,et al.The DJ-1 concentration in cerebrospinal fluid does not differentiate among Parkinsonian syndromes[J].Parkinsonism Relat Disord,2012,18(7):899-901.
[47]Lin X,Cook TJ,Zabetian CP,Leverenz JB,Peskind ER,Hu SC,et al.DJ-1 isoforms in whole blood as potential biomarkers of Parkinson disease[J].Sci Rep,2012,2:954.
[48]Gmitterová K, Heinemann U, Gawinecka J,Varges D,Ciesielczyk B,Valkovic P,et al.8-OHdG in cerebrospinal fluid as a marker of oxidativestress in various neurodegenerative diseases[J].Neurodegener Dis,2009,6(5/6):263-269.
[49]Bogdanov M,Matson WR,Wang L,Matson T,Saunders-Pullman R,Bressman SS,et al.Metab⁃olomic profiling to develop blood biomarkers for Parkinson′s disease[J].Brain,2008,131(Pt 2):389-396.
[50]De Lau LM,Koudstaal PJ,Hofman A,Breteler MM. Serum uric acid levels and the risk of Parkinson disease[J].Ann Neurol,2005,58(5):797-800.
[51]Annanmaki T,Muuronen A,Murros K.Low plasma uric acid level in Parkinson′s disease[J].Mov Dis⁃ord,2007,22(8):1133-1137.
[52]Maetzler W,Stapf AK,Schulte C,Hauser AK,Lerche S,Wurster I,et al.Serum and cerebrospinal fluid uric acid levels in lewy body disorders:ssocia⁃tions with disease occurrence and amyloid-β pathway[J].J Alzheimers Dis,2011,27(1):119-126.
[53]Isobe C, Murata T, Sato C, Terayama Y. Increase of oxidized/total coenzyme Q-10 ratio in cerebrospinal fluid in patients with Parkinson′s disease[J].J Clin Neurosci,2007,14(4):340-343.
[54]Sohmiya M,Tanaka M,Tak NW,Yanagisawa M,Tanino Y,Suzuki Y,et al.Redox status of plasma coenzyme Q10 indicates elevated systemic oxida⁃tive stress in Parkinson′s disease[J].J Neurol Sci,2004,223(2):161-166.
[55]Hirsch EC,Vyas S,Hunot S.Neuroinflammation iin Parkinson′s disease[J].Parkinsonism Relat Disord,2012,18(Suppl 1):S210-S212.
[56]Hirsch EC, Hunot S. Neuroinflammation in Parkinson′s disease:a target for neuroprotec⁃tion?[J].Lancet Neurol,2009,8(4):382-397.
[57] Zhang J,Sokal I,Peskind ER,Quinn JF,Jankovic J,Kenney C,et al.CSF multianalyte profile distin⁃guishes Alzheimer and Parkinson diseases[J].Am J Clin Pathol,2008,129(4):526-529.
[58] Yu SY,Zuo LJ,Wang F,Chen ZJ,Hu Y,Wang YJ,et al.Potential biomarkers relating pathological pro⁃teins,neuroinflammatory factors and free radicals in PD patients with cognitive impairment:a corssessectional study[J].BMC Neurol,2014,14:113.
[59] Scalzo P,Kümmer A,Cardoso F,Teixeira AL. Serum levels of interleukin-6 are elevated in pa⁃tients with Parkinson′s disease and correlate with physical performance[J].Neurosci Lett,2010,468(1):56-58.
[60] Williams-Gray H,Wijeyekoon Ruwani,Yarnall J,Lawson A,Breen P,Evans R,et al.Serum immune markers and disease progression in an incident Parkinson′s disease cohort(ICICLE-PD)[J].Mov Disord,2016,31(7):995-1003.
[61] Pepys MB,Hirschfield GM.C-reactive protein:a critical update[J].J Clin Invest,2003,111(12):1805-1812.
[62] Lindqvist D,Hall S,Surova Y,Nielsen HM,Janelidze S,Brundin L,Hansson O.Cerebrospinal fluid inflammatory markers in Parkinson′s diseaseassociations with depression,fatigue,and cognitive impairment[J].Brain Behav Immun,2013,33:183-189.
[63] de Farias CC,Maes M,Bonifácio KL,Bortolasci CC,de Souza Nogueira A,Brinholi FF,et al.Highly specific changes in antioxidant levels and lipid per⁃oxidation in Parkinson′s disease and its progres⁃sion:Disease and staging biomarkers and new drug targets[J].Neurosci Lett,2016,617:66-71.
[64] Umemura A,Oeda T,Yamamoto K,Tomita S,Kohsaka M,Park K,et al.Baseline plasma C-reactive protein concentrations and motor progno⁃sis in Parkinson disease[J].PLoS One,2015,10(8):e0136722.
[65] Zhang L,Yan J,Xu Y,Long L,Zhu C,Chen X,et al.The combination of homocysteine and C-reactive protein predicts the outcomes of Chinese patients with Parkinson′s disease and vascular parkinsonism[J].PLoS One,2011,6(4):e19333.
[66] Fumagalli F,Racagni G,Riva A.Shedding light into the role of BDNF in the pharmacotherapy of Parkinson′s disease[J].Pharmacogenomics J,2006,6(2):95-104.
[67] Pålhagen S,Qi H,Mårtensson B,Wålinder J,Granérus AK,Svenningsson P.Monoamines,BDNF,IL-6 and corticosterone in CSF in patients with Parkinson′s disease and major depression[J].J Neurol,2010,257(4):524-532.
[68]Salehi Z,Mashayekhi F.Brain-derived neurotrophic factor concentrations in the cerebrospinal fluid of patients with Parkinson′s disease[J].J Clin Neurosci,2009,16(1):90-93.
[69]Costa A,Peppe A,Carlesimo GA,Zabberoni S,Scalici F, Caltagirone C,et al.Brain-derived neurotrophic factor serum levels correlate with cognitiveperformanceinParkinson′sdisease patients with mild cognitive impairment[J].Front Behav Neurosci,2015,9:253.
[70]Scalzo P, Kümmer A,Bretas TL,Cardoso F,Teixeira AL.Serum levels of brain-derived neurotrophic factor correlate with motor impairment in Parkinson′s disease[J].J Neurol,2010,257(4):540-545.
[71]Ziebell M,Khalid U,Klein AB,Aznar S,Thomsen G,Jensen P,Knudsen GM.et al.Striatal dopamine transporter binding correlates with serum BDNF levels in patients with striatal dopaminergic neuro⁃degeneration[J].Neurobiol Aging,2012,33(2):428.e1-428.e5.
[72]Mashayekhi F,Mirzajani E,Naji M,Azari M. Expression of insulin-like growth factor-1 and insulinlike growth factor binding proteins in the serum and cerebrospinal fluid of patients with Parkinson′s disease[J].J Clin Neurosci,2010,17(5):623-627.
[73]Godau J,Knauel K,Weber K,Brockmann K,Maetzler W,Binder G,et al.Serum insulin-like growth factor 1 as possible marker for risk and early diagnosis of Parkinson disease[J].Arch Neurol, 2011,68(7):925-931.
[74]Picillo M, Erro R,Santangelo G, Pivonello R,Longo K,Pivonello C,et al.Insulin-like growth factor-1 and progression of motor symptoms in early,drug-naïve Parkinson′s disease[J].JNeurol,2013,260(7):1724-1730.
[75]Lu W,Wan X,Liu B,Rong X,Zhu L,Li P,et al. Specific changes of serum proteins in Parkinson's disease patients[J].PLoS One,2014,9(4):e95684.
[76]Berg D.Biomarkers for the early detection of Parkinson‘s and Alzheimer′s disease[J].Neuro⁃degener Dis,2008,5(3/4):133-136.
[77]Wang J.Multiple biomarkers for predicting cardio⁃vascular events:lessons learned[J].J Am Coll Cardiol,2010,55(19):2092-2095.
[78]Picillo M,Moccia M,Spina E,Barone P,Pellecchia MT. Biomarkers of Parkinson′s disease:recent insights,current challenges,and future prospects[J].J Par⁃kinsonism Restless Legs Syndr,2016,6:1-13.
Overview of cerebrospinal fluid and blood candidate biomarkers in Parkinson disease
CUI Dan-dan,WANG Xiao-liang,PENG Ying
(Institute of Materia Medica,Chinese Academy of Medical Sciences&Peking Union Medical College,Beijing 100050,China)
Parkinson disease(PD)is a common,progressive and disabling neurodegenerative movement disorder.Diagnosis of PD depends on clinical history and physical examination,but misdi⁃agnosis is common in early stages because of similar symptoms to other movement disorders.which is why biomarkers are urgently needed to accurately diagnose PD,especially in the early stages of PD,and find new drug targets.This review discusses the curient research of the PD candidate biomarkers from cerebrospinal fluid and blood in terms of PD pathogenesis.We have found that dihy⁃droxyphenylacetic acid,alpha-synuclein and its related proteins in Lewy bodies,8-hydroxy deoxy⁃guanosine,uric acid,interleukin and neurotrophic factors are potential biomarkers.They participate in different stages of PD.In order to enhance the accuracy of early diagnosis and efficacy of drugs evalua⁃tion,we are to use multiple biomarkers rather than a single biomarker,in combination with different biologic pathways of biomarkers,neuroimaging as well as clinical symptoms.
Parkinson disease;biomarker;cerebrospinal fluid;blood
s:WANG Xiao-liang,E-mail:wangxl@imm.ac.cn;PENG Ying,E-mail:ypeng@imm.ac.cn
R966
A
1000-3002-(2016)12-1254-10
10.3867/j.issn.1000-3002.2016.12.004
Foundation item:The project supported by National of Science and Technology Mega Project of China(2012ZX09301002-004);and Beijing Key Laboratory of New Drug Mechanisms and Pharmacological Evaluation Study(BZ0150)
2016-10-10接受日期:2016-12-14)
(本文编辑:齐春会)
国家科技重大专项(2012ZX09301002-004);新药作用机制研究与药效评价北京市重点实验室资助(BZ0150)
王晓良,E-mail:wangxl@imm.ac.cn;彭 英,E-mail:ypeng@imm.ac.cn

