肿瘤坏死因子-α对人脐静脉内皮细胞中组织蛋白酶K表达的影响
张 良 张 翼 唐秋红 林楚伟 周胜华
(1 湖南省人民医院心内科,长沙市 410005,E-mail:iarry@sina.com;2 中南大学湘雅二医院肾内科,长沙市 410011;3 长沙市中心医院心内科,长沙市410004;4 中南大学湘雅二医院心内科,长沙市 410011)
论著·基础研究
肿瘤坏死因子-α对人脐静脉内皮细胞中组织蛋白酶K表达的影响
张 良1张 翼1唐秋红2林楚伟3周胜华4
(1 湖南省人民医院心内科,长沙市 410005,E-mail:iarry@sina.com;2 中南大学湘雅二医院肾内科,长沙市 410011;3 长沙市中心医院心内科,长沙市410004;4 中南大学湘雅二医院心内科,长沙市 410011)
目的 观察不同浓度肿瘤坏死因子-α(TNF-α)和不同TNF-α作用时间对人脐静脉内皮细胞(HUVEC)中组织蛋白酶K(Cat K)表达的影响。方法 取对数生长期HUVEC进行实验。将HUVEC分为正常对照组、0.1 ng/ml TNF-α组、1 ng/ml TNF-α组、10 ng/ml TNF-α组、100 ng/ml TNF-α组,分别采用DMEM培养基、0.1 ng/ml TNF-α、1 ng/ml TNF-α、10 ng/ml TNF-α、100 ng/ml TNF-α作用24 h。另取HUVEC分为对照组、TNF-α 6 h组、TNF-α 12 h组、TNF-α 24 h组、TNF-α 48 h组,对照组DMEM培养基作用24 h,其他组采用10 ng/ml TNF-α作用相应时间。检测各组HUVEC中的Cat K mRNA和蛋白的表达情况。结果 与正常对照组比较,不同TNF-α浓度组的Cat K mRNA和Cat K蛋白表达水平均升高(P<0.05)。0.1 ng/ml TNF-α组、1 ng/ml TNF-α组、10 ng/ml TNF-α组Cat K mRNA和Cat K蛋白的表达水平依次增高(P<0.05),100 ng/ml TNF-α组Cat K mRNA和Cat K 蛋白表达水平较10 ng/ml TNF-α组下降(P<0.05)。与对照组比较,TNF-α各作用时间组Cat K mRNA和Cat K蛋白的表达水平增高(P<0.05);TNF-α 6 h组、TNF-α 12 h组、TNF-α 24 h组Cat K mRNA和Cat K蛋白的表达水平依次增高(P<0.05);TNF-α 48 h组Cat K mRNA和Cat K蛋白的表达水平较TNF-α 24 h组明显下降(P<0.05)。结论 在一定作用浓度及作用时间内,TNF-α可以呈剂量和时间依赖性刺激HUVEC中Cat K表达。TNF-α可能通过促进Cat K的表达促进动脉硬化的发生。
组织蛋白酶K;人脐静脉内皮细胞;肿瘤坏死因子-α;动脉硬化
肿瘤坏死因子(tumor necrosis factor,TNF)-α是由巨噬细胞和单核细胞产生的促炎细胞因子,可以调控多种炎症因子和生长因子的表达。有学者发现,动脉硬化兔血清TNF-α水平升高,血清TNF-α水平是心血管疾病危险因素,也是预测艾滋病毒感染者冠状动脉钙化的危险因素,提示TNF-α与动脉硬化发生有关系[1-2]。组织蛋白酶(cathepsin,Cat)K是组织蛋白酶家族中的重要成员,能降解细胞外基质(extracellular matrix,ECM),促进血管平滑肌细胞(vascular smooth muscle cell,VSMC)迁移,在人动脉硬化斑块中可见Cat K蛋白及基因表达水平增高[3];冠心病患者血清Cat K水平升高,并且Cat K可能是预测冠心病的生物标志物[4-5]。Keegan等[6]发现TNF-α可以促进血管内皮细胞中Cat K的表达,但是两者之间的时效和量效关系尚未完全清楚。本研究旨在探讨TNF-α对人脐静脉内皮细胞(human umbilical vein endothelial cell,HUVEC)中Cat K表达的影响。
1 材料和方法
1.1 主要材料 HUVEC购自中科院上海细胞库,人TNF-α购自PeproTech公司(批号300-01A),杜尔贝科改良伊格尔培养基(Dulbeceo′s modified eagle medium,DMEM)、胎牛血清购自上海Gibco公司,反转录试剂盒购自Fermentas公司(批号00216965),总RNA提取试剂Trizol-Reagent购自Invitrogen公司(批号204014),琼脂糖购自SABC公司,聚合酶链反应(polymerase chain reaction,PCR)maker购自天根公司,PCR引物由上海英骏生物公司提供,Cat K 抗体(Abcam公司 批号ab120950-9)、细胞核蛋白与细胞质蛋白抽取试剂盒购自Beyotime 公司。
1.2 方法
1.2.1 HUVEC的培养:HUVEC用含10%胎牛血清的DMEM培养基培养。将培养瓶放入37℃含5% CO2的培养箱内培养,每隔2~3 d换液一次,待细胞生长至融合状态时传代,取传至3~4代的细胞进行实验。
1.2.2 不同浓度TNF-α(母液浓度为1 000 ng/ml)的配制:按以下方法稀释:100 μl母液加入900 μl DMEM,得到100 ng/ml TNF-α;取100 μl 100 ng/ml TNF-α加入900 μl DMEM,得到10 ng/ml TNF-α;取100 μl 10 ng/ml TNF-α加入900 μl DMEM,得到1 ng/ml TNF-α;取100 μl 1 ng/ml TNF-α 加入900 μl DMEM,得到0.1 ng/ml TNF-α。1.2.3 实验分组:(1)不同浓度TNF-α对HUVEC表达Cat K的影响:① 正常对照组:采用DMEM培养HUVEC 24 h;② 0.1 ng/mlTNF-α组:采用终浓度0.1 ng/ml的TNF-α培养HUVEC 24 h;③ 1 ng/ml TNF-α组:采用终浓度1 ng/ml的TNF-α培养HUVEC 24 h;④ 10 ng/ml TNF-α组:采用终浓度10 ng/ml的TNF-α培养HUVEC 24 h;⑤ 100 ng/mlTNF-α组:采用终浓度100 ng/ml的TNF-α培养HUVEC 24 h。每组均设复孔,实验重复3次。(2)不同时间10 ng/ml TNF-α对HUVEC表达Cat K的影响:① 对照组:采用DMEM培养HUVEC 24 h;② TNF-α 6 h组:采用终浓度10 ng/ml的TNF-α培养HUVEC 6 h;③ TNF-α 12 h组:采用终浓度10 ng/ml的TNF-α培养HUVEC 12 h;④ TNF-α 24 h组:采用终浓度10 ng/ml的TNF-α培养HUVEC 24 h;⑤ TNF-α 48 h组:采用终浓度10 ng/ml的TNF-α培养HUVEC 48 h。每组均设复孔,实验重复3次。1.2.4 实时定量荧光PCR测定HUVEC中Cat K mRNA表达:将收集的HUVEC采用Trizol方法提取总RNA。取5 μl RNA用反转录试剂盒反转录为cDNA。取5 μl cDNA模板行PCR。根据GeneBank(https://www.ncbi.nlm.nih.gov/nuccore/NC_000001.11?report=genbank&from=150796208&to=150808441)的基因序列,采用Primer 5软件设计引物。引物由上海英骏生物公司合成。Cat K上游引物序列为:5′-ACTGGACTCAAAGTACCCCT-3′,下游引物序列为5′-GCCATCATTCTCAGACACAC-3′,长度为258 bp;选择β-肌动蛋白(β-Actin)作为半定量内对照引物,上游引物序列为:5′-ACACAGTGCTGTCTGGCG-3′,下游引物序列为5′-ATTTGCGGTGGACGATGG-3′,长度为234 bp。扩增条件为:95℃ 5 min预变性后,94℃变性30 s,60℃退火40 s,72℃延伸40 s,共38个循环。最后72℃延伸10 min。取PCR扩增产物5 μl点样于1%的琼脂糖凝胶上电泳,嗅化乙啶染色,紫外分光光度计观察电泳结果。Cat K和内参照β-actin的PCR产物长度分别是234 bp和258 bp,以Cat K/β-actin的A比值来表示Cat K mRNA在HUVEC的表达情况。1.2.5 Western blot检测HUVEC中Cat K蛋白的表达:用磷酸缓冲盐溶液清洗诱导分化成熟的各组HUVEC 2次,收集细胞并分瓶,按1 ml裂解液加100 mM苯甲基磺酰氟(phenylmethanesulfonyl fluoride,PMSF)10 μl,摇匀置于冰上。每微量离心管细胞加100 μl含PMSF的裂解液裂解,在4℃ 12 000 r/min离心10 min,将离心后的上清和还原型5×十二烷基磺酸钠上样缓冲液以4 ∶1比例以每管总25 μl体积分装转移至0.2 ml的微量离心管,以100℃加热10 min使蛋白质变性,变性蛋白质放于-80℃保存。蛋白上样量为每孔30 μg, 10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离蛋白,湿转法转移到聚偏氟乙烯膜上,10%胶用200 mA转移80 min左右。将膜放入含5%牛血清白蛋白和含0.1%吐温20的氨丁三醇缓冲液(tris-buffered saline and tween 20,TBST)室温下封闭 1~2 h,一抗(Cat K 1 ∶1 000稀释),4℃过夜。TBST 洗膜 10 min×3次,二抗(1 ∶5 000稀释)室温1 h,TBST洗膜10 min×3次,电化学发光法显色、曝光。 采用Quantity One软件进行图像分析,使用高斯建模得出灰度分析值。以Cat K/β-actin的A比值来表示Cat K蛋白在HUVEC的表达情况。
1.3 统计学分析 采用SPSS 11.0软件进行统计学处理。符合正态性分布的计量资料以(x±s)表示,多组样本间均数比较采用单因素方差分析来进行多组间比较,不符合正态性分布的均数比较采用非参数检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 不同浓度TNF-α对HUVEC中Cat K mRNA表达的影响 正常对照组HUVEC未见Cat K mRNA表达;其余4组经不同浓度TNF-α刺激24 h后均可见Cat K mRNA表达,表达水平均高于正常对照组(F=1 578.768,P<0.001)。在0.1 ng/ml、1 ng/ml、10 ng/ml TNF-α组中,随着TNF-α浓度的增加,Cat K mRNA的表达水平升高(P<0.05),100 ng/mlTNF-α组Cat KmRNA的表达水平低于10 ng/ml TNF-α组(P<0.05)。表1及见图1。
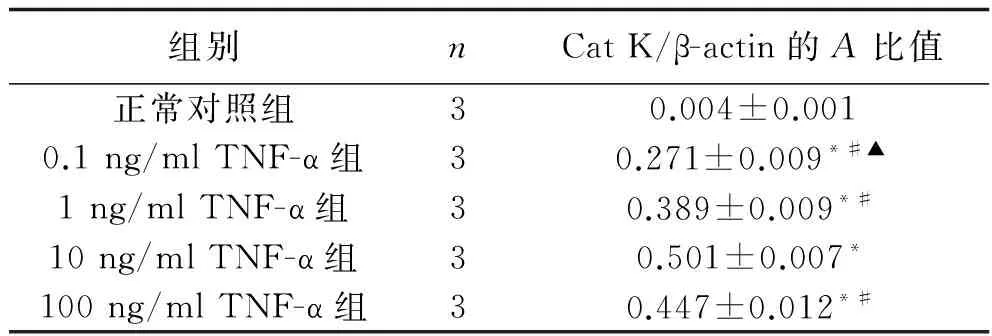
表1 不同浓度TNF-α刺激24 h各组HUVEC中Cat K mRNA表达情况(x±s)
注:与正常对照组比较,*P<0.01;与10 ng/ml TNF-α组比较,#P<0.05;与1 ng/ml TNF-α组比较,▲P<0.05。
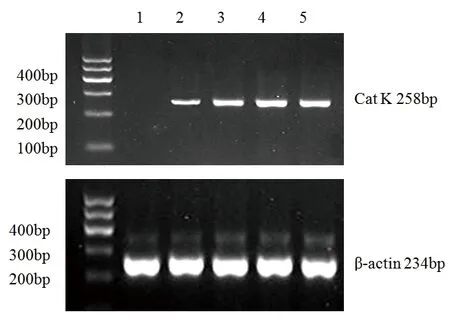
图1 Cat K和β-actin mRNA在HUVEC中表达的电泳图
注:l为正常对照组;2为0.1 ng/ml TNF-α组;3为1 ng/ml TNF-α组;4为10 ng/ml TNF-α组;5为100 ng/ml TNF-α组。
2.2 不同浓度TNF-α对HUVEC中Cat K 蛋白表达的影响 正常对照组HUVEC未见明显Cat K蛋白表达;其余4组给予不同浓度TNF-α刺激24 h后均可见Cat K蛋白表达,且表达水平均高于正常对照组(F=206.188,P<0.001)。在0.1 ng/ml、1 ng/ml、10 ng/ml TNF-α组中,随着TNF-α浓度的增加,Cat K的表达水平升高(P<0.05);100 ng/ml TNF-α组Cat K的表达水平低于10 ng/ml TNF-α组(P<0.05)。见表2及图2。

表2 不同浓度TNF-α刺激24 h各组HUVEC中Cat K蛋白表达情况(x±s)
注:与正常对照组比较,*P<0.01;与10 ng/ml TNF-α组比较,#P<0.05;与1 ng/ml TNF-α组比较,▲P<0.05。

图2 Cat K和β-actin在HUVEC表达的Western blot图。
注:l为正常对照组;2为0.1 ng/ml TNF-α组;3为1 ng/ml TNF-α组;4为10 ng/ml TNF-α组;5为100 ng/ml TNF-α组。
2.3 不同时间TNF-α对HUVEC中Cat K mRNA表达的影响 经10 ng/ml TNF-α作用不同时间后,HUVEC中均可见Cat K mRNA表达,不同作用时间组的Cat K mRNA表达水平均高于正常对照组(F=91.576,P<0.001)。 在TNF-α 6 h、TNF-α 12 h、TNF-α 24 h组中,随作用时间延长,Cat K mRNA的表达水平逐渐升高(P<0.05)。TNF-α 48 h 组Cat K mRNA表达水平低于TNF-α 24 h组(P<0.05)。见表3及图3。
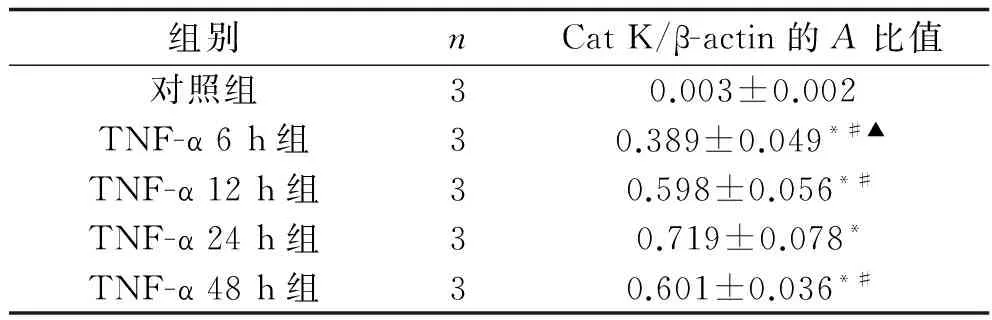
表3 10 ng/ml TNF-α作用不同时间各组 HUVEC中Cat K mRNA 表达情况(x±s)
注:与对照组比较, *P<0.05;与TNF-α 24 h组比较,#P<0.05;与12 h TNF-α组比较,▲P<0.05。

图3 Cat K和β-actin mRNA在HUVEC表达的电泳图
注:l为对照组;2为TNF-α 6 h组;3为TNF-α12 h组;4为 TNF-α 24 h组;5为 TNF-α 48 h组。
2.4 不同时间TNF-α对HUVEC中Cat K蛋白表达的影响 正常对照组未见Cat K蛋白表达,予10 ng/ml TNF-α作用不同时间后,HUVEC可见Cat K蛋白表达,且表达水平均高于正常对照组(F=100.486,P<0.001)。在TNF-α 6 h、TNF-α 12 h、TNF-α 24 h组中,随作用时间延长,Cat K蛋白的表达水平逐渐升高(P<0.05)。TNF-α 48h组Cat K 蛋白表达水平低于TNF-α 24 h(P<0.05)。见表4及图4。
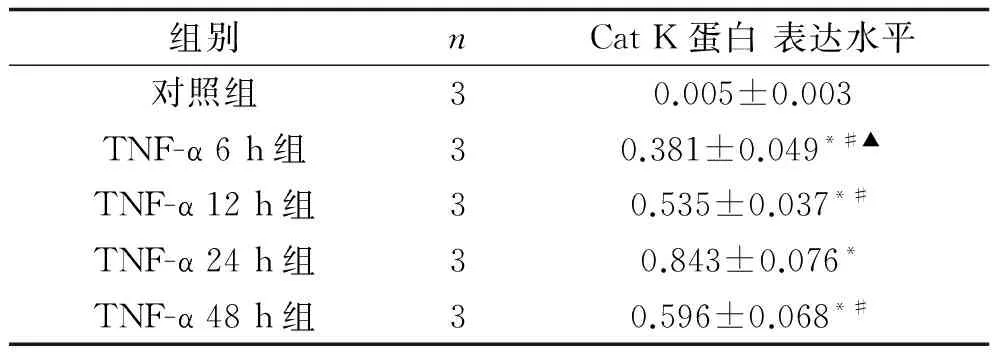
表4 10 ng/ml TNF-α作用不同时间各组HUVEC中Cat K蛋白的表达情况(x±s)
注:与对照组比较, *P<0.05;与 TNF-α 24 h组比较,#P<0.05;与12 h TNF-α组比较,▲P<0.05。
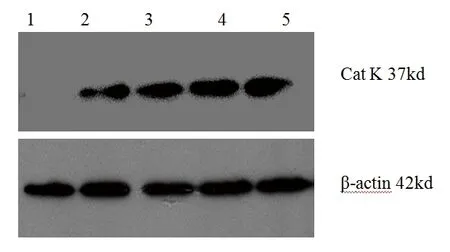
图4 Cat K和β-actin在HUVEC中表达的Western blot图注:l为对照组;2为TNF-α 6 h组;3为TNF-α 12 h组;4为TNF-α 24 h组;5为TNF-α 48 h组。
3 讨 论
Cat是在各种动物组织的细胞内(特别是溶酶体部分)发现的一类蛋白酶,能在酸性环境中被活化的溶酶体蛋白酶,属木瓜蛋白酶。人组织蛋白酶主要分为B、C、D、F、H、K、L、O、S、V 、W和X等12种亚型,大部分是半胱氨酸蛋白酶,其余是天冬氨酸或丝氨酸蛋白酶。Cat可降解不需要的细胞内基质或内吞蛋白[7-9]。有研究证实,Cat K和Cat S是半胱氨酸蛋白酶超家族中的重要成员,能降解弹力纤维和Ⅰ、Ⅲ和Ⅳ型胶原纤维,还参与生长因子、血管增殖调节及协助其他细胞因子调节等,有助于细胞迁移、增殖及凋亡等的调节[8,10]。Cat K可以促进ECM的降解,与腹主动脉瘤形成密切相关[11-12]。
TNF是一类具有多种生物效应的细胞因子,它通过和细胞膜上的特异性的受体结合,实现促进细胞生长,分化,凋亡及诱发炎症等生物学效应。TNF-α 是一个多效的促炎症因子,具有促进动脉粥样硬化形成的特点。TNF-α由单核细胞、巨噬细胞、平滑肌细胞、内皮细胞、表皮细胞等多种细胞表达,可以调节其他炎症因子和细胞因子的表达[12]。TNF-α可通过核转录因子κB和过氧化物酶体增生物激活受体-γ机制促进低密度脂蛋白跨HUVEC转运,促进动脉粥样硬化发生[13]。在大鼠颈动脉球囊损伤后,TNF-α抑制物苦参提取物能明显减少损伤血管内膜的TNF-α的表达及血管内膜增生[14];TNF-α抑制剂可能会抑制内皮功能障碍的进展,减慢动脉粥样硬进程[15]。正常情况下血管内皮细胞和平滑肌细胞并没有明显Cat K表达,但是给予TNF-α等炎症因子刺激后Cat K可以明显表达。本研究结果也显示,给予不同浓度TNF-α刺激24 h或10 ng/ml TNF-α作用不同时间后,均可见Cat K mRNA及蛋白的表达,表达强度均高于对照组(P均<0.05),这与其他研究结果相似[6,16]。有学者发现血清Cat L、Cat K、Cat S是预测冠心病的有用标志物,同时可作为阻滞心血管病相关蛋白降解的靶向药物,炎症因子和激素可调节培养心血管细胞和巨噬细胞中Cat的分泌和表达[17]。由于Cat ECM重构的主要作用,已成为一些ECM相关的疾病,包括骨质疏松症、癌症和心血管疾病的重要的治疗靶点[18]。
本研究发现,TNF-α刺激浓度为10 ng/ml作用时间为24 h时Cat K表达最强,而TNF-α刺激浓度为100 ng/ml或作用时间为48 h时Cat K mRNA和蛋白表达反而较前减少。提示TNF-α和其调控的多种炎症介质本身可能对细胞和组织造成损害。有研究发现,在40 ng/ml TNF-α作用24 h后HUVEC可见明显细胞凋亡,异丙酚在临床相关浓度范围内,可呈浓度梯度地减少TNF-α诱导的HUVEC细胞凋亡[19]。在急性心肌梗死中或心功能不全患者中,TNF、白细胞介素-8、C反应蛋白、干扰素等多种炎症因子释放增多,可造成细胞和器官损害[20-21]。人血管内皮细胞和大鼠血管平滑肌细胞予一定浓度的TNF-α、IFN-γ、lL-1β培养超过24 h后,可以观察到乳酸脱氢酶水平明显增高,细胞活性下降,细胞死亡增加[22-23]。因此TNF-α刺激浓度很大、作用时间很长时,有可能引起HUVEC损伤和死亡,从而使细胞Cat K表达减少,这与本次实验结果相符。
综上所述,在一定作用浓度及作用时间内,TNF-α可以呈剂量和时间依赖性刺激HUVEC中Cat K表达,TNF-α可能通过促进Cat K的表达促进动脉硬化的发生。
[1] Kong L,Luo C,Li X,et al.The anti-inflammatory effect of kaempferol on early atherosclerosis in high cholesterol fed rabbits[J].Lipids Health Dis,2013,12:115.
[2] Shikuma CM,Barbour JD,Ndhlovu LC,et al.Plasma monocyte chemoattractant protein-1 and tumor necrosis factor-α levels predict the presence of coronary artery calcium in HIV-infected individuals independent of traditional cardiovascular risk factors[J].AIDS Res Hum Retroviruses,2014,30(2):142-146.
[3] Hofnagel O,Robenek H.Cathepsin K:boon or bale for atherosclerotic plaque stability?[J].Cardiovasc Res,2009,81(2):242-243.
[4] Li X,Li Y,Jin J,et al.Increased serum cathepsin K in patients with coronary artery disease[J].Yonsei Med J,2014,55(4):912-919.
[5] Cheng XW,Kikuchi R,Ishii H,et al.Circulating cathepsin K as a potential novel biomarker of coronary artery disease[J].Atherosclerosis,2013,228(1):211-216.
[6] Keegan PM,Wilder CL,Platt MO.Tumor necrosis factor alpha stimulates cathepsin K and V activity via juxtacrine monocyte-endothelial cell signaling and JNK activation[J].Mol Cell Biochem,2012,367(1/2):65-72.
[7] Turk B,Turk D,Turk V.Protease signalling:the cutting edge[J].EMBO J,2012,31(7):1 630-1 643.
[8] Cheng XW,Huang Z,Kuzuya M,et al.Cysteine protease cathepsins in atherosclerosis-based vascular disease and its complications[J].Hypertension,2011,58(6):978-986.
[9] Turk V,Stoka V,Vasiljeva O,et al.Cysteine cathepsins:from structure,function and regulation to new frontiers[J].Biochim Biophys Acta,2012,1824(1):68-88.
[10]Helske S,Syväranta S,Lindstedt KA,et al.Increased expression of elastolytic cathepsins S,K,and V and their inhibitor cystatin C in stenotic aortic valves[J].Arterioscler Thromb Vasc Biol,2006,26(8):1 791-1 798.
[11]Qin Y,Cao X,Yang Y,et al.Cysteine protease cathepsins and matrix metalloproteinases in the development of abdominal aortic aneurysms[J].Future Cardiol,2013,9(1):89-103.
[12]Lv BJ,Lindholt JS,Wang J,et al.Plasma levels of cathepsins L,K,and V and risks of abdominal aortic aneurysms:a randomized population-based study[J].Atherosclerosis,2013,230(1):100-105.
[13]Zhang Y,Yang X,Bian F,et al.TNF-α promotes early atherosclerosis by increasing transcytosis of LDL across endothelial cells:crosstalk between NF-κB and PPAR-γ[J].J Mol Cell Cardiol,2014,72:85-94.
[14]Long G,Wang G,Ye L,et al.Important role of TNF-α in inhibitory effects of Radix Sophorae Flavescentis extract on vascular restenosis in a rat carotid model of balloon dilatation injury[J].Planta Med,2009,75(12):1 293-1 299.
[15]Murdaca G,Spanò F,Cagnati P,et al.Free radicals and endothelial dysfunction:potential positive effects of TNF-α inhibitors[J].Redox Rep,2013,18(3):95-99.
[16]Lafarge JC,Naour N,Clément K,et al.Cathepsins and cystatin C in atherosclerosis and obesity[J].Biochimie,2010,92(11):1 580-1 586.
[17]Li X,Liu Z,Cheng Z,et al.Cysteinyl cathepsins:multifunctional enzymes in cardiovascular disease[J].Chonnam Med J,2012,48(2):77-85.
[18]Fonovic M,Turk B.Cysteine cathepsins and extracellular matrix degradation[J].Biochim Biophys Acta,2014,1 840(8):2 560-2 570.
[19]Luo T,Xia Z,Ansley DM,et al.Propofol dose-dependently reduces tumor necrosis factor-alpha-induced human umbilical vein endothelial cell apoptosis:effects on Bcl-2 and Bax expression and nitric oxide generation[J].Anesth Analg,2005,100(6):1 653-1 659.
[20]Goswami B,Rajappa M,Mallika V,et al.TNF-α/IL-10 ratio and C-reactive protein as markers of the inflammatory response in CAD-prone North Indian patients with acute myocardial infarction[J].Clin Chim Acta,2009,408(1-2):14-18.
[21]Putko BN,Wang Z,Lo J,et al.Circulating levels of tumor necrosis factor-alpha receptor 2 are increased in heart failure with preserved ejection fraction relative to heart failure with reduced ejection fraction:evidence for a divergence in pathophysiology[J].PLoS One,2014,9(6):e99 495.
[22]de Klaver MJ,Buckingham MG,Rich GF.Lidocaine attenuates cytokine-induced cell injury in endothelial and vascular smooth muscle cells[J].Anesth Analg,2003,97(2):465-470.
[23]de Klaver MJ,Manning L,Palmer LA,et al.Isoflurane pretreatment inhibits cytokine-induced cell death in cultured rat smooth muscle cells and human endothelial cells[J].Anesthesiology,2002,97(1):24-32.
Effect of tumor necrosis factor-α on cathepsin K expression in human umbilical vein endothelial cells
ZHANGLiang1,ZHANGYi1,TANGQiu-hong2,LINChu-wei3,ZHOUSheng-hua4
(1DepartmentofCardiology,HunanProvincialPeople′sHospital,Changsha410005,China;2DepartmentofNephrology,theSecondXiangyaHospitalofCentralSouthUniversity,Changsha410011,China;3DepartmentofCardiology,ChangshaCentralHospital,Changsha410004,China;4DepartmentofCardiology,theSecondXiangyaHospitalofCentralSouthUniversity,Changsha410011,China)
Objective To observe the effect of tumor necrosis factor-α(TNF-α) with different concentrations and different actuation durations on the expression of cathepsin K(Cat K) in human umbilical vein endothelial cells(HUVECs).Methods HUVECs in logarithmic growth phase were used in the experiment.The HUVECs were divided into normal control group,0.1 ng/ml TNF-α group,1 ng/ml TNF-α group,10 ng/ml TNF-α group and 100 ng/ml TNF-α group treated with DMEM culture medium,0.1 ng/ml TNF-α,1ng/ml TNF-α,10 ng/ml TNF-α and 100 ng/m for 24 hours respectively.Other HUVECs were divided into control group,TNF-α 6 h group,TNF-α 12 h group,TNF-α 24 h group and TNF-α 48 h group.The control group was treated with DMEM culture medium for 24 hours,and the other groups were treated with 10 ng/ml TNF-α for the corresponding time.The expressions of Cat K mRNA and protein were detected in HUVECs of each group.Results The expression levels of Cat K mRNA and protein in the groups with different TNF-α concentrations increased compared to the normal control group(P<0.05).The expression levels of Cat K mRNA and protein increased in the order of 0.1 ng/ml TNF-α group,1 ng/ml TNF-α group and 10 ng/ml TNF-α group(P<0.05).The expression levels of Cat K mRNA and protein in 100 ng/ml TNF-α group were lower than those in 10 ng/ml TNF-α group(P<0.05).Compared to the control group,the expression levels of Cat K mRNA and protein in the groups treated with TNF-α for different times increased(P<0.05).The expression levels of Cat K mRNA and protein increased in the order of TNF-α 6 h group,TNF-α 12 h group and TNF-α 24 h group(P<0.05).The expression levels of Cat K mRNA and protein in TNF-α 48 h group were significantly lower than those in TNF-α 24 h group(P<0.05).Conclusion Within certain action concentration and actuation duration,TNF-α can stimulate the expression of Cat K in HUVEC in a time- and dose-dependent manner.TNF-α might promote the occurrence of arteriosclerosis by promoting Cat K expression.
Cathepsin K,Human umbilical vein endothelial cells,Tumor necrosis factor-α,Arteriosclerosis
张良(1979~), 男,博士,主治医师,研究方向:介入心脏病学。
周胜华(1963~),男,博士,教授,研究方向:介入心脏病学,E-mail:zhougqin@21cn.com。
R 543.3
A
0253-4304(2016)07-0901-05
10.11675/j.issn.0253-4304.2016.07.02
2016-03-03
2016-05-27)

