Nogo-A蛋白表达与少突胶质细胞瘤并发癫痫的相关性研究*
郝海涛, 王 旋, 姚东晓, 熊南翔, 赵洪洋
华中科技大学同济医学院附属协和医院神经外科,武汉 430022
Nogo-A蛋白表达与少突胶质细胞瘤并发癫痫的相关性研究*
郝海涛,王旋,姚东晓,熊南翔△,赵洪洋△
华中科技大学同济医学院附属协和医院神经外科,武汉430022
摘要:目的研究Nogo-A蛋白表达与少突胶质细胞瘤并发癫痫的相关性。方法将收集的23例少突胶质细胞瘤标本分为癫痫组与非癫痫组,免疫组化、免疫印迹技术检测Nogo-A蛋白表达水平。分别以Nogo-A蛋白、Nogo-A蛋白+尼莫地平、尼莫地平作用于原代培养的大鼠皮层神经元,激光共聚焦技术检测Fluo4/AM标记的神经元钙离子信号。结果少突胶质细胞瘤癫痫组Nogo-A蛋白表达免疫组化评分为(6.79±2.00),高于非癫痫组(4.44±1.59),差异有统计学意义(P<0.05);免疫印迹实验显示癫痫组Nogo-A/GAPDH(0.814±0.217)较非癫痫组Nogo-A/GAPDH(0.540±0.153)高,差异有统计学意义(P<0.05)。激光共聚焦检测结果显示Nogo-A蛋白组与Nogo-A蛋白+尼莫地平组神经元胞内钙离子浓度在加入药物后的各时间点上均较对照组和尼莫地平组显著升高,差异具有统计学意义(均P<0.05)。结论Nogo-A蛋白高表达可能对少突胶质细胞瘤患者并发癫痫起一定促进作用。
关键词:Nogo-A;少突胶质细胞瘤;癫痫;钙离子
在胶质瘤患者中,不同病理分型的胶质瘤并发癫痫的概率不同,其中少突胶质细胞瘤癫痫发生率较高(超过75%)[1],进而严重影响患者病情进展、治疗效果。有研究发现[2]Nogo-A蛋白与癫痫具有相关性,该蛋白在颞叶癫痫患者海马组织中表达升高,但具体的分子机制尚不明了。Nogo-A蛋白是一种神经轴突再生抑制因子[3],主要分布于中枢神经系统神经元、少突胶质细胞,在其他胶质细胞如星形细胞、雪旺细胞等未见表达[4]。研究发现[5],相对于其他类型胶质瘤,Nogo-A蛋白在少突胶质细胞瘤中有特异性显著表达,那么,该蛋白在少突胶质细胞瘤中的高表达是否与少突胶质细胞瘤继发癫痫具有相关性,该蛋白是否会影响神经元电活动进而促使癫痫的发生,值得探讨。众所周知,癫痫发作的本质是神经元异常放电,钙离子浓度的变化作为神经元电活动的一种简化模式,常常被应用于癫痫研究当中。本实验通过检测少突胶质细胞瘤组织中Nogo-A蛋白的表达,探讨该蛋白与少突胶质细胞瘤并发癫痫之间的相关性,并应用激光共聚焦技术检测Nogo-A蛋白对大鼠皮层神经元胞内钙离子浓度的影响,报道如下。
1材料与方法
1.1标本来源
收集病理诊断确诊的少突胶质细胞瘤(WHOⅡ级)标本23例,其中男性11例,女性12例,年龄18~57岁,中位年龄45岁。按术前是否有癫痫发作分组,非癫痫组9例、其中额叶3例、颞叶3例、额顶叶2例、颞顶叶1例;癫痫组14例,包括额叶4例、颞叶3例、额顶叶2例、额颞叶2例、颞顶叶、顶叶、顶枕叶各1例。
1.2试剂及设备
兔抗人Nogo-A多克隆抗体,工作浓度1∶100,购自Santa Cruz公司,二抗羊抗兔IgG、二氨基联苯胺(diaminobenzidine,DAB)显色试剂盒及电化学发光(electrochemiluminescence,ECL)试剂盒购自武汉谷歌生物公司,内参GAPDH一抗兔单克隆抗体购自Abcam公司,神经元培养液(Neurobasal-A)、添加剂B-27、胰蛋白酶、DMEM培养液及胎牛血清购自Gibco公司,Nogo-A蛋白购自Abnova公司,Fluo-4/AM购自日本同仁化工,多聚赖氨酸购自武汉三鹰公司,钙通道阻滞剂(尼莫地平)购自拜耳先灵医药。采用尼康激光共聚焦显像系统。
1.3免疫组织化学实验
取石蜡包埋的肿瘤标本行切片,经脱蜡、脱水、阻断,热修复抗原;血清封闭,一抗4℃冰箱孵育过夜,二抗孵育15 min;DAB显色;苏木精复染,常规脱水、干燥、封片。PBS代替一抗作为阴性对照。免疫组化评分(IRS):Nogo-A阳性显色表现为细胞膜及细胞质棕黄色颗粒,在×200显微镜下,随机选取6个视野,计数阳性细胞所占比例,<5%记为阴性(0分),≥5%记为阳性,其中5%~记为1分,25%~记为2分,50%~记为3分,>75%记为4分。显色程度评分:0分(无显色),1分(显色较弱),2分(显色中度),3分(显色深),将阳性细胞百分比评分与显色程度评分相乘,得到最终的免疫组化评分(IRS)。
1.4免疫印迹实验
取肿瘤标本,预冷PBS冲洗3次,加入裂解液于冰上裂解15 min,4℃下12 000 r/min离心5 min。取上清行蛋白定量,行SDS-PAGE凝胶电泳,经转膜、封闭后与一抗(兔抗人Nogo-A多克隆抗体)、二抗(羊抗兔IgG)结合,ECL试剂盒显色,记录影像,采用AlphaEaseFC软件取灰度值并分析Nogo-A/GAPDH比值结果。
1.5大鼠皮层神经元的原代培养
取新生24 h内的Wistar大鼠,消毒后开颅取大脑皮层组织,于预冷的D-Hanks液中漂洗后,置于预冷的DMEM培养液中,去除脑膜、血管等组织,将脑组织剪碎至1 mm3大小,加入胰蛋白酶,于37℃温箱中消化15 min,后加入含有胎牛血清的DMEM终止消化。巴士管反复吹打,过70 μm筛网,1 000 r/min离心6 min,去上清后加入DMEM(含10%胎牛血清)重悬,调整细胞密度为6×105/mL,种植于多聚赖氨酸包被的35 mm共聚焦小皿,于温箱(37℃,5%CO2)中培养,4~6 h后换液为神经元培养液(含有2%B-27的Neurobasal-A)。
1.6激光共聚焦显微镜检测大鼠皮层神经元细胞内钙离子浓度
①Krebs-ringer液的配制:双蒸水1 L,加入以下试剂:7.8 g NaCl,0.35 g KCl,0.37 g CaCl2,0.47 g MgCl2·6 H2O,0.256 g NaH2PO4·2 H2O,1.37 g NaHCO3,1.54 g葡萄糖,混匀备用。②实验分组:将培养第7天的皮层神经元细胞分为A、B、C、D共4组,每组6个,干预条件为:A组为对照组(Krebs-ringer液),B组为1 mg/L Nogo-A蛋白,C组1 mg/L Nogo-A蛋白+100 mg/L尼莫地平,D组为100 mg/L尼莫地平,B、C、D组药物配制溶剂均为Krebs-ringer液。③操作过程:按照说明书,将神经元培养液去除后,以HBSS溶液洗涤细胞3次,尽量去除残留培养液,加入Fluo-4/AM溶液(工作浓度5 μmol/L),量以覆盖细胞为准,37℃细胞培养箱孵育30 min,除去Fluo-4/AM工作液,HBSS溶液洗涤细胞3次后加入HBSS溶液覆盖细胞,于37℃温箱内去酯化15 min。然后去除HBSS液,加入药物,将小皿置于激光共聚焦显微镜下,调整共聚焦系统得到清晰细胞图像,记录各时间点(1、3、5、10 min)钙信号强度,注意观察过程中不能移动共聚焦小皿。
1.7统计学分析
采用SPSS 17.0软件进行统计学分析,数据先行正态性检验和方差齐性检验(levene检验),组间均数比较采用t检验,以P<0.05为差异有统计学意义。
2结果
2.1免疫组织化学实验结果
本实验23例少突胶质细胞瘤标本中均可见Nogo-A表达,在表达百分比评分上,癫痫组(2.79±0.58)较非癫痫组(2.67±0.50)稍高,差异无统计学意义(P>0.05),但癫痫组较非癫痫组染色更深(图1),最终免疫组化评分显示,癫痫组Nogo-A蛋白的IRS评分为(6.79±2.00),明显高于非癫痫组(4.44±1.59),差异有统计学意义(P<0.05)。

A:非癫痫组;B:癫痫组图1 两组少突胶质细胞瘤组织中Nogo-A蛋白表达(SP,×200)Fig.1 Immunohistochemical analysis of the expression of Nogo-A protein in oligodendroglioma tissues in the two groups (SP,×200)
2.2免疫印迹实验结果
免疫印迹实验结果显示,癫痫组Nogo-A/GAPDH(0.814±0.217),较非癫痫组(0.540±0.153)高,差异有统计学意义(P<0.05),癫痫组Nogo-A蛋白表达较非癫痫组高(图2)。

①②③:非癫痫组;④⑤⑥:癫痫组图2 Western blot检测两组少突胶质细胞瘤组织中Nogo-A蛋白的表达Fig.2 Expression of Nogo-A protein in oligodendroglioma tissues in the two groups
2.3激光共聚焦检测结果
激光共聚焦检测结果显示,对照组及尼莫地平组钙离子浓度在各时间点无明显变化,Nogo-A蛋白干预组及Nogo-A+尼莫地平组呈持续上升趋势,在第1 min后的各时间点钙离子荧光信号值明显高于对照组及尼莫地平组(均P<0.05)(表1,图3)。
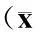
表1 各组神经元不同时间点钙离子信号荧光强度±s,n=6)
与对照组比较,*P<0.05;与尼莫地平组比较,#P<0.05

A:1 min;B:3 min;C:5 min;D:10 min图3 激光共聚焦显微镜观测到的Nogo-A蛋白干预组神经元在不同时间点的钙离子信号(×200)Fig.3 Calcium signals in neurons treated by Nogo-A protein at different time points observed by laser scanning confocal microscopy(×200)
3讨论
胶质瘤是成人最常见的颅内原发肿瘤,也是引起癫痫发作的最常见颅内肿瘤之一。据报道胶质瘤患者中伴有癫痫发作者约占26%~83%[6],不同的病理类型胶质瘤患者癫痫发生率不同,其中,少突胶质细胞瘤患者癫痫发病率可超过75%,远远高于星形细胞瘤等。少突胶质细胞瘤患者如此高的癫痫发病率,目前多认为与肿瘤位置、少突胶质细胞瘤常伴有钙化、低级别胶质瘤生长较缓慢等因素有关,而相关的分子生物学机制研究尚不多见。Nogo-A是一种神经轴突再生抑制蛋白,在少突胶质细胞瘤中表达显著[5]。有研究[2,7]表明该蛋白与癫痫具有相关性,据Bandtlow等[2]研究发现,相较于正常人,Nogo-A蛋白在颞叶癫痫患者的海马组织中表达含量升高。熊南翔等[7]对大鼠海马行电刺激发现海马内Nogo-A蛋白表达含量与电刺激时间呈正相关,即电刺激可引起大鼠海马神经元表达Nogo-A蛋白含量增加。上述实验研究显示,Nogo-A蛋白表达与癫痫存在着一定相关性,该蛋白与神经元电活动之间的作用可能扮演了一定角色。
本实验将收集到的23例少突胶质细胞瘤病例分为癫痫组与非癫痫组,肿瘤部位及是否有钙化并无显著差异。根据对上述23例少突胶质细胞瘤组织的免疫组化结果分析可知,Nogo-A蛋白在少突胶质细胞瘤癫痫组与非癫痫组中都有明显表达。在表达百分比评分上,癫痫组(2.79±0.58)较非癫痫组(2.67±0.50)稍高,差异不显著(P>0.05),但癫痫组表达含量较非癫痫组更高,其最终的Nogo-A蛋白表达IRS评分为(6.79±2.00),明显高于非癫痫组(4.44±1.59),差异有统计学意义(P<0.05)。免疫印迹实验也表明了同样的结果。上述实验结果说明Nogo-A蛋白表达与少突胶质细胞瘤癫痫的发生具有一定相关性。
结合本实验与Bandtlow等[2]的研究,均表明Nogo-A蛋白的高表达与癫痫具有相关性。众所周知,癫痫的本质是神经元的异常放电,上述研究提示Nogo-A蛋白可能会影响神经元的电活动。钙稳态失衡与癫痫发作密切相关[8],钙超载是神经元痫样放电的电生理学基础之一。根据激光共聚焦检测结果可知,相较于对照组,Nogo-A蛋白组神经元钙离子浓度升高,L型钙通道阻滞剂尼莫地平并不能完全阻止Nogo-A蛋白导致的神经元胞内钙离子浓度上升。上述结果表明Nogo-A蛋白可引起神经元钙超载,对于神经元异常放电可能起了一定促进作用。并发癫痫的少突胶质细胞瘤组织中Nogo-A蛋白表达升高,这些蛋白可能会影响与之接触神经元的电活动,例如在凋亡坏死的肿瘤细胞内包含的Nogo-A蛋白或Nogo-A片段,可直接作用于周围的神经元,引起神经元胞内钙离子浓度升高,对于癫痫的发生可能起一定促进作用。
Nogo-A蛋白有很多功能片段,如Nogo-66、Nogo-A-Δ20、Nogo-A-24、Nogo-A-Δ2等,其中最重要的2个抑制性功能域是Nogo-66和Nogo-A-Δ20[9]。研究表明Nogo-A-Δ20可作用于属于G蛋白偶联受体家族成员的1-磷酸鞘氨醇受体2(sphingosine-1-phosphate receptor 2,S1PR2)[10-11],S1PR2激活Gαi蛋白可导致磷脂酶C途径激活,引起细胞内钙离子浓度升高。Nogo-66作用于NgR-P75联合受体,通过调节胞内RhoA等信号分子起作用,鉴于该信号通路不依赖钙离子,故Nogo-A蛋白导致的神经元钙超载可能与该通路无关。但同时Rho/Rho激酶(ROCK)通路可以调节钙离子敏感度,而Nogo-A蛋白功能片段较多,很多信号通路尚不明确,因此Nogo-A蛋白引起钙超载的具体信号通路目前难以确定,仍需进一步研究。L型钙通道阻滞剂尼莫地平并不能完全阻止钙超载,同样说明Nogo-A蛋白可能通过其他途径引起钙超载。
综合上述实验结果表明,Nogo-A蛋白高表达与癫痫发作具有一定相关性,无论对于人海马组织,或是人少突胶质细胞瘤组织,癫痫组中该蛋白的表达明显升高,结合该蛋白具有的导致神经元钙超载功能,可以推断Nogo-A蛋白过表达对于少突胶质瘤继发癫痫可能起了一定促进作用。但该蛋白导致钙超载的具体信号通路仍不明确,它所致的钙超载在痫样放电这一病理过程中所起的作用大小,仍需要进一步研究。
参考文献
[1]Roux F X,Nataf F.Cerebral oligodendrogliomas in adults and children.Current data and perspectives[J].Neurochirurgie,2005,51(3/4):410-416.
[2]Bandtlow C E,Dlaska M,Pirker S,et al.Increased expression of Nogo-A in hippocampal neurons of patients with temporal lobe epilepsy[J].Eur J Neurosci,2004,20(1):195-206.
[3]Chen M S,Huber A B,van der Haar M E,et al.Nogo-A is a myelin-associated neurite outgrowth inhibitor and an antigen for monoclonal antibody IN-1[J].Nature,2000,403(6768):434-439.
[4]Buss A,Sellhaus B,Wolmsley A,et al.Expression pattern of Nogo-A protein in the human nervous system[J].Acta Neuropathol,2005,110(2):113-119.
[5]Kuhlmann T,Gutenberg A,Schulten H J,et al.Nogo-a expression in glial CNS tumors:a tool to differentiate between oligodendrogliomas and other gliomas?[J].Am J Surg Pathol,2008,32(10):1444-1453.
[6]Zentner J,Hufnagel A,Wolf H K,et al.Surgical treatment of neoplasms associated with medically intractable epilepsy[J].Neurosurgery,1997,41(2):378-387.
[7]熊南翔,赵洪洋,张方成.电刺激对海马表达Nogo-A蛋白的影响[J].中华物理医学与康复杂志,2006,28(6):364-367.
[8]Avanzini G,Franceschetti S.Cellular biology of epileptogenesis[J].Lancet Neurol,2003,2(1):33-42.
[9]Sui Y P,Zhang X X,Lu J L,et al.New insights into the roles of Nogo-A in CNS biology and diseases[J].Neurochem Res,2015,40(9):1767-1785.
[10]王国丽,大宝贵嗣,山崎和生,等.转染及培养条件对外源性钙离子ATP酶SERCA1/α表达的影响 [J].中国组织化学与细胞化学杂志,2014,23(3):223-226.
[11]Kempf A,Tews B,Arzt M E,et al.The sphingolipid receptor S1PR2 is a receptor for Nogo-a repressing synaptic plasticity[J].PLoS Biol,2014,12(1):e1001763.
(2015-10-11收稿)
Association of Nogo-A Expression with Oligodendroglioma-caused Epilepsy
Hao Haitao,Wang Xuan,Yao Dongxiaoetal
DepartmentofNeurosurgery,UnionHospital,TongjiMedicalCollege,HuazhongUniversityofScienceandTechnology,Wuhan430022,China
AbstractObjectiveTo investigate the relationship between Nogo-A expression and oligodendroglioma-caused epilepsy.MethodsA total of 23 patients with oligodendroglioma were divided into epilepsy group and nonepilepsy group.Nogo-A expression was detested by Western blotting and immunohistochemistry,respectively.The cortical neurons of rats were treated by Nogo-A,Nogo-A+nimodipine and nimodipine,respectively.Signals of Ca2+in neurons marked by Fluo4/AM were recorded by laser scanning confocal microscopy.ResultsImmunoreactivity score(IRS) of Nogo-A expression was(6.79±2.00)in the epilepsy group,remarkably higher than in the nonepilepsy group(4.44±1.59)(P<0.05).Western blot showed that Nogo-A/GAPDH was(0.814±0.217)in the epilepsy group,which was significantly increased when compared with that in the nonepilepsy group(0.540±0.153)(P<0.05).Laser scanning confocal microscopy revealed that the concentration of Ca2+in neurons was significantly increased in the Nogo-A and Nogo-A+nimodipine groups as compared with that in control and nimodipine groups at each time point after addition of drugs(P<0.05).ConclusionOverexpression of Nogo-A protein may contribute to the epileptogenesis in patients with oligodendroglioma.
Key wordsNogo-A;oligodendroglioma;epilepsy;calcium
中图分类号:R739.264
DOI:10.3870/j.issn.1672-0741.2016.01.010
通讯作者△,Corresponding author,赵洪洋,E-mail:hyzhao750@sina.com;熊南翔,E-mail:mozhuoxiong@163.com
*湖北省自然科学基金资助项目(No.2012FFB02408)
郝海涛,男,1987年生,博士研究生,E-mail:2236869876@qq.com

