顶空固相微萃取-气相色谱-质谱联用法鉴别产紫杉醇的内生菌株J11和诱变菌株J11-8
戴黄益,刘明志,吕镇城
(1.西南林业大学生命科学学院云南昆明 650224;2.惠州学院生命科学学院,广东惠州 516007)
顶空固相微萃取-气相色谱-质谱联用法鉴别产紫杉醇的内生菌株J11和诱变菌株J11-8
戴黄益1,2,刘明志2*,吕镇城2
(1.西南林业大学生命科学学院云南昆明 650224;2.惠州学院生命科学学院,广东惠州 516007)
采用顶空固相微萃取-气相色谱-质谱(HS-SPME-GC-MS)对产紫杉醇内生真菌J11及其诱变菌株J11-8的挥发性成分进行分析.结果表明,J11菌株可鉴定19种挥发性成分,J11-8菌株鉴定可鉴定24种挥发性成分,两者挥发性化学成分及相对百分含量具有明显差异.因此,HS-SPME-GC-MS可用于区分野生型真菌和突变真菌在代谢组学上的差异,在真菌的种属鉴定上具有重要的理论和实践价值.
内生真菌;紫杉醇;顶空固相微萃取(HS-SPME);气相色谱-质谱(GC-MS)
目前,随着研究的深入,在地球上新发现的真菌的种类比预想的要多得多,其中,新发现的内生真菌的种类占据相当大的比例.传统的真菌的分类鉴定方法主要基于形态学的观察和鉴定,形态学鉴定的主要依赖于无性孢子和有性孢子,特别是有性孢子及其生殖过程.对于内生真菌来说,在很多情况下,无性孢子和有性孢子的形成需要与植物形成共生关系,这给鉴定工作造成了困难.目前,基于标准化和自动化程度较高的真菌鉴定方法逐步建立,如Biolog微生物自动分析系统[1]和BIOFOSUN系统鉴定[2]方法,但是,这两种真菌鉴定方法操作复杂,应用范围有限,且需要专用的仪器设备,因而,难于推广应用.另一方面,基于DNA条形码的分子生物学技术逐渐成熟,如ITS(Internal transcribed spacer)等条形码技术成为鉴定真菌的可靠方法[3-5].目前,在GeneBank和EMBL数据库登记的真菌条形码序列呈现出快速增长,在真菌的鉴定中发挥了重要作用,成为真菌分子鉴定的主要方法.
随着现代高精度分析化学技术的不断发展和完善,在生物学领域展示了越来越广的应用前景.基于代谢组学基础上的对真菌的蛋白质,次生代谢产物和挥发性物质的微生物菌种鉴定方法成为可能,如基质辅助激光解析/电离飞行时间质谱(MALDI-TOF-MS)[6-9],气相色谱-质谱(GC-MS)[10,11].在本研究中,笔者分离获得一株产紫杉醇内生真菌J11[12,13]并通过诱变育种,获得产紫杉醇的高产菌株J11-8[14].本文通过顶空固相微萃取-气相色谱-质谱联用技术分析鉴定了挥发性成分,结果表明,两个菌株的挥发性组及相对含量具有显著差异,这些结果可作为识别两个菌株“身份”的“指纹图谱”.该方法在真菌的菌种鉴定上可能具有应用前景.
1 材料与方法
1.1 材料
产紫杉醇的内生真菌J11菌株由本实验室分离获得,经形态和分子鉴定为葡萄座腔菌属真菌[11,12].J11-8菌株为J11菌株的突变株,紫杉醇产量可达1024.2μg/L[13].
QP-2010-Plus型气质联用仪(日本岛津公司);手动顶空固相微萃取装置(德国IKA公司);65 μm PDMS/ DVB统领取纤维头(美国Supelco公司);Rtx-5MS色谱柱(美国安捷伦公司).
1.2 HS-SPME法
J11和J11-8菌株培养于含PDA固体培养基的100 mL顶空瓶中15 d,用于固相微萃取.使用手动固相微萃取进样器及萃取头进行吸附.萃取头在使用前在气相色谱进样口老化2 h,老化温度为250℃.将老化的萃取头插入样品瓶的顶空部分,室温下吸附30 min.吸附完成后插入GC样口进行解吸附.
1.3 GC-MS分析条件
升温程序如下:起始温度40℃,保留2 min,以4℃/min升温到220℃,再以15℃/min升温到250℃,保留2 min.进样口温度250℃,连接口温度280℃,解吸附5 min.载气为高浓度He(99.99%),不分流进样,流速为1 mL/min.质谱条件:连接口温度280℃,电离方式EI,离子源温度为230℃,四级杆温度150℃;电子能量70 eV,Scan模式全程扫描.样品经过气相色谱进样分离后,形成不同色谱峰.
2 结果与分析
采用GC-MS计算机联用仪分析J11菌株和J11-8菌株的化学组成,经NIST/WILEY检索及面积归一化计算,分别确定2个菌株的挥发性化学组分.J11菌株的GC-MS总离子流图见图1,挥发性化学组分见表1,J11-8菌株的总离子流图见图2,挥发性化学组分见表2.
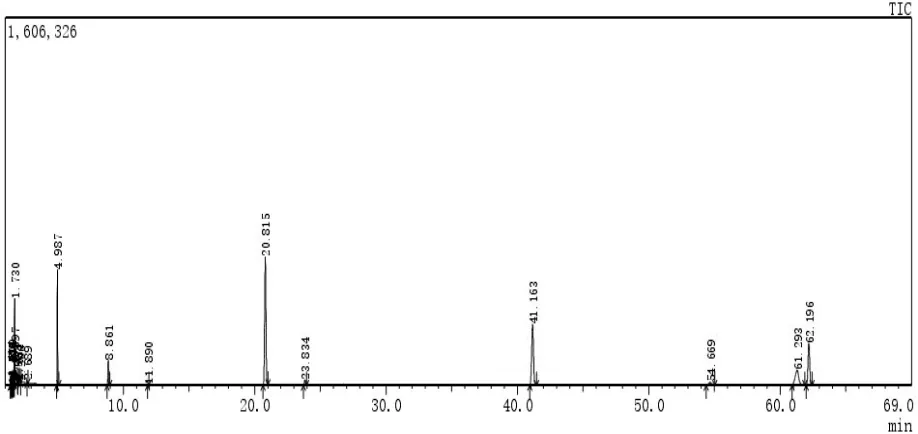
图1 J11菌株的GS-MS分析挥发性化学成分的总离子流图

表1 J11检测结果
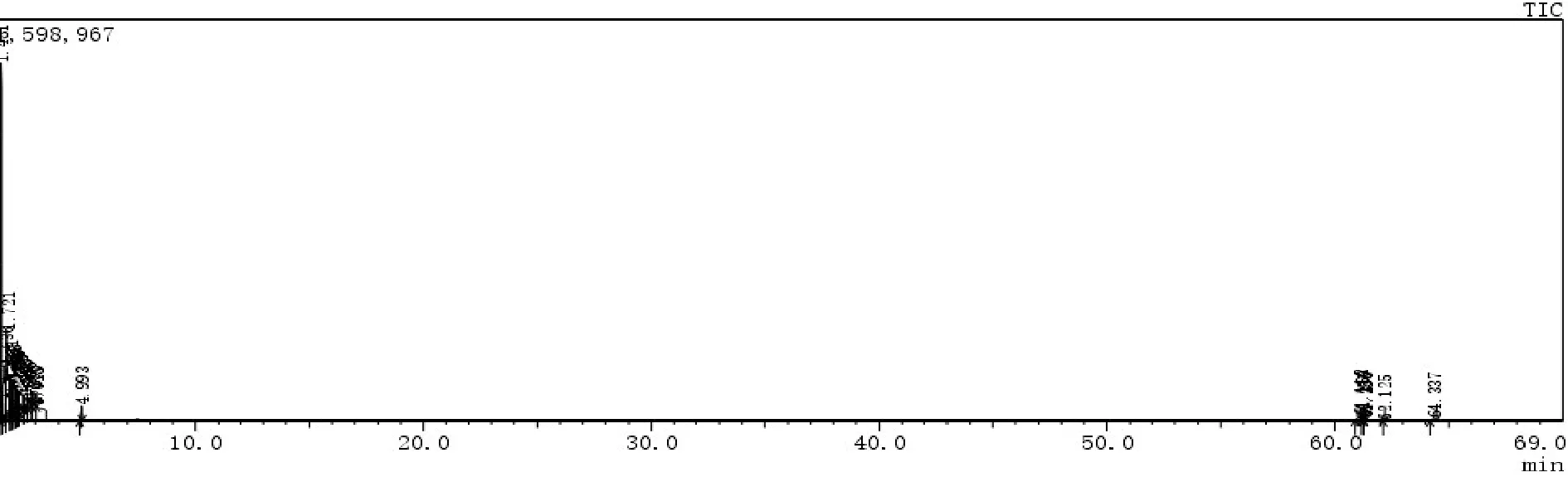
图2 J11-8菌株的GC-MS分析挥发性化学成分的部离子流图

表2 J11-8
通过比较表1和表2,发现在野生型J11菌株的19个挥发性化学组分与其突变株J11-8的24个挥发性化学组分中,仅有3个组分相同,即二甲基硅烷二醇,柠檬油精和十二甲基环己硅氧烷,且其相对含量差异较大.在野生型菌株J11中,主要挥发性化学成分除了二甲基硅烷二醇(6.24%),柠檬油精(9.46)和十二甲基环己硅氧烷(31.26%)外,还包括十四甲基环庚硅氧烷(20.84%),十六甲基环辛硅氧烷(12.87%)以及对-乙酰基-邻-[(三甲基硅烷基)乙炔基]苯酚(9.73%),但在突变菌株中,除了二甲基硅烷二醇(19.71%)含量显著增加外,柠檬油精(1.33%)和十二甲基环己硅氧烷(0.60%)的含量显著降低,但是,乙醇(22.37%)和丙烷(13.78%)显著升高,此外,碳酸氢铵,氨基甲酸铵,1-碘-3-甲基-2-戊酮,三甲基丁醇等组分也显著升高.
3 讨论
通过顶空固相微萃取-气相色谱-质谱联用法分析野生型J11菌株和突变菌株J11-8的挥发性化学成分,可以看出两者具有显著差异,这说明野生型菌株和突变型菌株在代谢途径上具有明显不同的特性,可用于区分野生型和突变型菌株,是菌种或菌株“亚型”的“身份标签”和“指纹图谱”.另一方面,从实验结果来看,由于野生型菌株和突变菌株在代谢组学上的差异程度显然超过了DNA序列的差异程度,因而,该方法是否可用于真菌的菌种鉴定一直存在疑问.事实上,同一个菌株在不同培养基,不同培养条件以及不同的培养时间,通过该方法分析获得的代谢“指纹图谱”也可能存在显著差异.因此,目前,在通过与DNA条形码序列比较,获得大量详实和可靠的数据,以及在提出一个标准化方案以前,通过该方法鉴定菌株可能是一个有争议的问题.虽然如此,该方法作为鉴别野生型菌株和突变型菌株的“指纹图谱”还是可靠的.
相对于同时蒸馏萃取(SDE-GC-MS),HS-SPMEGC-MS操作更简单.同时,相对于DNA条形码ITS所进行的菌种鉴定,利用HS-SPME-GC-MS进行菌种鉴定,节省了大量的操作步骤,且操作简单.如果能够与ITS等条形码比较,证明HS-SPME-GC-MS在鉴定菌种具有可靠性,以及建立标准化的方法,利用HS-SPMEGC-MS鉴定菌种为时不远,应该具有广阔的应用前景.目前,利用MALDI-TOF-MS鉴定真菌有较多研究报道[15,16],但是,该方法需要提取真菌的全部蛋白质,蛋白质是否提取完全,以及蛋白质提取方法等将影响鉴定结果的准确性.从本实验的结果来看,通过HSSPME-GC-MS所获得的真菌挥发性化学组分较少,这将是影响其在基础研究和应用前景方面的主要障碍.因此,通过分析GC-MS分析真菌提取物中的小分子天然化合物有助于鉴别和鉴定真菌.
[1]姚粟,程池,李金霞,等.Biolog微生物自动分析系统——丝状真菌鉴定操作规程的研究[J].食品与发酵工业,2006,32(8):63-67.
[2]章强强,赵颖,李莉,等.利用BIOFOSUN系统鉴定常见曲霉[J].检验医学,2010,25(7):515-518.
[3]仇萌,邹先彪.DNA-ITS序列鉴定深部真菌菌种的研究进展[J].中国真菌学杂志,2011,6(2):122-125.
[4]徐罗娜,涂敏,王晓芳.DNA条形码技术在真菌上的研究与应用[J].湖北农业科学,2014,53(20):4790-4795.
[5]郑冰,应春妹,汪雅萍,等.rDNA-ITS序列分析对临床少见丝状真菌鉴定作用的评估[J].检验医学,2011,26(10):648-652.
[6]梁铮,柏彩英,罗娅莎,等.MALDI-TOF-MS技术快速鉴定临床酵母样真菌的应用评价[J].检验医学与临床,2015,12(18):2658-2663.
[7]徐昕荣,朱斌,马瑜璐,等.MALDI-TOF-MS鉴定生物脱氮细菌的方法研究[J].环境科学与技术,2010,23(10):148-151.
[8]冯建军,龙海,刘新娇,等.MALDI-TOF质谱技术鉴定植物病原体研究进展[J].植物检疫,2014,28(6):13-18.
[9]黄声雷,胡必杰,陈蓉,等.两种MALDI-TOF MS系统快速鉴定血培养中白念珠菌以外酵母样真菌[J].检验医学,2015,30(2):128-131.
[10]李康乐,包佳源,陆瑞利,等.SDE-GC-MS法分析三种虫生真菌菌丝中挥发性成分[J].菌物学报,2012,31(1):92-101.
[11]张霄霄,汪定成,张惠中.质谱在临床病原真菌检测及鉴定中的研究进展[J].临床检验杂志,2015,33(4):294-296.
[12]刘明志.南方红豆杉产紫杉醇内生真菌的分离[J].热带亚热带植物学报,2011,19(4):360-364.
[13]刘明志,段中岗,吕镇城,等.高产紫杉醇内生真菌J11的鉴定[J].中国生物化学与分子生物学报,2014,30(10):1031-1038.
[14]刘明志,吕镇城,冉梦莲,等.产紫杉醇葡萄座腔菌J11菌株诱变获得高产菌株[J].药物生物技术,2015,22(1):45-48.
[15]叶丽艳,郭玲,马艳宁,等.基质辅助激光解析电离飞行时间质谱技术在快速鉴定真菌中的临床应用研究[J].中华医院感染学杂志,2015,25(15):3361-3363.
[16]姜长宏,龙军,华夏.基质辅助激光解析电离飞行时间质谱仪在侵袭性真菌感染病原真菌鉴定中的应用[J].实用医学杂志,2015,31(17):2902-2904.
【责任编辑:吴跃新】
Identification of Paclitaxel-producing Wild-type Entophyte fungus J11 and Its Mutant Strain J11-8 by HS-SPME-GC-MS
DAI Huang-yi1,2,LIU Ming-zhi2*,LV Zhen-cheng2
(1.College of Life Science,Southwest Forestry University,Kunming 650224,Yunnan China;2.School of Life Science,Huizhou University,Huizhou 516007,Guangdong China)
The volatile components of paclitaxel-producing wild-type endophyte fungus J11 and its mutant strain J11-8 were analyzed by headspace solid-phase microextraction gas chromatography-mass spectrometry(HS-SPME-GC-MS).Results showed that nineteen compounds in the J11 and twenty-four compounds in J11-8 were identified.The volatile components and their relative percentages in both strains had significant differences.The difference on metabolomics for wild-type fungus and mutant fungus could be distinguished by HS-SPME-GC-MS.The HS-SPME-GC-MS has an important theoretical and practical values on identification for fungus’s species and genus.
endophytic fungus;paclitaxel;headspace-solid-phase microextraction(HS-SPME);gas chromatography-mass spectrometry(GC-MS)
R965.1
A
1671-5934(2016)06-0045-05
2016-10-15
广东省科技计划项目(2013B060400026)
戴黄益(1991-),女,广东龙川人,硕士研究生,研究方向为分子细胞生物学.
*通讯作者:刘明志,教授,Email:tlmz63@163.com.

