乙醛法筛选抗乙醛啤酒酵母菌株的应用研究
金玮鋆,李 红,王君伟(中国食品发酵工业研究院,北京100015)
乙醛法筛选抗乙醛啤酒酵母菌株的应用研究
金玮鋆,李红,王君伟
(中国食品发酵工业研究院,北京100015)
摘要:乙醛是使啤酒产生硬纸板味、烂苹果味的主要来源,对啤酒品质有较大影响。本实验采用紫外诱变与高浓乙醛平板选育结合法,将筛选得到的菌株(共20株)与出发菌株进行低温发酵实验,然后利用气相色谱法测定菌株发酵液乙醛含量,并将其与出发菌株乙醛含量相比较。对具有较大乙醛降幅的菌株(共3株)进行乙醇脱氢酶活性的验证及稳定性实验,由此筛选出抗乙醛啤酒酵母菌株。该菌株可抵抗高浓度乙醛环境,从而快速还原代谢产生的乙醛,其乙醛含量为4.42 mg/L±0.14 mg/L,较出发菌株降低了71.13 %;乙醇脱氢酶(ADH1、ADH3与ADH4)活性显著高于出发菌株(增幅为88.80 %),且遗传稳定性表现良好。
关键词:微生物;乙醛;抗乙醛啤酒酵母;高浓乙醛法;乙醇脱氢酶
优先数字出版时间:2015-10-22;地址:http://www.cnki.net/kcms/detail/52.1051.TS.20151022.1440.002.html。
乙醛是啤酒羰基化合物的主要成分,也是啤酒产生硬纸板味、烂苹果味的主要来源,对啤酒风味有较大的影响[1]。虽然国家标准GB4927—2008中并未对乙醛含量有所限制,但含量过高的乙醛也会影响人们对啤酒的味觉感受。当啤酒中乙醛的含量超过25 mg/L时,就会有辛辣刺激的口感;超过10 mg/L时,啤酒会有不成熟的口感。优质啤酒的乙醛含量一般在3~8 mg/L[2]。
在诸多低产乙醛啤酒酵母菌株的选育方法中,许多研究人员选择运用基因工程手段构造重组菌株的方法获得理想的低乙醛啤酒酵母菌株[3-4],该法虽然成功率高且效果显著,但考虑到近年来利用基因工程重组菌株进行啤酒酿造的安全性问题备受争议,国内外也鲜有企业将基因工程构造菌株应用于啤酒工业化生产之中。因此,本研究摒弃了基因工程法,通过分析啤酒酵母的乙醛代谢途径,从传统诱变及选育方法出发,进行低产乙醛啤酒酵母菌株的选育。
近年来也有研究人员采用相似选育方法进行低产乙醛啤酒酵母的选育。张媛媛利用紫外诱变和甲吡唑抗性平板+希夫试剂显色结合法筛选得到乙醛含量低于出发菌的突变株,其乙醛降幅达到82.0 %[5];沈楠采用紫外诱变和乙醛脱氢酶抑制剂双硫仑-乙醇平板筛选结合法,并配合高浓乙醛低温驯化,得到低产乙醛酵母菌株,其降幅为73.7 %[6]。以上两种方法在选育低产乙醛啤酒酵母菌株中具有显著优势,但操作过于复杂,实验试剂成本过高。
因此,本实验采用紫外诱变与高浓乙醛平板选育结合法,将随机挑选大而圆的独立菌落进行低温发酵实验,然后利用气相色谱法测定实验菌株发酵液乙醛的含量,并将其与出发菌株乙醛含量相比较。然后,对具有较大乙醛降幅的实验菌株进行乙醇脱氢酶酶活的测定及稳定性实验,由此筛选出抗乙醛啤酒酵母菌株。该菌株可抵抗高浓度乙醛环境,从而快速还原代谢产生的乙醛,具有低产乙醛的发酵特性。该方法操作简单安全,所用试剂较少,可快速、有效地筛选出抗乙醛啤酒酵母,从菌株的角度降低啤酒中乙醛的含量。
如图1所示,丙酮酸通过丙酮酸脱羧酶(E1)积累生成乙醛;乙醇通过乙醇脱氢酶(E2)生成乙醛的反应速率高于乙醛的还原反应;生成的乙醛未能通过乙醛脱氢酶(E3)及时转化成乙酸。本实验通过向环境中添加高浓度乙醛以造成乙醛的积累,抑制酵母的生长代谢活性,从而筛选E2(ADH1、ADH3、ADH4)或E3活性高的啤酒酵母菌株。
由图1可知,E1为丙酮酸脱羧酶;E2为乙醇脱氢酶(其中乙醛生成乙醇途径的关键酶为ADH1、ADH3、ADH4,乙醇生成乙醛的关键酶为ADH2);E3为乙醛脱氢酶(ALD2、ALD3、ALD4、ALD5、ALD6);E4为乙酰辅酶A合成酶(ACS1、ACS2)。
1材料与方法
1.1材料、试剂与仪器
1.1.1材料与试剂
菌种:实验室保存菌株。
试剂及耗材:40 %乙醛(分析纯),国药集团化学试剂有限公司;琼脂(生物试剂),北京奥博拓达科技有限公司;磷酸氢二钾(分析纯),磷酸二氢钾(分析纯),北京红星化工厂;乙二胺四乙酸(EDTA)(生物试剂),氢氧化钾(化学纯),无水乙醇(分析纯),北京化工厂;辅酶I (NAD+)(98 %分析纯),还原型辅酶I(NADH)(98 %分析纯),百灵威科技有限公司;甘氨酸(生物试剂),北京索莱宝科技有限公司;氯化钾(分析纯),西陇化工股份有限公司。
试剂及培养基配制方法如下:
2 mM EDTA:称取0.58 g EDTA,用去离子水溶解并定容至1 L。
100 mM磷酸钾缓冲液(pH7.5):将80.2 mL 1 mol/L磷酸氢二钾与19.8 mL 1 mol/L磷酸二氢钾混匀。
50 mM甘氨酸-氢氧化钾缓冲溶液(pH9.0):将50 mL 0.2 mol/L甘氨酸与8.8 mL 0.2 mol/L氢氧化钾混匀,用去离子水定容至200 mL。
100 mM乙醇:量取7.8 mL 75 %vol的乙醇溶液,用去离子水稀释并定容至1 L。
0.15 mM乙醛:量取14.1 mL 40 %乙醛,迅速用去离子水稀释并定容至1 L(通风橱操作)。
1 mM NAD+:称取0.67 g NAD+,用去离子水溶解并定容至1 L。
1 mM NADH:称取0.71 g NADH,用去离子水溶解并定容至1 L。
10 mM氯化钾:称取0.75 g氯化钾,用去离子水溶解并定容至1 L。
麦汁培养基:将大麦芽粉碎,利用协定糖化法制备原麦汁浓度为13°P的定型麦芽汁,115℃下灭菌20 min。
麦汁琼脂培养基:在麦汁中加入2 %琼脂,115℃下灭菌20 min。
乙醛-麦汁琼脂培养基:用移液管移取10 mL 40 %乙醛溶液于100 mL容量瓶中,迅速用蒸馏水稀释,配制成4 %乙醛溶液,备用(由于乙醛易挥发,因此配制时应在通风橱内操作)。配制麦汁琼脂培养基,灭菌后向含100mL未凝固培养基的三角瓶中依次注射添加经0.22 μm滤膜过滤的500 μL、1500 μL、2500 μL、3500 μL、4500 μL、5500 μL、6500 μL、7500 μL4 %乙醛溶液,立即封口并迅速混匀,配成终浓度依次为200 mg/L、600 mg/L、1000 mg/L、1400 mg/L、1800 mg/L、2200 mg/L、2600 mg/L、3000 mg/L的乙醛-麦汁琼脂培养基。
1.1.2仪器与设备
生化培养箱(LRH-250),上海一恒科技有限公司;多用途恒温超声提取机(SY-1000E),北京弘祥隆生物技术公司;高速冷冻离心机(LR10-2.4A),北京雷勃尔医疗器械有限公司;紫外分光光度计(UV-1780),日本Shimadzu公司;高效气相色谱仪(Autosystem XV),美国PE公司;高压蒸汽灭菌锅(LDZX-50KBS),上海申安医疗器械厂。
1.2实验方法
1.2.1不同浓度乙醛的平板涂布

图1酵母乙醛代谢途径示意图
(1)按乙醛-麦汁琼脂培养基配制方法制备不同浓度乙醛-麦汁琼脂平板,以麦汁琼脂平板为对照,每个平板含培养基25 mL。
(2)取1支出发菌株(编号为KB)斜面,从斜面上接取1环酵母泥放入10 mL麦汁中28℃下活化培养24 h。
(3)取1 mL活化酵母液,利用梯度稀释法稀释至一定倍数后,分别取100 μL接到平板上涂布,每个乙醛浓度和对照组均设3个平行。
(4)将涂布好的平板(含乙醛的平板须用封口膜包好以减少乙醛的挥发)于28℃恒温培养箱中倒置培养4~5 d,每日定时观察菌落的生长情况,计算每个平板的菌落个数,计算抑制率。
抑制率的计算公式如下:
抑制率(%)=(对照组平均菌落数-实验组平均菌落数)÷对照组平均菌落数×100 %。
1.2.2紫外诱变时间的确定
(1)25 W紫外灯预热15~20 min后,将涂布好菌悬液的平板放置在紫外灯下30 cm处,迅速打开平板盖进行紫外照射,紫外照射时间分别为0、5 s、10 s、15 s、20 s、30 s、40 s、50 s、60 s、70 s,每个照射强度做3个平行。
(2)照射后立即关盖,并迅速用锡纸包好避光放置,整个诱变过程须避光完成,防止菌体发生光修复。
(3)将包好的平板于28℃下避光倒置培养4~5 d,观察并记录不同照射时间下酵母菌落数,计算不同照射强度下酵母致死率,确定紫外诱变最佳照射时间。
致死率的计算公式如下:
致死率(%)=(对照组平均菌落数-实验组平均菌落数)÷对照组平均菌落数×100 %。
1.2.3高浓乙醛筛选抗乙醛啤酒酵母
(1)制备乙醛浓度为1800 mg/L的乙醛-麦汁琼脂平板,按平板涂布实验方法对酵母菌悬液进行涂布。
(2)对涂布好的平板进行紫外诱变的照射,照射时间为20 s,设3个平行。照射结束后用锡纸包好,于28℃下避光倒置培养4~5 d,观察并记录不同照射时间下酵母菌落数量。
(3)从平板中随机挑选大而圆的独立菌落酵母菌株,编号并保藏至斜面。
(4)分别从实验菌株和KB斜面上取1环酵母菌株(接菌量约为2.5×107cfu/mL)放入10 mL麦汁中,28℃下活化培养24 h。
(5)分别取1 mL活化液接入9 mL麦汁中,28℃下扩大培养24 h,以提高酵母菌株的活性并促使接菌量基本一致。
(6)将10 mL扩培液分别接入100 mL麦汁中,12℃下进行低温发酵,发酵时间为8~10 d。
(7)发酵结束后,取5 mL发酵液至顶空瓶中,参照《啤酒分析方法》GB 4928—2008,利用气相色谱法(GC)对实验菌株发酵液进行乙醛含量的测定[7],计算各实验菌株的乙醛降幅与所有实验菌株的乙醛平均降幅。降幅及平均降幅的计算公式如下:
降幅(%)=(出发菌株乙醛含量-实验菌株乙醛含量)÷出发菌株乙醛含量×100 %;
平均降幅(%)=正突变菌株乙醛降幅的总和÷正突变菌株个数×100 %。
(8)根据乙醛降幅由大到小的顺序对实验菌株进行排序,选取降幅较大的3株进行乙醇脱氢酶酶活的测定。
1.2.4乙醇脱氢酶的提取及测定
1.2.4.1粗酶液的提取
(1)发酵结束后,将余下发酵液倒入50 mL离心管中(离心管须事先称量质量并编号),以5000×g离心5 min,弃上清液收集酵母细胞。
(2)用5 mL 2 mM EDTA和超纯水分别清洗2次,每次以5000×g离心10 min。
(3)称量含有底层酵母泥的离心管质量以计算得到酵母泥质量,将收集得到的酵母泥悬浮于100 mM的磷酸钾缓冲溶液(pH 7.5)(按1∶30料液比)。
(4)采用冻融-超声结合法对酵母悬浊液进行破壁处理,将菌悬液冷冻于-18℃冰箱,每次至少冷冻3 h,于4℃冰箱中解冻3次。
(5)第3次解冻菌悬液后将其置于恒温超声提取机中,0℃下500 W超声20 min(工作时间为3.5 s,间歇时间为1.5 s,冰浴降温)。
(6)将超声后的菌悬液在10℃下10000×g低温离心10 min,吸取上清液作为细胞抽提物即粗酶液。
1.2.4.2乙醇脱氢酶酶活的测定
乙醇脱氢酶活性的测定原理为:
(1)乙醇脱氢酶ADH2酶活的测定:取2支比色管,向其中1支比色管中依次添加1.5 mL甘氨酸-氢氧化钾缓冲液、0.5 mL NAD+、0.5 mL粗酶液作为实验组,另1支比色管中依次添加1.5 mL甘氨酸-氢氧化钾缓冲液、0.5 mL NAD+、0.5 mL去离子水作为对照组。将比色管摇匀,室温(25℃)下添加0.5 mL乙醇,快速混匀后倒入比色皿中,记录340 nm下1 min的吸光度,并计算每分钟吸光度增加值E340。
(2)乙醇脱氢酶ADH1酶活的测定:取2支比色管,向其中1支比色管中依次添加1.5 mL甘氨酸-氢氧化钾缓冲液、0.5 mL NADH、0.5 mL粗酶液作为实验组,另1支比色管中依次添加1.5 mL甘氨酸-氢氧化钾缓冲液、0.5 mL NADH、0.5 mL去离子水作为对照组。将比色管摇匀,室温(25℃)下添加0.5 mL乙醛,快速混匀后倒入比色皿中,记录340 nm下每分钟的吸光度,并计算每分钟吸光度增加值E340。
乙醇脱氢酶酶活定义为:3 mL反应体系。1 min吸光度增加0.001为一个活力单位。以单位酵母质量所有具有的酶活性值表示,单位为U/mg。
酶活计算公式如下:
U= (E340×3) / (0.5×0.001)。
式中:E340为每分钟的吸光度增加值;3为测酶活的反应体系的量;0.5为反应体系添加酶液的量;0.001为吸光度增加单位。
酶活增幅的计算公式如下:
酶活增幅(%)=(实验菌株酶活-出发菌株酶活)÷出发菌×100 %。
1.2.5稳定性实验
1.2.5.1重复实验
选取初筛菌株与出发菌株,重复发酵实验并测定相关指标,每株设3组平行。
1.2.5.2传代实验
(1)选取初筛菌株与出发菌株斜面上取1环酵母菌株(接菌量约为2.5×107cfu/mL)放入10 mL麦汁中,28℃下活化培养24 h。
(2)分别取1 mL活化液接入10 mL麦汁中,28℃下扩大培养24 h,以提高酵母菌株的活性并促使接菌量基本一致,视此发酵液为酵母菌株的第0代发酵液。
(3)在第0代菌株发酵高泡期(即24 h后)时,从中移取1 mL发酵液,加到10 mL麦汁中,为1代菌株发酵,剩余10 mL第0代发酵液则接入100 mL麦汁中进行12℃低温发酵实验;在第1代菌株发酵高泡期时,再移出1 mL发酵液加到10 mL麦汁中,为2代菌株发酵,剩余10 mL 第1代发酵液接入100 mL麦汁中进行12℃低温发酵实验。如此反复操作步骤,连续进行5代三角瓶发酵实验,发酵时间为8~10 d。
(4)发酵结束后,取5 mL发酵液至顶空瓶中,参照《啤酒分析方法》GB 4928—2008,利用气相色谱法(GC)对实验菌株发酵液进行乙醛含量的测定,计算相同菌株不同代数间的相对偏差,据此验证初筛菌株稳定性。
2结果与讨论
2.1乙醛抑制曲线与最佳添加浓度的确定
按照乙醛添加方法及培养基配制方法,分别制备浓度梯度为0 mg/L、200 mg/L、600 mg/L、1000 mg/L、1400 mg/L、1800 mg/L、2200 mg/L、2600 mg/L、3000 mg/L乙醛稀释液的麦汁琼脂培养基,并进行平板涂布培养实验,对各平板进行菌落计数和抑制率的计算,绘制抑制曲线,实验结果见图2。

图2添加不同浓度乙醛的酵母抑制曲线
由图2可知,随着乙醛添加浓度的不断升高,酵母抑制率逐渐上升,抑制曲线呈上升趋势,当乙醛浓度大于2600 mg/L时,酵母完全受到抑制,不再生长。当乙醛浓度为1800 mg/L时,酵母抑制浓度超过50 %,因此,选取1800 mg/L为乙醛最佳添加浓度。
2.2紫外诱变最佳时间的确定
本研究通过紫外诱变实验得到不同诱变时间下酵母致死率,绘制致死曲线,对紫外诱变的最佳诱变时间进行确定。实验结果见图3。
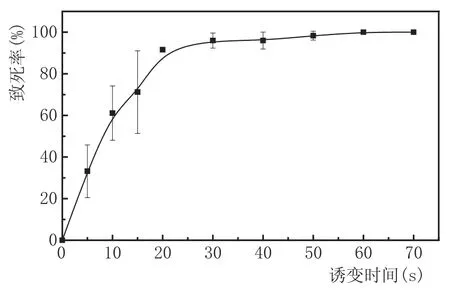
图3不同紫外诱变时间下的酵母致死曲线
由图3可知,酵母致死率随着紫外诱变时间的增长呈上升趋势,当紫外诱变时间在20 s之前时,酵母致死率较低且不稳定;当紫外诱变时间为20 s时,酵母致死率超过80 %;当诱变时间为60 s以上时,酵母致死率达到100 %。因此,本实验选取20 s(致死率为91.58 %)作为其最佳诱变时间。
2.3抗乙醛啤酒酵母菌株的选育
选取抑制浓度为1800 mg/L乙醛进行抗乙醛啤酒酵母菌株的选育实验。实验中共随机挑选了20株实验菌株与出发菌株(KB)一同进行液态发酵实验。发酵结束后,测定乙醛含量,并计算实验菌株乙醛降幅与平均降幅,结果见图4。
由图4可知,20株实验菌株中共有9株乙醛含量较出发菌株(KB)有所下降,正突变率为45.00 %,平均降幅为18.39 %,最大降幅为71.40 %。
其中,乙醛降幅最高的菌株编号依次为2、12、14。

图4高浓乙醛法筛选菌株(共20株)与出发菌株(KB)乙醛降幅
2.4初筛菌株与出发菌株乙醇脱氢酶酶活的测定
对编号为2、12、14的3株初筛菌株及KB进行乙醇脱氢酶(分别用ADH1与ADH2表示)酶活的测定,并计算初筛菌株与KB的酶活增幅,测定及计算结果见表1。
由表1可知,3株初筛菌株乙醇脱氢酶酶活均高于出发菌株KB,将乙醛生成乙醇途径的关键酶ADH1、ADH3、ADH4与乙醇生成乙醛的关键酶ADH2酶活增幅相比较可以看出,初筛菌株ADH1、ADH3、ADH4酶活增幅均高于ADH2酶活增幅,该现象表明初筛菌株乙醛生成乙醇的反应速率大于乙醇生成乙醛的反应速率,因而实现乙醛代谢速度的提升。该实验结果很好地证实了初筛菌株的低产乙醛现象,也验证了利用高浓乙醛法选育抗乙醛啤酒酵母菌株的有效性。3组实验菌株中,菌株2乙醇脱氢酶ADH1、ADH3、ADH4酶活显著高于其余实验菌株及对照组,该实验结果与其具有最大乙醛降幅相符合。

表1初筛菌株(共3株)与出发菌株(KB)乙醇脱氢酶活性及酶活增幅对比结果
2.5稳定性实验
对以上3株初筛菌株进行同步发酵并测定发酵液乙醛含量,进行重复实验及传代实验,其中,重复实验设3组平行,传代实验共传5代。
初筛菌株与KB重复性实验见表2:3株初筛菌株与KB实验重复性良好,数据标准偏差均不超过0.20 mg/L。其中,菌株2的乙醛含量平均值最低(4.42 mg/L±0.14 mg/L),比出发菌株(KB)降低了71.13 %。初筛菌株与KB传代实验见表3:菌株2、菌株12表现出良好的遗传稳定性,每代乙醛含量间标准偏差均低于0.20 mg/L。菌株2乙醛含量的波动范围为4.12~4.49 mg/L。

表2初筛菌株(共3株)与出发菌株(KB)重复实验乙醛含量对比结果 (mg/L)

表3初筛菌株(共3株)与出发菌株(KB)传代实验乙醛含量对比结果 (mg/L)
3 结论
本实验从酵母乙醛代谢途径出发,分析了酵母降低乙醛含量的代谢途径,并综合实验操作成效及实验菌株安全性,最终采用将紫外诱变育种与高浓乙醛法平板筛选法相结合的方法筛选抗乙醛啤酒酵母菌株。通过低温发酵实验测定乙醛含量及低乙醛实验菌株乙醇脱氢酶活性,最终筛选得到具有抗高浓度乙醛环境且稳定传代的抗乙醛啤酒酵母菌株。该菌株编号为2,乙醛含量为4.42 mg/L±0.14 mg/L,较出发菌株降低了71.13 %;其乙醇脱氢酶(ADH1、ADH3与ADH4)活性显著高于出发菌株(增幅为88.80 %),且遗传稳定性表现良好。
参考文献:
[1] Joseph T H, William C H. Kinetics of acetaldehyde formation during the staling of lager beer[J]. Journal of the ASBC, 1977, 35(4):183-186.
[2]李红,吴永阳,张五九.啤酒中的乙醛[J].酿酒, 2004, 31(6):
35-37.
[3] Wang D L, Sun J S, Zhang W J. Disruption of brewer's yeast alcohol dehydrogenase II gene and reduction of acetaldehyde content during brewery fermentation[J]. Journal of the ASBC, 2006, 64(4):195-201.
[4]蔡勇,王肇悦,晏本菊.关于控制啤酒乙醛含量的研究进展[J].中国酿造, 2008,182(5):4-6.
[5]张媛媛,李崎.低产乙醛啤酒酵母的选育与研究[D].无锡:江南大学, 2011.
[6]沈楠,王金晶,刘春凤,等.低产乙醛啤酒酵母的定向驯化筛选[J].食品与发酵工业,2013, 39(7):94-97.
[7]全国食品工业标准化技术委员会.GB/T 4928—2008啤酒分析方法[S].北京:中国标准出版社,2009.
The Screening of Acetaldehyde-resistant Beer Yeast Strains by High-concentration Acetaldehyde Method
JIN Weiyun, LI Hong and WANG Junwei
(China National Research Institute of Food & Fermentation Industries, Beijing 100015, China)
Abstract:Acetaldehyde is the main source of cardboard and rotten apple flavor in beer, which has a great influence on beer quality. In this study, acetaldehyde content in the fermenting liquid (low- temperature fermentation by starting strains and 20 experimental yeast strains screened by UV mutation and high-concentration acetaldehyde breeding method) was measured by GC. Then acetaldehyde content in fermenting liquid by experimental strains was compared with that by starting strains. And the activity of alcohol dehydrogenase and the stability test of the experimental strains (3 strains in total) with large decreasing amplitude of acetaldehyde content were carried out to select acetaldehyde-resistant yeast strains. The content of acetaldehyde of the final-selected beer yeast strains was 4.42±0.14 mg/L, 71.13 % lower than the starting strains; the activity of alcohol dehydrogenase (ADH1, ADH3 and ADH4 ) was significantly higher than the starting strains (increased by 88.80 % ), and good genetic stability was expressed.
Key words:microbe; acetaldehyde; acetaldehyde-resistant beer yeast; high-concentration acetaldehyde method; alcohol dehydrogenase
通讯作者:李红(1978-),男,博士,博士后,高级工程师,研究方向:食品发酵。
作者简介:金玮鋆。
收稿日期:2015-07-23
基金项目:国家国际科技合作专项项目(2014DFG31770)。
DOI:10.13746/j.njkj.2015319
中图分类号:TS262.5;TS261.1;TS261.4
文献标识码:A
文章编号:1001-9286(2016)01-0010-05

