玉米蛋白粉部分替代鱼粉对大菱鲆幼鱼的生长性能和游离氨基酸代谢的影响❋
许丹丹, 何 艮, 周慧慧, 宋 飞
(中国海洋大学水产动物营养与饲料农业部重点实验室;海水养殖教育部重点实验室,山东 青岛 266003)
玉米蛋白粉部分替代鱼粉对大菱鲆幼鱼的生长性能和游离氨基酸代谢的影响❋
许丹丹, 何艮❋❋, 周慧慧, 宋飞
(中国海洋大学水产动物营养与饲料农业部重点实验室;海水养殖教育部重点实验室,山东 青岛 266003)
摘要:以初始体重(9.19±0.01)g的大菱鲆幼鱼为研究对象,研究玉米蛋白粉部分替代饲料中的鱼粉蛋白对大菱鲆幼鱼的生长性能、血浆生化指标、组织游离氨基酸含量及氨基酸分解关键酶基因表达的影响。设计2种等氮、等能的实验饲料组:鱼粉对照组(FM)和玉米蛋白粉替代45%鱼粉蛋白组(CGM),分别饱食投喂大菱鲆幼鱼30天。研究表明:与FM组相比,CGM组大菱鲆幼鱼的特定生长率、饲料效率、以及蛋白质和脂肪沉积率显著降低,且全鱼粗蛋白和粗脂肪含量也显著降低(P<0.01),但CGM组的全鱼水分和灰分含量显著高于FM组(P<0.01)。CGM组血浆总蛋白、葡萄糖、甘油三酯和总胆固醇含量均较FM组显著降低(P<0.05)。大菱鲆摄食CGM组饲料后,其血浆和肌肉游离氨基酸含量均较FM组显著降低,且肌肉氨基酸降幅度更大(P<0.05)。CGM组肠道支链α-酮酸脱氢酶二氢硫辛酸转乙酰基酶(BCKD-E2)mRNA表达量较FM组显著升高。结果表明:玉米蛋白粉替代45%鱼粉蛋白显著抑制了大菱鲆幼鱼的生长,降低了饲料效率,影响了鱼体营养物质的组成和代谢,加快了肠中氨基酸的分解代谢,降低了组织游离氨基酸的平衡性和总量。
关键词:大菱鲆;玉米蛋白粉;替代;氨基酸;基因表达
XU Dan-Dan, HE Gen, ZHOU Hui-Hui, et al. Effects of partial replacement of fish meal with corn gluten meal on growth performance and free amino acid metabolism of juvenile turbot (ScophthalmusmaximusL.) [J].Periodical of Ocean University of China, 2016, 46(2): 26-34.
据联合国粮农组织的报告,2012年世界上超过一半的水产品来自养殖[1]。然而,受世界鱼粉产量和价格的影响,水产养殖业的可持续发展越来越受到饲料原料来源的制约,而饲料原料的核心问题是蛋白源问题[2]。尽管一系列植物性蛋白原料,可用于部分替代鱼类饲料中的鱼粉,然而对于海水肉食性鱼类,植物蛋白源的替代遇到了瓶颈,当饲料中鱼粉替代率超过50%以后,饲料的蛋白质效率就明显下降,并伴随有生长减缓、生理机能降低等情况的出现[3-5]。从养殖成本、可持续性及鱼类健康方面来说,非鱼粉蛋白源替代鱼粉的研究需不断深入。
氨基酸不仅是蛋白质和其它含氮化合物合成的前体,也参与体内主要代谢途径的调控,且越来越多的学者证明氨基酸也作为信号分子参与细胞内信号传导过程[6-7]。因此,体内氨基酸组成的变化将对机体生理变化、代谢状态和生长等有重要影响。在鱼类中研究发现,饲料氨基酸模式和组织游离氨基酸库的组成具有高度相关性[8-10]。组织游离氨基酸的变化说明了机体的营养状况,决定蛋白质合成方向,因此需要阐明不同饲料原料与组织氨基酸库组成间的关系。已有研究表明,当体内FAA不平衡时,氨基酸分解供能加剧,降低蛋白质的合成率,通过检测氨基酸分解的关键酶基因表达状况可以一定程度判断体内氨基酸代谢情况[11],本文选择检测支链α-酮酸脱氢酶二氢硫辛酸转乙酰基酶(BCKD-E2)的基因表达变化。
大菱鲆(ScophthalmusmaximusL.)是世界范围内重要的海水养殖肉食性性鱼类[9,12-13],也是中国北方重要的养殖经济鱼类,其饲料蛋白需求量高,大概为50%左右,因此本论文选择大菱鲆作为研究对象。课题组前期研究结果显示,复合植物蛋白源替代大菱鲆幼鱼饲料鱼粉比例超过40%时显著降低鱼类生长性能[14],且玉米蛋白粉单一替代鲆鲽鱼类饲料鱼粉蛋白超过40%时,对生长有显著负面影响[8,15]。因此,本研究选择45%替代水平的玉米蛋白粉作为实验饲料,研究其在影响鱼体生长的情况下对鱼体生理生化指标、组织游离氨基酸含量和氨基酸分解代谢的影响,以探究植物蛋白源在鱼体中引起的生理应答状态的变化,以期为植物蛋白源在肉食性鱼类饲料中的应用提供一定的理论依据。
1材料与方法
1.1 实验饲料
以鱼粉(OPENCA,秘鲁)和谷朊粉为主要蛋白源,鱼油、棕榈油和大豆卵磷脂为主要脂肪源,配制粗蛋白约50%,粗脂肪约11.5%的对照组饲料(FM)。以玉米蛋白粉(CG)(七好生物科技有限公司,中国)替代FM组45%鱼粉蛋白,设计等氮等能的植物蛋白源替代组饲料,实验饲料组成及营养成分见表1,2组饲料氨基酸组成见表2。
饲料原料粉碎后过80目筛网,将粉碎好的原料按饲料配方由小到大逐一混合均匀,然后与油脂充分混合,最后再加入大约30%蒸馏水揉匀后制粒。烘干且待冷却后,用双层塑料袋包装并封口,储存于-20℃冰箱中备用。
1.2 实验过程与管理
大菱鲆幼鱼为当年人工培育的同一批苗种,购于山东省海阳市黄海水产有限公司。养殖实验在山东省海阳市黄海水产公司养殖基地进行。实验开始前,以两处理组实验饲料的等量混合物作为暂养料暂养2周,使鱼逐渐适应水环境和实验饲料。
实验开始前,将暂养鱼饥饿24h,然后用丁香酚麻醉(1∶10000)(上海试剂公司)。之后随机抽取100尾鱼称重作为初始鱼体重((9.19±0.01)g)。选择大小均匀、体格健壮、无损伤的大菱鲆随机分到6个养殖桶(玻璃纤维,500L),每桶放养40尾鱼。每组饲料随机投喂3个养殖桶的实验鱼,并于每天2次(07:00和19:00)投喂大菱鲆至表观饱食,投喂1h后记录每顿的残饵数量。投喂后换水70%左右。如有死鱼,记录数量、重量和症状。养殖采用室内长流水养殖系统,整个养殖期间均采用24h连续充氧,遮蔽所有窗户、关闭灯光(投喂期间除外)以降低室内光线强度,实验期间水温保持在16~19℃。
1.3 样品采集
分鱼期间,随机抽取20尾实验鱼作为初始鱼,样品置-20℃冰箱保存待用。30d养殖结束时,实验鱼饥饿24h后称重,记录每桶鱼的数量和重量,分别随机从每桶中抽取6尾鱼,用于常规分析,置-20℃冰箱保存。其它鱼继续饥饿24h,共饥饿48h,以使各组鱼代谢均达到均匀稳定水平[16]。然后重新投喂各自饲料至表观饱食状态,在投喂后8和24h分别随机取样,确保所取的鱼均为充分摄食的鱼即胃肠中充满食物的鱼,否则弃用。2个时间点鱼均抽取尾静脉血于肝素钠抗凝管中,静置后3000g离心5min,吸取上层血浆后分装,放于液氮保存。投喂后8h时,在抽完血的鱼背部相同位置割下一块肌肉放离心管中,置液氮中保存,用于检测肌肉中的游离氨基酸含量。在禁食8h时,每个养殖桶中随机取4尾鱼用于分子实验的分析,每2尾鱼的样品放于1个离心中,每个处理共取6份独立样品(n=6);采用颈椎切断法杀死实验鱼,剥取肠,在生理盐水中快速冲洗掉食物残渣,置离心管中放于液氮保存;每尾鱼在背部相同位置割下一块肌肉置离心管中放于液氮保存;取样结束后所有样品置-80℃冰箱中保存待用。

表1 实验饲料配方及化学组成(干物质)
Nate:1矿物质混合物Mineral premix(mg/kg):CoCl2·6H2O (1%), 50; CuSO4·5H2O (25%), 10; FeSO4·H2O (30%), 80; ZnSO4·H2O (34.5%), 50; MnSO4·H2O(31.8%), 45; MgSO4·7H2O(15%), 1200; Sodium selenite (1%), 20; Calcium iodine (1%) 60; Zoelite, 11470。
2维生素混合物Vitamin premix(mg/kg):Thiamin (98%), 25; Riboflavin (80%), 45; Pyridoxine-HCl (99%), 20; Vitamin B12 (1%), 10;Vitamin K3 (51%), 10; Inositol(98%), 800; Pantothenic acid(98%), 60; Niacin acid(99%), 200; Folic acid(98%), 20; Biotin(2%), 60; Retinol acetate(500000IU/g), 32; Cholecalciferol(500000IU/g), 5 mg; Alpha-tocopherol(50%), 240; Ascorbic acid(35%), 2000; Anti-oxidants (Oxygen ling grams, 100%), 3; Rice husk powder (100%), 11470。
3其它:啤酒酵母2%,氯化胆碱0.25%,防霉剂0.1%,抗氧化剂0.05%,诱食剂(甜菜碱∶二甲基-β -丙酸噻亭∶甘氨酸∶丙氨酸∶5-磷酸肌苷=4∶2∶2∶1∶1) 1.0%。Others: Beer yeast 2%, Choline Chloride 0.25%, Mold inhibitor 0.1%, Antioxidant 0.05%, Attractant (Betaine∶Dimethyl-propiothetin∶Glycine∶Alanine∶5-phosphate inosine = 4∶2∶2∶1∶1) 1.0%.

表2 实验饲料氨基酸组成(干物质)
1.4 生化分析
饲料原料、饲料和全鱼常规组成测定方法参考文献[17]。样品在105℃烘干24h,检测水分;凯氏定氮法(N×6.25)检测粗蛋白;索氏抽提法检测粗脂肪;550℃马弗炉高温灼烧法检测灰分。使用绝热式热量计(C2000;IKA werke,Germany)检测饲料能量。
1.5 血浆生化指标检测
检测摄食后24h实验鱼血浆中的总蛋白、葡萄糖、甘油三酯和总胆固醇含量。使用全自动生化分析仪(Biomix-800,Sysmex,Japan)进行测定,检测所需试剂购自Sysmex Corporation。
1.6 氨基酸检测
1.6.1 原料和饲料氨基酸的检测准确称取20~40mg样品双份于25mL水解管中,酸水解方法制得水解液[18]。含硫氨基酸蛋氨酸和胱氨酸的检测,必需先用过硫酸氧化,使之转变为稳定的氧化物蛋氨酸砜和磺基丙氨酸,再进行检测[19],使用全自动氨基酸检测仪(L-8900,Hitachi,Japan)检测氨基酸含量,色谱柱为钠离子交换柱。
1.6.2 组织游离氨基酸的检测检测摄食后8h的实验鱼血浆和肌肉中游离氨基酸的含量。使用全自动氨基酸检测仪(L-8900,Hitachi,Japan)检测氨基酸含量,色谱柱为锂离子交换柱。
从-80℃中取出血浆置4℃冰箱中解冻,待血浆融化后,取0.4mL血浆置于2mL离心管中,加入1.2mL 10%磺基水杨酸,二者充分混匀静置5min,13000r/min 4℃ 离心15min,用1mL注射器吸取上清,0.22μm滤膜过滤加入上样管中,检测血浆中游离氨基酸浓度[20]。
从-80℃中取出肌肉样品置4℃冰箱中解冻,待融化后,准确称取1g肌肉置于5mL离心管中,加入3mL 10%磺基水杨酸,匀浆破碎后取1.5mL匀浆液,13000r/min 4℃离心15min,取上清用0.22μm滤膜过滤,检测肌肉中游离氨基酸浓度[21]。
1.7 实时定量PCR(qRT-PCR)
肠和肌肉总RNA提取采用Trizol试剂(Invitrogen,USA),具体操作过程参考李明珠[22]的方法。使用PrimeScript®RT reagent Kit With gDNA Eraser(Perfect Real Time)(TAKALA,Japan)进行RNA反转录,具体步骤参照试剂盒说明书。使用SYBR® Primix Ex TaqTM(TAKALA,Japan)进行荧光定量反应,实验过程与条件参照Zuo等[23]。目的基因BCKD-E2(branch-chain α-keto acid dehydrogenase dihydrolipoyl transacylase)引物序列为:上游引物,CTGCTCAGCGTGTTGGATG;下游引物,GAGGGAGAATCACTGGTTTGG。内参基因选择GAPDH(glyceraldehyde-3-phosphate dehydrogenase),引物序列为:上游引物,AGCAGCAGCCATGTCAGACC;下游引物,TTGGGAGACCTCACCGTTGTAAC;且2个处理组间内参基因表达量无显著性差异(结果未列出)。定量数据采用相对定量中的2-△△Ct分析,要使此分析方法有效,目的基因和内参基因的引物扩增效率必须一致且接近1[22],本实验目的基因与内参基因扩展效率一致。采用2-ΔΔCt方法测定目的基因的表达量,计算各处理组目的基因的表达量。计算公式为:
△△Ct=△Ct(处理组)-△△Ct(对照组);
△Ct(处理组)=
Ct(处理组目的基因)-Ct(处理内参基因);
△Ct(对照组)=
Ct(对照组目的基因)-Ct(对照内参基因)。
1.8 相关指标计算和数据统计分析
特定生长率(SGR,%/d)=100×(ln终末体重-ln初始体重)/养殖天数。
摄食量(FI,%/d)=100×总摄食量/[养殖天数×(初始体重+终末体重)/2]。
饲料效率(FE)=鱼体湿增重(g)/总摄食量(g)。
蛋白质效率(PER)=鱼体湿增重(g)/蛋白质摄入量(g)。
营养沉积率=100×[(终末体重×终末鱼体营养成分含量)-(初始体重×初始鱼体营养成分含量)]/营养摄入量。
式中,营养指蛋白质和脂肪。
成活率(SR,%)=100×(终末鱼数量/初始鱼数量)。
试验数据用平均值±标准误(M±SE)表示,采用SPSS 16.0版软件对所得数据进行数据分析和统计。数据作单因子方差分析(ANOVA),且数据进行方差齐性检验,若处理间有显著差异,再作Tukey’s多重比较,P<0.05表示处理间差异性显著。
2结果
2.1 生长和饲料利用
如表3所示,与鱼粉组(FM)相比,玉米蛋白粉替代45%鱼粉蛋白(CGM)极显著降低大菱鲆幼鱼的终末体重(FBW)、定生长率(SGR)、饲料效率(FE)、蛋白质效率(PER)、蛋白质沉积率和脂肪沉积率(P<0.01),其中以脂肪沉积率降低幅度最大,下降98.85%±075%。摄食量(FI)和成活率(SR)在各处理组之间无显著性差异(P>0.05)。
2.2 全鱼体组成
由表4可知,CGM组的水分和灰分含量极显著高于FM组(P<0.01),但粗蛋白和粗脂肪含量极显著低于FM组(P<0.01)。
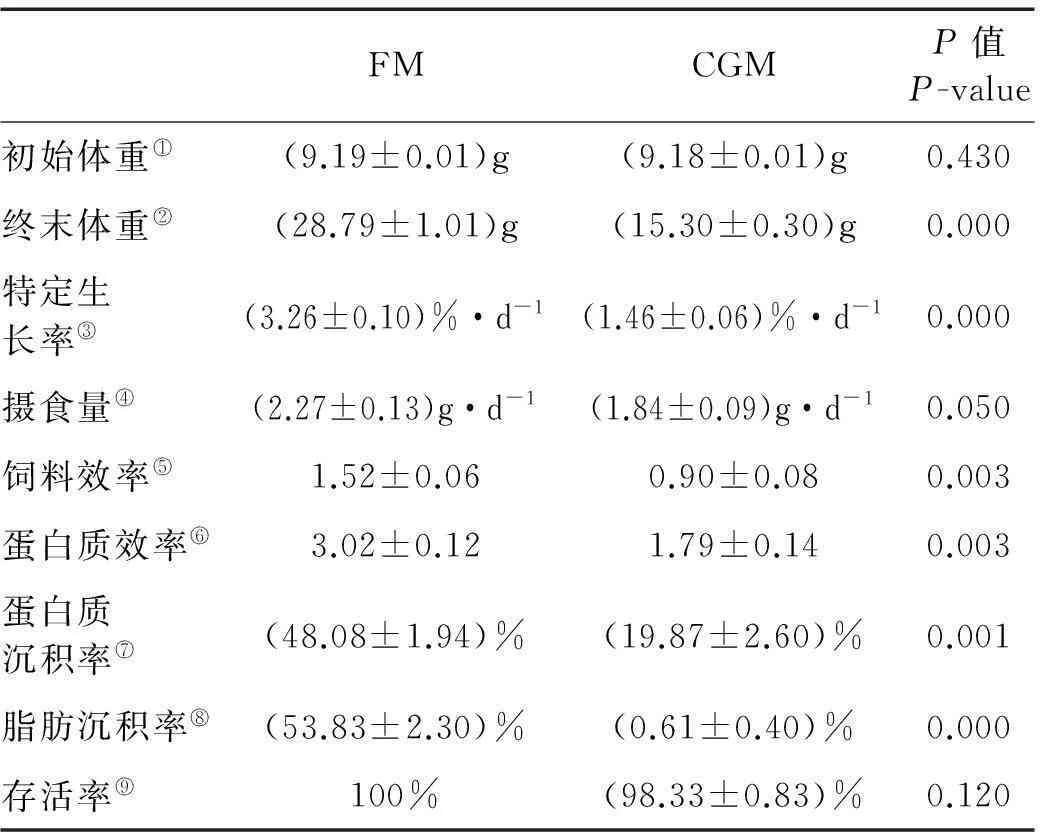
表3 生长性能和营养利用
注:数值以平均值±标准误表示(n=3)。Values are means±SE (n=3).
①Initoal body weight; ②Final body weight;③Specific growth rate; ④Feed intake; ⑤Feed efficiency; ⑥Protein efficiency; ⑦Protein retention; ⑧Fat retention; ⑨Percentge of survival
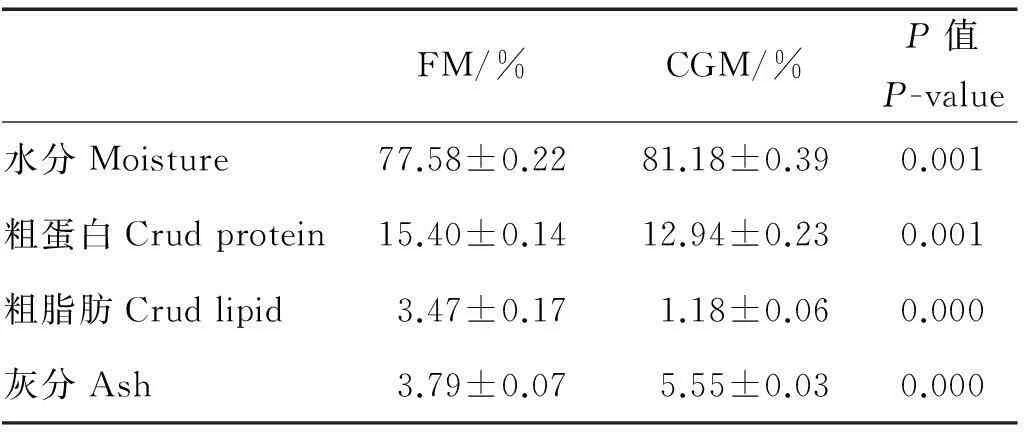
表4 摄食不同饲料对大菱鲆幼鱼体成分的影响(湿重)
注:数值以平均值±标准误表示(n=3)。Values are means ± SE (n=3).
2.3 血浆生化指标
由表5中结果可知,FM组血浆总蛋白和葡萄糖(GLU)含量显著高于CGM组(P<0.05),而甘油三酯和总胆固醇(TCHO)含量均极显著高于CGM组(P<0.01)。

表5 摄食不同饲料对大菱鲆幼鱼血浆指标的影响
注:数值以平均值±标准误表示(n=3)。 Values are means ± SE (n=3).
①Total protein; ②Glucose; ③Triglyceride; ④Total cholesterol
2.4 血浆游离氨基酸组成
表6结果表明,大菱鲆摄食CGM组饲料8h后,血浆游离单一必需氨基酸(EAA)Thr、Ile、Leu和Phe均较FM组显著降低(P<0.05),且游离总EAA含量也出现显著降低(P<0.05)。而对于CGM组的血浆游离单一非必须氨基酸(NEAA),除Ala和Pro外,其它氨基酸均显著低于FM组(P<0.05),且游离总NEAA也较FM组显著降低(P<0.05)。与FM组相比,CGM组也显著降低血浆总游离氨基酸(TAA)含量(P<0.05)。
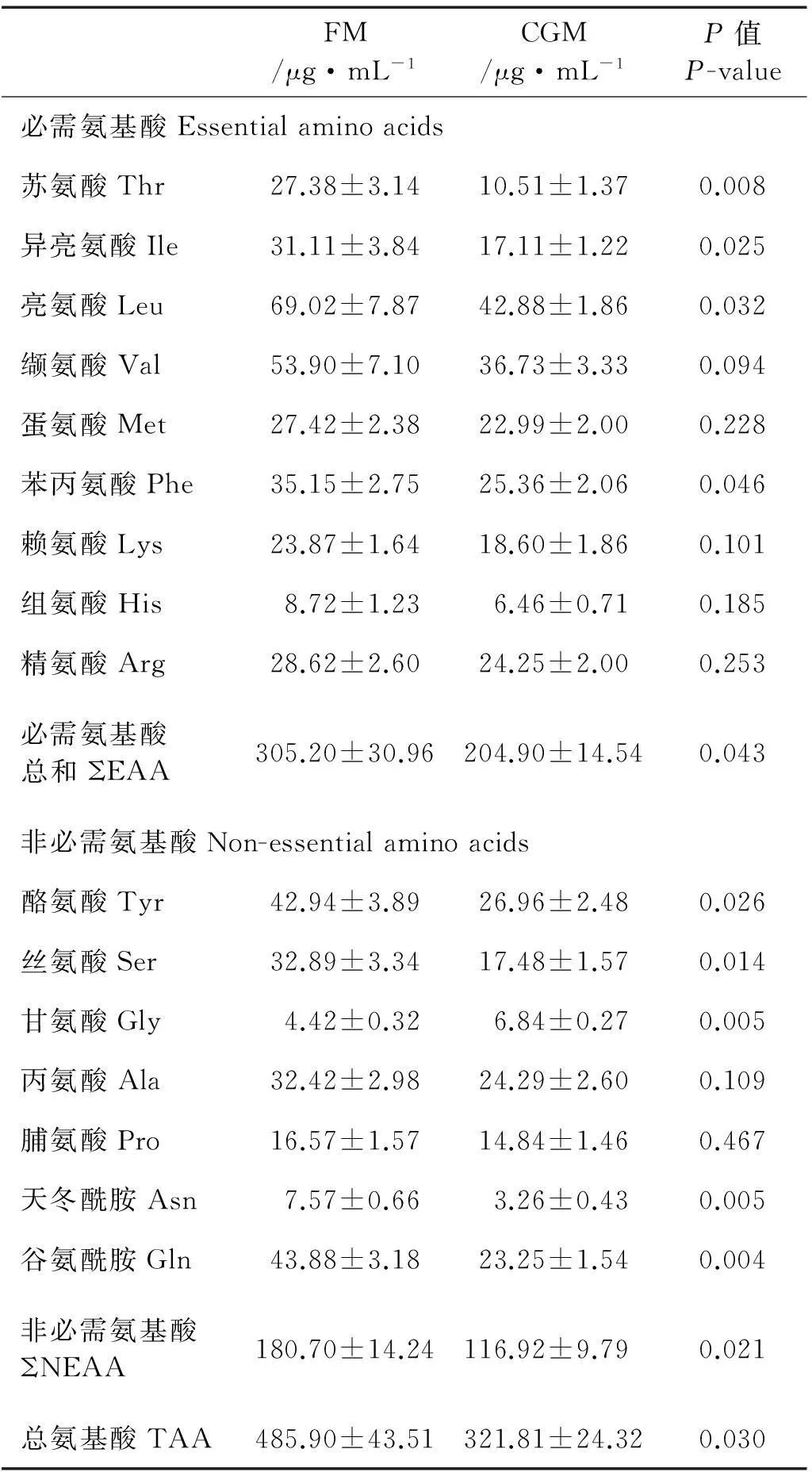
表6 摄食不同饲料对大菱鲆幼鱼血浆游离氨基酸组成的影响
注:数值以平均值±标准误表示(n=3)。 Values are means ± SE (n=3).
2.5 肌肉游离氨基酸组成
表7结果表明,大菱鲆摄食CGM组饲料8h后,除肌肉Phe外,其它游离单一必需氨基酸(EAA)含量均较FM组显著降低:其中His显著降低(P<0.05),而其它氨基酸均达到极显著水平(P<0.01),且游离总EAA含量也极显著降低(P<0.01)。而对于CGM组的肌肉游离单一非必须氨基酸(NEAA),除Gly外,其它氨基酸均显著低于FM组(P<0.05),且游离总NEAA也较FM组极显著降低(P<0.01)。与FM组相比,CGM组也极显著降低肌肉TAA(P<0.01)。
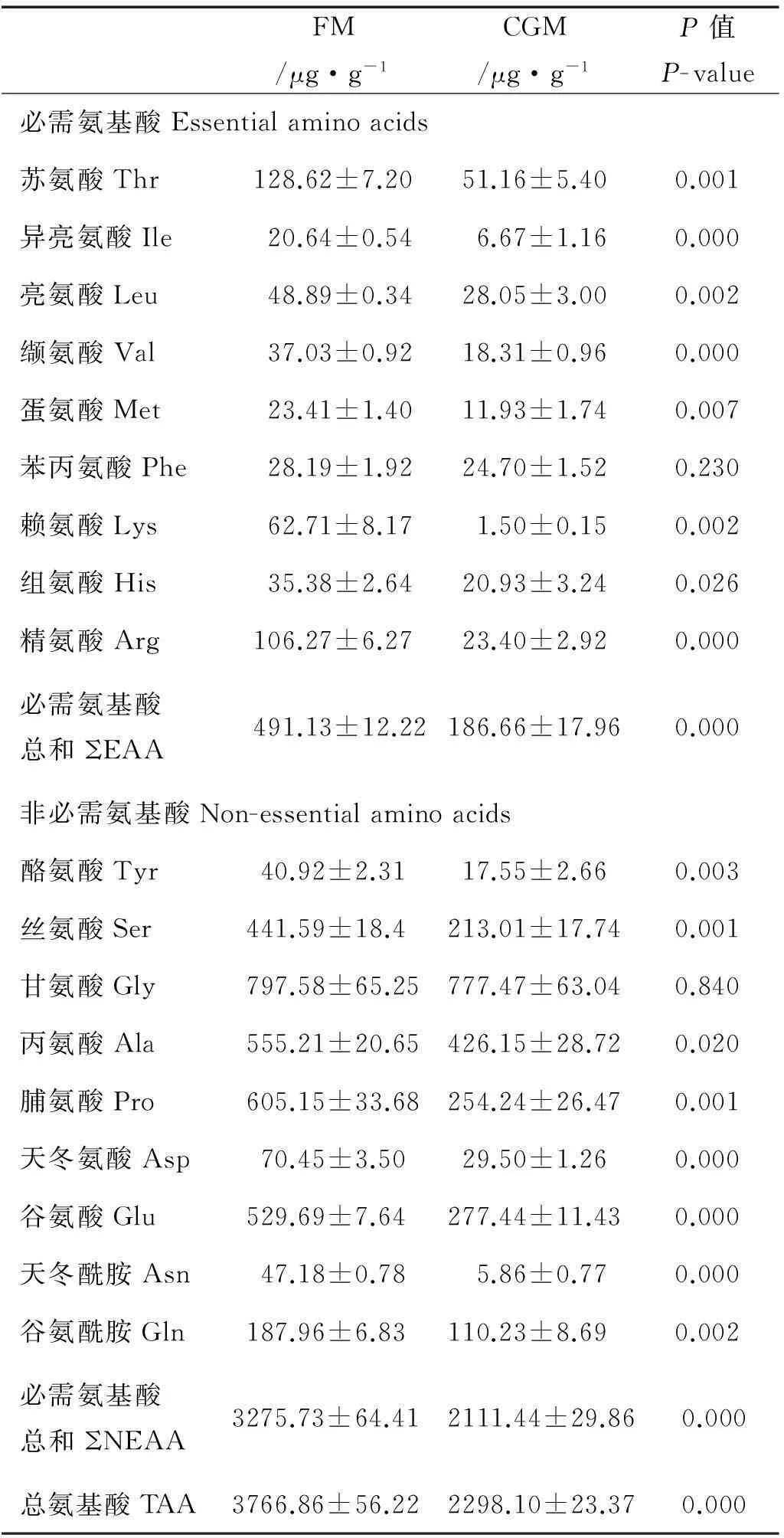
表7 摄食不同饲料对大菱鲆幼鱼肌肉游离
注:数值以平均值±标准误表示(n=3)。Values are means ± SE (n=3).
2.6 支链氨基酸分解关键酶基因表达变化
如图1所示,肠道中CGM组支链α-酮酸脱氢酶二氢硫辛酸转乙酰基酶(BCKD-E2)表达量较FM组极显著提高(P<0.01),而肌肉中两处理组BCKD-E2表达量无显著性差异(P>0.05)。

(以GAPDH作为内参,CMG处理组目的基因表达量以FM组的数值作为参照求比值,将FM组的数值设为1,得到替代组的各数值。结果以平均值±标准误(n=6)表示,全部实验数据采用单因素方差分析,进行Tukey’s多重比较检验,分析结果标注在各图上方(*:P<0.05; **:P<0.01)。Transcription levels were normalized by the reference gene GAPDH. Target gene of CGM group were normalized to the corresponding expression levels of FM sample. Results are expressed as mean ± SE (n=6) and were analyzed by one-way ANOVA followed by Tukey’s multiple range test (*:P<0.05; **:P<0.01).)
图1摄食不同饲料对大菱鲆幼鱼BCKD-E2基因表达的影响
Fig.1BCKD-E2 mRNA levels of juvenile turbot fed the experimental diets
3讨论
研究结果表明,玉米蛋白粉替代45%饲料鱼粉蛋白后,显著降低了大菱鲆幼鱼的特定生长率(SGR)和饲料效率(FE)。这与其它学者在大菱鲆上的植物蛋白源替代研究结果一致,当玉米蛋白粉[8]或大豆浓缩蛋白[12]替代饲料鱼粉蛋白比例接近50%时,SGR和FE均显著性降低。另外,在其它肉食性鱼类,如红鳍东方鲀[24]、尖吻鲈[3]和条石鲷[25]上的结果表明,当非鱼粉蛋白源单一替代饲料中的鱼粉比例超过50%时,FE和蛋白质效率(PER)均降低。一方面,植物蛋白源的生物学价值低于鱼粉,如玉米蛋白粉富含Leu但缺乏Lys,豆粕中严重缺乏Met,且Lys为第二限制性氨基酸。另一方面,FE和PER的降低与蛋白质的消化率低有关。Regost等[8]发现,大菱鲆对添加玉米蛋白粉的饲料消化率随玉米蛋白粉替代量的升高而降低。在其它鱼类尤其是肉食性鱼类中,玉米蛋白粉的蛋白质消化率往往低于鱼粉[26-27]。
本研究发现,当玉米蛋白粉替代45%饲料鱼粉蛋白后,显著降低蛋白质沉积率(PR)和脂肪沉积率(FR)。已知营养物质沉积率与养殖期间机体营养物质增加量相关,也就意味着当非鱼粉蛋白源替代鱼粉后导致鱼体蛋白质和脂肪的合成均降低。因此我们认为,植物蛋白源替代鱼粉后引起鱼体内新陈代谢平衡的混乱,导致了蛋白质和脂肪沉积率的降低[14,28],具体机制有待进一步研究。
当玉米蛋白粉单一替代鱼粉后,显著降低鱼体粗蛋白含量。这与Rogost的研究结果不一致,Rogost的结果显示即使玉米蛋白粉100%替代大菱鲆饲料中的鱼粉也未对鱼体粗蛋白产生影响[8]。分析原因可能是由于实验鱼的大小不同,对同一蛋白源的耐受性不同。另一方面,玉米蛋白粉替代45%鱼粉蛋白后,极显著的降低了鱼体粗脂肪含量,且脂肪沉积率也大幅度降低。这与东方红鳍豚[24]、金头鲷[29]和尖吻鲈[3]上植物蛋白源替代结果一致,表明当植物蛋白源替代鱼粉比例过高,将影响鱼类体脂积累。
本研究表明,当玉米蛋白粉替代鱼粉后,血浆总蛋白显著降低,变化趋势与全鱼粗蛋白变化一致,说明大菱鲆整体蛋白质代谢发生变化。替代组的葡萄糖含量也较鱼粉组降低,与其它鱼类中的研究结果一致[29-31],说明非鱼粉蛋白源替代后影响了鱼类的能量代谢过程。与体脂肪含量变化一致,各替代组的血浆甘油三酯(TG)和总胆固醇(TCHO)含量均低于鱼粉对照组,这也进一步说明非鱼粉蛋白源替代鱼粉后,极大的抑制了脂肪代谢过程。Lim等[24]推测,血浆TG和TCHO含量的降低是由于植物蛋白源中的多酚(黄烷醇类、黄酮类、黄酮醇类等的混合物)导致。然而,在小鼠中的研究发现,当使用醇洗大豆蛋白除去其中的异黄酮后,小鼠血浆中胆固醇含量仍显著降低,且脂肪酸合成途径也处于被抑制状态。Takahashi和Ide[32]认为大豆蛋白本身比其原料中的异黄酮对降低肝脏脂肪生成作用更为重要,而异黄酮在调节脂肪酸氧化和脂肪组织基因表达中发挥作用。而Yun等[13,33]在高植物蛋白饲料中添加胆固醇,发现大菱鲆幼鱼血浆和肝脏中胆固醇含量的升高与饲料中胆固醇含量有较高的相关性,因此提出植物蛋白源降低机体胆固醇的作用是由于植物中本身胆固醇含量较低的缘故。
已有研究表明,当虹鳟[18]摄食饲料后,分别在肝静脉和背动脉取血,发现血浆游离氨基酸(FAA)在摄食后快速升高,总FAA均在摄食后6h达峰值,而各FAA的峰值出现在6~12h之间,在大西洋鳕鱼[34]中的研究也得到了类似结果。因此本试验选择在大菱鲆幼鱼中摄食后8h取样。结果表明,玉米蛋白粉替代饲料鱼粉蛋白后,显著降低了血浆中4种游离必需氨基酸(EAA)的含量,且多数游离非必需氨基酸(NEAA)也有降低,因此我们认为植物蛋白源必需氨基酸的不平衡干扰了非必需氨基酸的吸收。早前研究已经证明了饲料中必需氨基酸模式与组织FAA浓度的关系,我们的结果与之一致[8,35]。这说明血浆游离氨基酸组成受饲料蛋白质质量影响。分析原因,可能是由于肉食性鱼类对植物蛋白的消化率低,且多数必需氨基酸的可利用性也低于鱼粉[27,36]。肌肉是体内重要的游离氨基酸贮存库。本实验发现,替代组中肌肉各FAA较鱼粉组下降幅度更大,在血浆中与对照组无差异的氨基酸,在肌肉中出现了显著性降低,说明肌肉氨基酸库对饲料蛋白质质量更加敏感。在动物快速生长时期,骨骼肌的快速生长主要由餐后蛋白质高合成率决定,由摄食后机体中升高的氨基酸和胰岛素调节[37]。因此当非鱼粉蛋白源替代鱼粉后降低了肌肉中FAA含量,从而抑制蛋白质的合成代谢,导致生长减缓。
同时,我们发现当玉米蛋白粉替代鱼粉,肠道支链氨基酸分解途径关键酶支链α-酮酸脱氢酶二氢硫辛酸转乙酰基酶(BCKD-E2)mRNA表达量较鱼粉组显著升高。因此,肠吸收了消化道中组成不平衡的氨基酸,导致肠中支链氨基酸分解代谢加剧[38],从而进一步加剧了血浆中氨基酸的不平衡程度。因此,尽管玉米蛋白粉中富含亮氨酸(Leu),但是其血浆中Leu含量仍较鱼粉组显著降低。
综上所述,玉米蛋白粉单一替代45%鱼粉蛋白可显著降低鱼类生长性能和饲料利用。玉米蛋白粉替代鱼粉干扰了鱼体蛋白质、脂肪的沉积,使蛋白质尤其是脂肪的沉积率降低。饲料氨基酸的不平衡,加剧了肠道中EAA的氧化消耗,从而进一步降低机体组织中氨基酸的平衡程度,表现为血浆和肌肉中FAA含量出现显著性降低,肌肉中FAA降低幅度更大。对于植物蛋白源替代鱼粉后组织游离氨基酸库变化对机体产生的应答,三大营养素代谢变化的机制,有待深入研究。
参考文献:
[1]Mathiesen A M. The State of World Fisheries and Aquaculture 2012[M]. Rome: Food and Agriculture Orgnization International Deptartmental Working Group, 2012: 230.
[2]Tacon A G, Metian M. Global overview on the use of fish meal and fish oil in industrially compounded aquafeeds: Trends and future prospects[J]. Aquaculture, 2008, 285(1): 146-158.
[3]Tantikitti C, Sangpong W, Chiavareesajja S. Effects of defatted soybean protein levels on growth performance and nitrogen and phosphorus excretion in Asian seabass (Latescalcarifer) [J]. Aquaculture, 2005, 248(1): 41-50.

[5]Drew M, Borgeson T, Thiessen D. A review of processing of feed ingredients to enhance diet digestibility in finfish[J]. Animal Feed Science and Technology, 2007, 138(2): 118-136.
[6]Meijer A J. Amino acids as regulators and components of nonproteinogenic pathways[J]. Journal of Nutrition, 2003, 133(6): 2057-2062.
[7]Wu G. Amino acids: Metabolism, functions, and nutrition[J]. Amino Acids, 2009, 37(1): 1-17.
[8]Regost C, Arzel J, Kaushik S. Partial or total replacement of fish meal by corn gluten meal in diet for turbot (Psettamaxima) [J]. Aquaculture, 1999, 180(1): 99-117.
[9]Fournier V, Huelvan C, Desbruyeres E. Incorporation of a mixture of plant feedstuffs as substitute for fish meal in diets of juvenile turbot (Psettamaxima) [J]. Aquaculture, 2004, 236(1-4): 451-465.
[10]Li P, Mai K, Trushenski J, et al . New developments in fish amino acid nutrition: Towards functional and environmentally oriented aquafeeds[J]. Amino Acids, 2009, 37(1): 43-53.
[11]Seiliez I, Panserat S, Lansard M, et al. Dietary carbohydrate-to-protein ratio affects TOR signaling and metabolism-related gene expression in the liver and muscle of rainbow trout after a single meal[J]. American Journal of Physiology-Regulatory, Integrative and Comparative Physiology, 2011, 300(3): 733-743.
[12]Day O, González H. Soybean protein concentrate as a protein source for turbotScophthalmusmaximusL[J]. Aquaculture Nutrition, 2000, 6(4): 221-228.
[13]Yun B, Ai Q, Mai K, et al. Synergistic effects of dietary cholesterol and taurine on growth performance and cholesterol metabolism in juvenile turbot (ScophthalmusmaximusL.) fed high plant protein diets[J]. Aquaculture, 2012, 324-325: 85-91.
[14]Liu Y, He G, Wang Q, et al. Hydroxyproline supplementation on the performances of high plant protein source based diets in turbot (ScophthalmusmaximusL.)[J]. Aquaculture, 2014, 433: 476-480.
[15]Kikuchi K. Partial replacement of fish meal with corn gluten meal in diets for Japanese flounder Paralichthys olivaceus[J]. Journal of the World Aquaculture Society, 1999, 30(3): 357-363.
[16]Lansard M, Panserat S, Seiliez I, et al. Hepatic protein kinase B (Akt)-target of rapamycin (TOR)-signalling pathways and intermediary metabolism in rainbow trout (Oncorhynchusmykiss) are not significantly affected by feeding plant-based diets[J]. British Journal of Nutrition, 2009, 102(11): 1564-1573.
[17]AOAC. Official methods of analysis of AOAC International[M]. 17th edn. Arlington VA USA: AOAC, 2003.
[18]Yin F G, Liu Y L, Yin Y L, et al. Dietary supplementation with Astragalus polysaccharide enhances ileal digestibilities and serum concentrations of amino acids in early weaned piglets[J]. Amino Acids, 2009, 37(2): 263-270.
[19]杨元秀, 周孝治. 氨基酸分析仪测定饲料及其原料中的含硫氨基酸[J]. 饲料广角, 2009(2): 40-42.
Yang Y X, Zhou X Z. Mesurement of sulfur-containing amino acid in feed and feed ingredients by use of amino acid analyzer[J]. Feed China, 2009(2): 40-42.
[20]Karlsson A, Eliason E J, Mydland L T, et al. Postprandial changes in plasma free amino acid levels obtained simultaneously from the hepatic portal vein and the dorsal aorta in rainbow trout (Oncorhynchusmykiss) [J]. Journal of Experimental Biology, 2006, 209(24): 4885-4894.
[21]Mente E, Deguara S, Santos M B, et al. White muscle free amino acid concentrations following feeding a maize gluten dietary protein in Atlantic salmon (SalmosalarL.) [J]. Aquaculture, 2003, 225(1-4): 133-147.
[22]李明珠. 皱纹盘鲍 Δ5 脂肪酸去饱和酶研究[D]. 青岛: 中国海洋大学, 2013.
Li M Z. Research of Δ5 Fatty Acyl Desaturase in Abalone,HaliotisdiscushannaiIno[D]. Qingdao: Ocean University of China, 2013.
[23]Zuo R, Ai Q, Mai K, et al. Effects of dietary n-3 highly unsaturated fatty acids on growth, nonspecific immunity, expression of some immune related genes and disease resistance of large yellow croaker (Larmichthyscrocea) following natural infestation of parasites (Cryptocaryonirritans) [J]. Fish and Shellfish Immunollogy, 2012, 32(2): 249-258.
[24]Lim S J, Kim S S, Ko G Y, et al. Fish meal replacement by soybean meal in diets for Tiger puffer,Takifugurubripes[J]. Aquaculture, 2011, 313(1-4): 165-170.
[25]Lim S J, Lee K J. Partial replacement of fish meal by cottonseed meal and soybean meal with iron and phytase supplementation for parrot fishOplegnathusfasciatus[J]. Aquaculture, 2009, 290(3): 283-289.
[26]李会涛, 麦康森, 艾庆辉, 等. 大黄鱼对几种饲料蛋白原料消化率的研究[J]. 水生生物学报, 2007, 31(3): 370-376.
Li H T, Mai K S, Ai Q H, et al. Apparent digestibility of selected protein ingredients for larger yellow croakerPseudosciaenaCrocea[J]. Acta Hydrobiologyica Sinica, 2007, 31(3): 370-376.
[27]Yuan Y C, Gong S Y, Yang H J, et al. Apparent digestibility of selected feed ingredients for Chinese sucker,Myxocyprinusasiaticus[J]. Aquaculture, 2010, 306(1): 238-243.
[28]Panserat S, Kolditz C, Richard N, et al. Hepatic gene expression profiles in juvenile rainbow trout (Oncorhynchusmykiss) fed fishmeal or fish oil-free diets[J]. British Journal of Nutrition, 2008, 100(5): 953-967.
[29]Gómez Requeni P, Mingarro M, Calduch Giner J, et al. Protein growth performance, amino acid utilisation and somatotropic axis responsiveness to fish meal replacement by plant protein sources in gilthead sea bream (Sparusaurata) [J]. Aquaculture, 2004, 232(1): 493-510.
[30]Zhou Q, Mai K, Tan B, et al. Partial replacement of fishmeal by soybean meal in diets for juvenile cobia (Rachycentroncanadum) [J]. Aquaculture Nutrition, 2005, 11(3): 175-182.
[31]Gui D, Liu W, Shao X, et al. Effects of different dietary levels of cottonseed meal protein hydrolysate on growth, digestibility, body composition and serum biochemical indices in crucian carp (Carassiusauratusgibelio) [J]. Animal Feed Science and Technology, 2010, 156(3): 112-120.
[32]Takahashi Y, Ide T. Effects of soy protein and isoflavone on hepatic fatty acid synthesis and oxidation and mRNA expression of uncoupling proteins and peroxisome proliferator-activated receptor γ in adipose tissues of rats[J]. The Journal of nutritional biochemistry, 2008, 19(10): 682-693.
[33]Yun B, Mai K, Zhang W, et al. Effects of dietary cholesterol on growth performance, feed intake and cholesterol metabolism in juvenile turbot (ScophthalmusmaximusL.) fed high plant protein diets[J]. Aquaculture, 2011, 319(1): 105-110.
[34]Lyndon A, Davidson I, Houlihan D. Changes in tissue and plasma free amino acid concentrations after feeding in Atlantic cod[J]. Fish Physiology and Biochemistry, 1993, 10(5): 365-375.
[35]Ogata H. Correlations of essential amino acid patterns between the dietary protein and the blood, hepatopancreas, or skeletal muscle in carp (Cyprinuscarpio) [J]. Bulletin of the Japanese Society of Scientific Fisheries (Japan), 1986, 52(2): 307-312.
[36]Lee S M. Apparent digestibility coefficients of various feed ingredients for juvenile and grower rockfish (Sebastesschlegeli) [J]. Aquaculture, 2002, 207(1): 79-95.
[37]Suryawan A, Davis T A. Regulation of protein synthesis by amino acids in muscle of neonates[J]. Frontiers in Bioscience: a Journal and Virtual Library, 2011, 16: 1445.
[38]Zhang Y, Dabrowski K, Hliwa P, et al. Indispensable amino acid concentrations decrease in tissues of stomachless fish, common carp in response to free amino acid- or peptide-based diets[J]. Amino Acids, 2006, 31(2): 165-172.
责任编辑朱宝象
Effects of Partial Replacement of Fish Meal with Corn Gluten Meal on Growth Performance and Free Amino Acid Metabolism of Juvenile Turbot (ScophthalmusmaximusL.)
XU Dan-Dan, HE Gen, ZHOU Hui-Hui, SONG Fei
(The Key Laboratory of Aquaculture Nutrition and Feeds, Ministry of Agriculture; The Key Laboratory of Mariculture, Ministry of Education, Ocean University of China, Qingdao 266003, China)
Abstract:The study was conducted to investigate the effects of the partial substitution of dietary fish meal by corn gluten meal on growth performance, plasma metabolites, tissue amino acid concentration, and branch-chain α-keto acid dehydrogenase dihydrolipoyl transacylase (BCKD-E2) mRNA level of juvenile turbot, Scophthalmus maximus L. (initial weight (9.19±0.01)g). Two isonitrogenous and isoenergetic diets were designed based on fish meal (FM) and corn gluten meal replacing 45% of fish meal protein (CGM). Each diet was randomly allocated to triplicate groups of juvenile turbots for 30 days. The results showed that corn gluten meal replacing 45% of fish meal protein resulted in significantly decreased financial body weight (FBW), specific growth rate (SGR), feed efficiency (FE), protein efficiency ratio (PER), protein and fat retention (PR and FR), as well as whole body crude protein and lipid content (P<0.01), while feed intake (FI) and survival rate (SR) were not affected by both two diets. However, compared with FM diet, fish fed CMG diet greatly increased whole body moisture and ash content (P<0.01). Fish meal was replaced by corn gluten meal resulted in the reduction of plasma total protein (TP), glucose (GLU), triglycerides (TG) and total cholesterol (TCHO) (P<0.05). Plasma and muscle free amino acid patterns were affected by dietary protein sources and showed significant low levels in fish fed CGM diet, especially in muscle except phenylalanine and glycine, all of the essential and non-essential amino acids were markedly lower in CMG diet than that FM diet (P<0.05). Compared with FM diet, CGM diet significantly increased BCKD-E2 mRNA level in intestine (P<0.01). Thus, this study suggested that 45% substitution of fish meal by corn gluten meal significantly decreased growth performance, feed utilization, affected global nutrient composition and metabolism, increased intestinal amino acid catabolism, and impaired tissue amino acid balance and concentration in juvenile turbot. The present study indicates that the poor growth performance of corn gluten meal incorporated diet may be mainly due to the lower free amino acid concentration in fish tissues after feeding.
Key words:Turbot; corn gluten meal; replacement; amino acid; gene expression
DOI:10.16441/j.cnki.hdxb.20140408
中图法分类号:S963.16
文献标志码:A
文章编号:1672-5174(2016)02-026-09
作者简介:许丹丹(1986-),女,博士。E-mail:dandxu2008@163.com❋❋通讯作者: E-mail:hegen@ouc.edu.cn
收稿日期:2014-12-12;
修订日期:2015-02-15
基金项目:❋ 国家自然科学基金项目(31222055);国家重点基础研究发展计划(2014CB138602)资助
引用格式:许丹丹, 何艮, 周慧慧, 等. 玉米蛋白粉部分替代鱼粉对大菱鲆幼鱼的生长性能和游离氨基酸代谢的影响[J]. 中国海洋大学学报(自然科学版), 2016, 46(2): 26-34.
Supported by National Natural Science Foundation of China (31222055); National Program on Key Basic Research Projects(2014CB138602)

