胰岛素抵抗肝癌细胞IGF-1R/NF-κB表达及多药耐药机制研究*
王以浪,印滇,杨莉,张亮,姚登福
·原发性肝癌·
胰岛素抵抗肝癌细胞IGF-1R/NF-κB表达及多药耐药机制研究*
王以浪,印滇,杨莉,张亮,姚登福
目的探讨胰岛素抵抗(IR)肝癌细胞胰岛素样生长因子1受体(IGF-1R)和核因子-κB(NF-κB)表达变化及多药耐药(MDR)发生机制。方法采用高浓度胰岛素诱导人肝癌细胞(HepG2和HepG2.2.15)建立胰岛素抵抗(IR)细胞模型。采用Western blot法检测胰岛素受体(InsR)、IGF-1R、NF-κB和P-糖蛋白(P-gp)表达变化。使用流式细胞仪(Annexin V-FITC法)检测阿霉素对细胞凋亡的影响。结果分别用100 nmol/L和1 000 nmol/L胰岛素培养HepG2和HepG2.2.15细胞48 h,成功建立IR肝癌细胞模型;IR肝癌细胞IGF-1R、NF-κB、P-gp表达上调,而InsR表达下调;应用25μg/mL阿霉素作用细胞24 h后,IR-HepG2细胞组凋亡率(31.1%±1.9%)显著低于HepG2细胞组【(49.7%±2.2%),P<0.01】,IR-HepG2.2.15细胞凋亡率【(20.1±1.7)%】显著低于HepG2.2.15细胞【(33.8±1.8)%,P<0.01】;HepG2.2.15和IR-HepG2.2.15细胞凋亡率分别较HepG2和IR-HepG2细胞显著降低(P<0.01)。结论IGF-1R/NF-κB/P-gp过表达可能介导IR肝癌细胞对阿霉素的多药耐药。
HepG2细胞;胰岛素抵抗;胰岛素样生长因子1受体;核因子-κB;P糖蛋白;多药耐药
肝细胞癌(hepatocellular carcinoma,HCC)是最常见的恶性肿瘤之一。我国HBV相关性HCC约占80%,而代谢异常也是重要的致病因素[1-2]。近来研究显示,2型糖尿病(type 2 diabetes mellitus,T2DM)患者HCC发病率明显增高[3-4]。胰岛素抵抗(insulin resistance,IR)是指各种原因使胰岛素靶器官(肝、脂肪、骨骼肌等)对胰岛素的敏感性降低,导致β细胞代偿性分泌过多胰岛素,出现高胰岛素血症。IR是T2DM发病的核心环节[5]。胰岛素与胰岛素受体(insulin receptor,Ins R)和胰岛素样生长因子1受体(insulin-like growth factor 1 receptor,IGF-1R)结合,介导下游信号通路传递,并与HCC发生关系密切[6]。P糖蛋白(P-glycoprotein,P-gp)表达上调与肿瘤多药耐药(multi-drug resistance,MDR)表型形成密切相关[7]。我们前期研究提示核因子-κB(nuclear factorκB,NF-κB)可诱导肝癌细胞P-gp过表达及MDR形成,而抑制NF-κB表达可以逆转MDR[8-10]。有研究显示,胰岛素可诱导多种细胞P-gp表达上调,介导MDR[11-12],但胰岛素能否诱导人肝癌细胞多药耐药以及其作用机制尚不清楚。本研究采用高浓度胰岛素加入细胞培养液,诱导人肝癌细胞(HepG2和HepG2.2.15)培养,建立肝癌细胞IR模型,观察了细胞Ins R、IGF-1R、NF-κB和P-gp等表达的变化,以探讨IR肝癌细胞对阿霉素多药耐药的机制。
1 材料与方法
1.1 细胞与试剂人肝癌细胞HepG2和整合HBV DNA的HepG2.2.15细胞株购自中国科学院上海生物化学与细胞生物学研究所。胰岛素、琼脂糖、溴化乙锭、二乙基焦炭酸、无酚红RPMI 1640培养基(Sigma公司);新生小牛血清(杭州四季青生物工程材料研究所);鼠抗人InsR-β抗体(ab983)、兔抗人InsR-β磷酸化(Y1361)抗体(ab60946)、兔抗人IGF-1R抗体(ab39675)、抗IGF-1R磷酸化(Y1161)抗体(ab39398)、兔抗人p65磷酸化(S536)抗体(ab86299)、兔抗人P-gp抗体(ab10347,美国Abcam公司);兔抗人核因子-κB抑制蛋白α(IκBα)抗体(SAB4501995,Sigma公司),羊抗兔IgG和羊抗鼠IgG(美国Jackson公司)。
1.2 IR肝癌细胞模型建立取HepG2和HepG2. 2.15细胞,复苏后用含10%灭活小牛血清的RPMI 1640培养液在37℃、5%CO2条件下培养。当细胞贴壁长满后,倾去培养基,用0.25%胰蛋白酶消化。根据细胞生长情况传代。取对数生长期细胞接种于无血清的RPMI 1640培养液中,待细胞完全贴壁,分别加入1、10、100、1 000和10 000 nmol/L的胰岛素,孵育24 h、48 h和60 h,用葡萄糖氧化酶法测定培养上清液葡萄糖含量。计算空白组与不同胰岛素浓度组细胞葡萄糖消耗量差值,选择葡萄糖消耗量差值最小,即达到胰岛素抵抗最高状态的胰岛素作用浓度为胰岛素最佳浓度。采用四甲基偶氮唑盐(MTT)法测定各组细胞活性。
1.3 细胞蛋白表达检测分别将各组细胞接种于6孔板中,培养48 h后,弃培养液,经PBS洗涤,胰酶消化,1000 r/m离心5 min,收集细胞,弃上清液,冰上操作:按照1×106个细胞加细胞裂解液100 μl和PMSF 1μl裂解细胞,冰上静置10 min,4℃,12000 r/m离心15 min,收集上清液,以BCA法测定蛋白浓度。采用Western blot法检测蛋白表达,取蛋白样品20μg,加至0.5 mL EP管内,加上样缓冲液按比例稀释蛋白,混匀后于沸水中煮5 min,使蛋白变性。制作10%分离胶和4%浓缩胶。向电泳槽内加入电泳缓冲液,每道上样蛋白样品20μg,先80 V×35 min,然后改为100 V×60 min。在电泳结束后,以恒流300 mA×110 min转膜。转膜结束后,以TBS-T洗涤缓冲液脱色摇床上漂洗5 min,2次,TBS洗5 min。将膜转移至封闭液,室温下脱色摇床上摇动封闭1 h。取出膜,用TBS-T漂洗10 min,2次,TBS洗涤10 min。然后,加入一抗,4℃过夜,TBS-T漂洗5 min,2次,TBS洗5 min,加入二抗,室温孵育2 h,漂洗、DAB显色并摄像。
1.4 细胞凋亡检测采用Annexin V-FITC法,取25μg/mL阿霉素加入各组肝癌细胞培养液中,共培养24 h。分别收集各组细胞,离心,吸净上清,PBS洗涤细胞2次。加入Annexin V-FITC结合液195μl,轻轻重悬细胞,再加入Annexin V-FITC 5 μl,轻轻混匀,室温避光孵育10 min。离心,弃上清,加入Annexin V-FITC结合液190μl,轻轻重悬细胞。加入PI染色液10μl,轻轻混匀,冰浴、避光放置。使用流式细胞仪检测各组细胞凋亡率,每组检测3次,取平均值。
2 结果
2.1 胰岛素对肝癌细胞存活率的影响应用不同浓度的胰岛素作用HepG2和HepG2.2.15细胞不同时间后,各浓度组胰岛素均有抑制肝癌细胞增殖的作用。与1 000 nmol/L胰岛素组比,10 000 nmol/L胰岛素作用HepG2(t=5.57,P<0.01)和HepG2.2.15细胞(t=7.25,P<0.01)24 h,对细胞活性抑制明显增强,差别有统计学意义(图1)。

图1 胰岛素对肝癌细胞存活率的影响A:与1 000nmol/L胰岛素作用HepG2细胞24 h组比,#P=0.02;B:与1 000nmol/L胰岛素作用HepG2.2.15细胞24 h组比,#P=0.01
2.2 IR肝癌细胞模型建立成功100 nmol/L胰岛素作用HepG2细胞24 h、48 h和72 h,培养上清液葡萄糖浓度分别为(9.8±0.12)mmol/L、(9.5± 0.25)mmol/L和(8.9±0.21)mmol/L,作用48 h细胞培养上清液葡萄糖浓度与作用24 h比无显著性差异(t=1.87,P=0.13),作用72 h培养上清液葡萄糖浓度较作用48 h无明显下降(t=3.18,P=0.03,图2A);1 000 nmol/L浓度胰岛素作用HepG2.2.15细胞24 h、48 h和72 h,培养上清液葡萄糖浓度分别为(9.6±0.17)mmol/L、(9.2±0.20)mmol/L和(8.8± 0.18)mmol/L,作用48 h细胞培养上清液葡萄糖浓度与作用24 h比无显著性差异(t=2.64,P=0.06),作用72 h培养上清液葡萄糖浓度较作用48 h无明显下降(t=2.57,P=0.06,图2B);100 nmol/L和1 000nmol/L胰岛素分别作用HepG2细胞和HepG2.2.15细胞48 h,细胞培养上清液葡萄糖消耗量较作用24 h无显著降低,形成胰岛素抵抗,并能维持72 h。
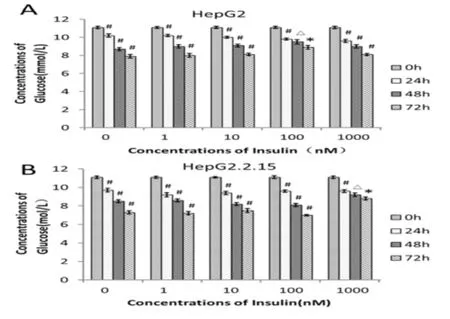
图2 不同浓度胰岛素诱导肝癌细胞葡萄糖消耗变化(A、B)与0 h组比,#P>0.05;与24 h组比,△P<0.05;与48 h组比,*P<0.05
2.3 IR肝癌细胞IsnR-β和IGF-1R表达变化与HepG2细胞和HepG2.2.15细胞比,胰岛素诱导后形成的IR-HepG2细胞和IR-HepG2.2.15细胞IsnR-β和P-IsnR-β表达下调,而IGF-1R和P-IGF-1R表达上调(图3)。

图3 IR肝癌细胞蛋白表达变化IR肝癌细胞IsnR-β蛋白表达对照组肝癌细胞下调,而IGF-1R表达上调
2.4 IR肝癌细胞P-p65、IκBα和P-gp表达变化与HepG2细胞和HepG2.2.15细胞比,IR-HepG2细胞和IR-HepG2.2.15细胞P-p65和P-gp表达上调,而IκBα表达下调;整合HBV DNA的HepG2.
2.15 和IR-HepG2.2.15细胞P-gp表达较HepG2和IR-HepG2增强(图4)。
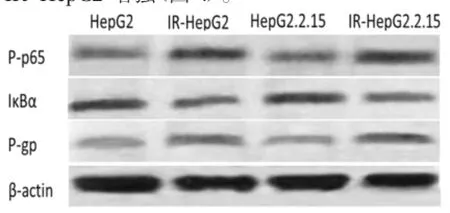
图4 IR肝癌细胞P-p65和P-gp表达的变化IR肝癌细胞P-p65和P-gp表达较对照组肝癌细胞上调,而IκBα表达下调
2.5 IR肝癌细胞耐受阿霉素诱导凋亡在25μg/ mL阿霉素作用细胞24 h后,IR-HepG2细胞凋亡率为(31.1±1.9)%,显著低于HepG2细胞的【(49.7± 2.2)%,P<0.01】;IR-HepG2.2.15细胞凋亡率为(20.1± 1.7)%,显著低于HepG2.2.15细胞组的【(33.8± 1.8)%,P<0.01】;HepG2.2.15和IR-HepG2.2.15细胞凋亡率分别较HepG2和IR-HepG2细胞显著降低(P<0.01,图5)。
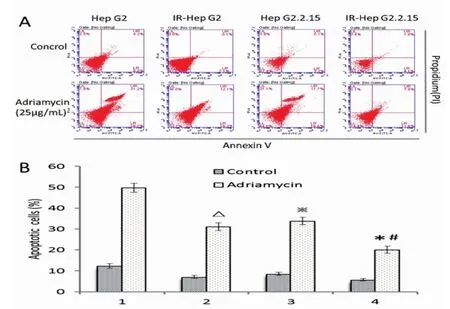
图5 肝癌细胞凋亡率的变化(A、B)经阿霉素诱导后,IR肝癌细胞凋亡率显著低于对照组肝癌细胞
3 讨论
IR是T2DM发病的主要始动因素,也是代谢综合征的中心环节和基本致病基础。T2DM与HCC发生、发展、治疗和预后密切相关[13]。IR和高胰岛素血症介导了T2DM和代谢综合征与恶性肿瘤发病之间的桥梁关系。有研究表明T2DM与许多实体恶性肿瘤密切相关,尤其是HCC[14,15]。意大利学者的一项研究表明有31.2%HCC患者患有T2DM,而正常人群T2DM患病率仅为12.7%。一项荟萃分析显示患有T2DM患者患HCC的风险是正常人的2.31倍,其中使用外源性胰岛素治疗的糖尿病患者患HCC风险是不使用胰岛素患者的4倍,而死亡风险增加1.43倍,提示胰岛素不仅参与HCC的形成,而且通过增加化疗药物的多药耐药而影响HCC患者的治疗效果。由此可见,T2DM是HCC的独立危险因素,其中高胰岛素血症可能起了重要作用[16,17]。
胰岛素、IsnR、IGF-1R和下游靶基因构成胰岛素信号轴,介导机体病理生理过程[18]。其中IGF-1R与恶性肿瘤密切相关,其在HCC表达上调,阻断IGF-1R使肝癌细胞生长受抑、诱导细胞凋亡,增加放、化疗敏感性[19,20]。本研究用高浓度胰岛素诱导肝癌细胞,在胰岛素作用肝癌细胞后24 h即能诱导肝癌细胞形成IR,并能维持72 h。经Western blot检测显示IsnR和磷酸化IsnR表达下调,抑制细胞对葡萄糖消耗,符合胰岛素抵抗特征。但作为胰岛素的另一受体IGF-1R和磷酸化IGF-1R表达却明显上调,推测其可能介导了胰岛素诱导的细胞分裂、增殖和凋亡抑制等。
MDR基因编码的细胞膜P-gp是一种ATP依赖的流出泵,一旦与抗肿瘤药物结合,通过ATP提供能量就可将药物从细胞内泵出细胞外,出现耐药现象。恶性肿瘤细胞往往高表达P-gp[21]。有研究显示胰岛素可诱导P-gp表达,其具体机制尚不明确[22,23]。NF-κB是首先在B细胞中发现的一种结合于免疫球蛋白κ轻链增强子上的核蛋白,有RelA(p65)、RelB、C-Rel、NF-κB1(p50)和NF-κB2(p52)五个亚基,亚基间可形成同源或异源二聚体,其中p50/p65二聚体最常见。NF-κB是胰岛素信号通路下游重要靶点,我们前期研究显示抑制NF-κB后HepG2细胞P-gp表达显著下调。本研究发现IR肝癌细胞NF-κB亚单位磷酸化的p-65(P-p65)和多P-gp表达较肝癌细胞显著增强;采用流式细胞仪检测经阿霉素诱导的细胞凋亡显示阿霉素诱导的IR肝癌细胞凋亡率较肝癌细胞明显减低。上述结果提示NF-κB可能介导了胰岛素诱导的肝癌细胞P-gp表达及对阿霉素的多药耐药。
HBV相关性肝癌高耐药性是HCC化疗不敏感的主要原因。本研究提示整合HBV DNA的HepG2.2.15细胞P-gp蛋白表达较HepG2细胞增高,对阿霉素有更高的耐药性,但其具体机制尚不清楚。
本研究以高浓度胰岛素诱导肝癌细胞形成IR肝癌细胞模型,研究提示NF-κB介导了胰岛素/IGF-1R诱导肝癌细胞P-gp表达及对阿霉素的多药耐药,推测HBV可能与肝癌细胞多药耐药相关,这些结果可能为肝癌的耐药逆转提供了潜在的靶点。
[1]Torre LA,Bray F,Siegel RL,et al.Global cancer statistics. 2012.CA Cancer J Clin,2015,65(2):87-108.
[2]Yang JD,Roberts LR.Hepatocellular carcinoma:A global view. Nat Rev Gastroenterol Hepatol,2010,7(8):448-458.
[3]Shikata K,Ninomiya T,Kiyohara Y.Diabetes mellitus and cancer risk:review of the epidemiological evidence.Cancer Sci,2013,104(1):9-14.
[4]Chettouh H,Lequoy M,Fartoux L,et al.Hyperinsulinaemia and insulin signalling in the pathogenesis and the clinical course of hepatocellular carcinoma.Liver Int,2015,35(10): 2203-2217.
[5]Ohta Y,Tanizawa Y.Insulin secretion and insulin resistance. Nihon Rinsho,2013,71(11):1936-1940.
[6]De Minicis S,Agostinelli L,Rychlicki C,et al.HCC development is associated to peripheral insulin resistance in a mouse model of NASH.PLoSOne,2014,9(5):e97136.
[7]Lopes-Rodrigues V,Seca H,Sousa D,et al.The network of P-glycoprotein and microRNAs interactions.Int J Cancer,2014,135(2):253-263.
[8]Shi Y,Wang SY,Yao M,et al.Chemosensitization of HepG2 cells by suppression of NF-κB/p65 gene transcription with specific-siRNA.World JGastroenterol,2015,21(45):12814-12821.
[9]姚敏,顾星,姚登福,等.肝癌患者核因子-κB异常表达及转录干预对多药耐药的逆转效果.中华医学杂志,2016,96(10): 761-766.
[10]吴玮,姚敏,王以浪,等.TNF-α/NF-κB通路干预对肝癌多药耐药相关P-gp表达的影响.南通大学学报(医学版),2013,33(1):13-17.
[11]Nawa A,Fujita-Hamabe W,Tokuyama S.Altered intestinal P-glycoprotein expression levels in a monosodium glutamate-induced obesemouse model.Life Sci,2011,89(23-24):834-838.
[12]Kobori T,Harada S,Nakamoto K,et al.Functional alterations of intestinal P-glycoprotein under diabetic conditions.Biol Pharm Bull,2013,36(9):1381-1390.
[13]Siddique A,Kowdley KV.Insulin resistance and other metabolic risk factors in the pathogenesis of hepatocellular carcinoma. Clin Liver Dis,2011,15(2):281-296.
[14]Sugimoto K,Takei Y.Clinicopathological features of non-alcoholic fatty liver disease.Hepatol Res.2011,41(10):911-920.
[15]Starley BQ,Calcagno CJ,Harrison SA.Nonalcoholic fatty liver disease and hepatocellular carcinoma:a weighty connection. Hepatology,2010,51(5):1820-1832.
[16]Wang P,Kang D,Cao W,et al.Diabetes mellitus and risk of hepatocellular carcinoma:a systematic review and meta-analysis. Diabetes Metab Res Rev,2012,28(2):109-122.
[17]Chao LT,Wu CF,Sung FY,et al.Insulin,glucose and hepatocellular carcinoma risk in male hepatitis B carriers:results from 17-year follow-up of a population-based coho rt. Carcinogenesis,2011,32(6):876-881.
[18]Burnol AF,Morzyglod L,Popineau L.Cross-talk between insulin signaling and cell proliferation pathways.Ann Endocrinol(Paris),2013,74(2):74-78.
[19]姚宁华,姚登福,董志珍,等.足叶苦素抑制胰岛素样生长因子I受体表达对肝癌细胞增殖与运动的影响.中华肝脏病杂志,2013,21(5):376-380.
[20]Yan XD,Yao M,Wang L,et al.Overexpression of insulin-like growth factor-Ireceptor as a pertinent biomarker for hepatocytes malignant transformation.World J Gastroenterol,2013,19(36): 6084-6092.
[21]Hu Y,Li C,Li H,et al.Resveratrol-mediated reversal of tumor multi-drug resistance.Curr Drug Metab,2014,15(7):703-710.
[22]Nawa A,Fujita Hamabe W,Tokuyama S.Altered intestinal P-glycoprotein expression levels in a monosodium glutamate-induced obesemousemodel.Life Sci,2011,89(23-24):834-838.
[23]Nawa A,Fujita Hamabe W,Tokuyama S.Inducible nitric oxide synthase-mediated decrease of intestinal P-glycoprotein expression under streptozotocin-induced diabetic conditions.Life Sci,2010,86(11-12):402-409.
(收稿:2016-06-20)
(本文编辑:陈从新)
Exp ression of IGF-1R/NF-kappa B and multi-d rug resistance in insulin resistance-HepG2 and HepG2. 2.15 cells in vitro
Wang Yilang,Yin Dian,Yang Li,et al.
Department of Oncology,Research Center of Clinical Medicine,First People's Hospital A ffiliated to Nantong University,Nantong,226001,Jiangsu Province,China Corresponding author:Yao Dengfu,E-mail:yaodf@ahnmc.com
Ob jective To investigate the expression of insulin-like growth factor 1 receptor(IGF-1R),nuclear factor-κB(NF-κB)and the mechanism of multi-drug resistance(MDR)in insulin resistance(IR)-hepatoma cells in vitro.Methods The human hepatoma cells(HepG2 and HepG2.2.15)were induced by high concentration of insulin to establish a insulin resistance model.The expression of insulin receptor(InsR),IGF-1R,NF kappa B,P glycoprotein(P-gp)were detected by Western bloting and the effect of adriamycin on cell apoptosis were detected by flow cytometry(annexin V-FITC).Resu lts IR model of hepatoma cells were established successfully by subjecting the HepG2 and HepG2.2.15 cells to 100 nmol/L and 1 000 n mol/L insulin respectively for 48 hours.The expression of IGF-1R,NF-kappa B and P-gp were up-regulated in IR hepatoma cells,while the InsR expression was down-regulated;After treatment of the two cells with 25μg/m l doxorubicin for 24 hours,the apoptosis rate of IR-HpeG 2 cells(31.1%±1.9%)was significantly lower than HepG2 cells[(49.7± 2.2)%,P<0.01],and the apoptosis rate of IR-HepG2.2.15 cells(20.1±1.7)%was significantly lower than HepG2.2.15 cells[(33.8±1.8)%,P<0.01];The apoptotic rates of HepG2.2.15 or IR-HepG2.2.15 cells were significantly lower than HepG2 or IR-HepG2 cells(P<0.01),respectively.Conclusion The expression of IGF-1R,NF-kappa B and P-gp are up-regulated in IR-hepatoma cells,which might induce the MDR to adriamycin.
HepG2 cells;Insulin resistance;Insulin-like growth factor I receptor;NF-kappa B;P-glycoprotein;Multi-drug resistance
10.3969/j.issn.1672-5069.2016.06.016
南通市卫生局青年医学人才科研基金项目(编号:WQ2014005)
226001江苏省南通市第一人民医院肿瘤科(王以浪,印滇,杨莉,张亮);南通大学附属医院临床研究中心(姚登福)
王以浪,男,34岁,医学硕士,主治医师。从事肿瘤学基础及临床研究。E-mail:oncowang@163.com
姚登福,E-mail:yaodf@ahnmc.com

