有关ΔH计算的归类解析与备考指导
江苏 李宗来
有关ΔH计算的归类解析与备考指导
江苏 李宗来
化学反应与能量是每年高考的必考内容,其中反应热ΔH(焓变)的计算是近几年高考的高频考点,本文就2015年高考中出现的有关热化学方程式中ΔH的计算及最新考纲进行归类解析,并在此基础上提出一些解题的方法与指导,以期在备战2016年的高考时使我们的复习更有针对性。
题型一:物质的量n与热化学方程式中的ΔH相互换算
【例1】(2015安徽,节选)NaBH4(s)与水(l)反应生成NaBO2(s)和氢气(g),在25℃,101kPa下,已知每消耗3.8g NaBH4(s)放热21.6kJ,该反应的热化学方程式是________________。
【解析】根据题意可得n(NaBH4)=3.8g÷38g/mol=0.1mol,所以消耗1mol NaBH4(s)放热为21.6kJ×10=216kJ,即ΔH=-216kJ/mol。
【答案】NaBH4(s)+2H2O(l)NaBO2(s)+4H2(g)ΔH=-216kJ/mol
【变式练习】
(2015海南)已知丙烷的燃烧热ΔH=-2 215kJ/mol,若一定量的丙烷完全燃烧后生成1.8g水,则放出的热量约为( )
A.55kJ B.220kJ
C.550kJ D.1 108kJ
【解析】表示丙烷的燃烧热化学方程式为C3H8(g)+7/2O2(g3CO2(g)+4H2O(l) ΔH=-2 215kJ/mol,生成4mol H2O(l)放出2 215kJ热量,则生成1.8g÷ 18g/mol=0.1mol H2O(l),则消耗丙烷的物质的量为0.025mol,所以反应放出的热量是Q=0.025mol× 2 215kJ/mol=55.375kJ。
【答案】A
【备考指导】热化学方程式中各物质的化学计量系数只表示物质的量,可以是简单分数或小数,方程式书写不同,ΔH不同,ΔH与系数(各物质的n)等比例的增加或减少。因此首先要将题干信息中的质量m、微粒个数N、标准状况下的气体体积V、溶液中溶质的物质的量浓度cB与物质的量n进行相互转化,再根据n与ΔH比例关系从而解答相关计算。另外注意书写热化学方程式时要标注各物质的聚集状态。
题型二:由能量变化图来计算热化学方程式的ΔH
【例2】(2015海南,节选)由N2O和NO反应生成N2和NO2的能量变化如图所示,若生成1mol N2,其ΔH=________kJ/mol。


【答案】-139
【变式练习】
(2015广东,节选)用O2将HCl转化为Cl2,可提高效益,减少污染,传统上该转化通过如下图所示的催化剂循环实现。
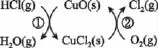
【解析】根据图象信息,由物质转化箭头指向可写出反应②的热化学方程式:CuCl2(g)+1/2O2(gCuO(s)+Cl2(g)
ΔH2;由盖斯定律可知,①+②可得总反应:2HCl(g)+1/2O2(gH2O(g)+Cl2(g) ΔH=ΔH1+ΔH2。
【答案】2HCl(g)+1/2O2(g)H2O(g)+Cl2(g)ΔH=ΔH1+ΔH2。
【备考指导】对于能量变化图首先要读懂图意,图象中往往将一个反应分成几步进行,经历不同的反应途径,最终得到目标产物。因能量变化只与始态、终态有关,与变化路径无关,计算反应的ΔH时,要关注化学反应始态(反应物的总能量)与终态(生成物的总能量)位置关系,从而确定吸放热及ΔH的大小;对于循环转化关系图中物质的箭头既可以表示加入(反应物)也可表示产出(生成物),首先以某物质为起点,顺着箭头的方向,理顺物质间的转化关系与过程,再按题目要求写出某一步反应的热化学方程式。
题型三:由盖斯定律来计算热化学方程式中的ΔH
【例3】(2015重庆)黑火药是中国古代的四大发明之一,其爆炸的热化学方程式为S(s)+2KNO3(s)+3C(sK2S(s)+N2(g)+3CO2(g) ΔH=xkJ/mol④,已知碳的燃烧热为ΔH1=akJ/mol,S(s)+2K(s)K2S(s) ΔH2=bkJ/mol ②,2K(s)+N2(g)+3O2(g2KNO3(s) ΔH3=ckJ/mol ③,则x为( )
A.3a+b-cB.c+3a-b
C.a+b-cD.c+a-b
【解析】已知碳的燃烧热ΔH1=akJ/mol,则燃烧热化学方程式为C(s)+O2(gCO2(g) ΔH2=akJ/mol①,根据盖斯定律可得目标热化学方程式④=3①+②-③,所以ΔH=3ΔH1+ΔH2-ΔH3=3a+b-c。
【答案】A
【备考指导】运用盖斯定律来计算热化学方程式中的ΔH时,第一步应该观察,找出反应物和目标产物以及中间产物;第二步通过热化学方程式的四则运算消除中间产物,同时要掌握运用对相关联的热化学方程式处理技巧:①改变热化学方程式系数等比例的改变ΔH,颠倒反应物与生成物的顺序,ΔH正负改变,数值不变;②热化学方程式相加减,ΔH随之相加减。
题型四:由键能来计算热化学方程式中的ΔH
【例4】(2015浙江,节选)乙苯催化脱氢制苯乙烯反应:
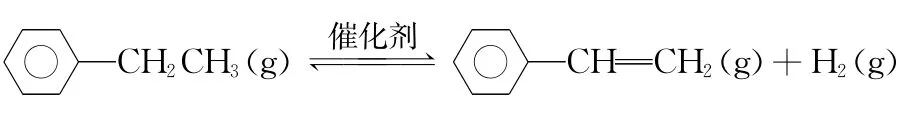
已知:

化学键C—H C—C C C H—H键能(kJ/mol)412 348 612 436
计算上述反应的ΔH=______kJ/mol。
【解析】反应物断开2mol C—H键和1mol C—C键,共吸收能量为412kJ/mol×2+348kJ/mol=1 172kJ/mol;生成物形成1mol CC键和1mol H—H键,共放出能量为612kJ/mol+436kJ/mol=1 048kJ/mol;ΔH=1 172kJ/mol-1 048kJ/mol=124kJ/mol。
【答案】124
【备考指导】化学反应的本质是旧键的断裂和新键的形成,反应过程中有能量变化其本质原因是断键吸收的能量与成键所释放的能量不等,当不考虑其他能量转化的前提下,可根据吸收和释放的能量的相对大小来计算反应的焓变ΔH,ΔH=断键吸收的总能量—成键所放出的总能量,同时注意物态变化过程中的能量变化:物质由固体(s)→液态(l)→气态(g)吸收能量,反之释放能量。
题型五:由热化学方程式中的ΔH来计算键能
【解析】由题意可得,生成1mol H2(g)、1mol I2(g)分子形成化学键时分别需要释放436kJ、151kJ的能量,设1mol HI(g)分子化学键断裂时需吸收的能量为akJ,则ΔH=断键吸收的总能量—成键所放出的总能量=2a-(436+151)=+11,所以a=299kJ。
【答案】299
【变式练习】
(2015山东,节选)F2与其他卤素单质反应可以形成卤素互化物,例如ClF3、BrF3等。已知反应Cl2(g)+3F2(g)2ClF3(g) ΔH=-313kJ/mol,F—F键的键能为159kJ/mol,Cl—Cl键的键能为242kJ/mol,则ClF3中Cl—F键的平均键能为______kJ/mol。
【解析】根据焓变的含义可得,242kJ/mol+3× 159kJ/mol-6×ECl—F=-313kJ/mol,解得Cl—F键的平均键能ECl—F=172kJ/mol。
【答案】172
【备考指导】根据热化学方程式中的ΔH来计算键能,首先要弄清反应方程式中各物质所含的键的类型、键能及键的个数,计算时同时要注意各物质前的化学计量数。再根据ΔH=断键吸收的总能量-成键所放出的总能量,求出某价键在断裂时所吸收的能量或成键时所释放的能量即键能的大小。
综上所述,在高考中解答有关反应热ΔH的计算,只要我们熟悉常见的考查角度,读懂题干信息,理顺数量关系,计算时要细致、谨慎并运用相关的方法与技巧,答题的准确率定会大幅度地提升。
(作者单位:江苏省响水中学)

