知己知彼 百战不殆
——重视“核心”考点,确保复习效益
河北 颜建河
知己知彼 百战不殆
——重视“核心”考点,确保复习效益
河北 颜建河
在高考复习的各个阶段中,特别是后期复习,我们绝不能掉以轻心,要高度重视化学考纲中的一些“核心”考点的再复习,认认真真地梳理好这些知识。同时,要努力做到时时翻阅、时时补充,学会灵活运用。这样才能确保高考复习的效益和质量,高考中做到战无不胜,取得最好成绩。本文扼要将《考纲·说明》中的一些“核心”考点进行诊治和再梳理,以期能对学生的后期复习有所启示。
考点之一:离子方程式问题
【考向分析】《考纲·说明》明确要求“能正确书写化学方程式和离子方程式,并能进行有关计算”。离子方程式的书写及正误判断,是历年高考的热点题型之一。试题以选择题和填空题的方式进行命制,着力考查元素及化合物相关知识,经常涉及复分解反应、水解反应、氧化还原反应(包括电极反应),等等。理解离子反应及氧化还原的实质,才能做到掌握方法,学以致用,迅速、准确地解决问题。
【例1】(2013全国)能正确表示下列反应的离子方程式是( )

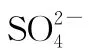

【答案】A
【考点指津】迅速、准确判断离子方程式书写的正误,其切入点为“五查”“三看”,深刻牢记,才能做到心中有数,防患于未然。
“五查”:一查化学符号书写是否正确(原则是强酸、强碱和可溶性盐用离子符号表示,其余均以原来的化学式表示)。二查等号、可逆号、箭头等是否正确。通常有沉淀、气体、弱电解质生成的离子反应才会发生。反应物和生成物之间用“”连接,生成物是沉淀、气体的标“↓”“↑”符号。例如,在盐的水解反应中除①Al2S3溶于水[2Al3++3S2-+6H2O2Al(OH)3↓+3H2S↑]、②将FeCl3溶液逐滴加入沸水中得Fe(OH)3胶体(胶体)+3H+]、③互促水解反应的离子方程式用“”连接、生成物沉淀用“↓”、气体用“↑”外,一般盐类的水解程度小,其离子方程式用”连接,且不能形成沉淀、放出气体。对涉及有机物参加的离子反应,其离子方程式用“→”而不用”连接。三查两守恒,即质量守恒(微粒种类相同)和电荷守恒(方程式两边电荷总数相等)。四查得失电子数是否相等。五查微粒比例(符合化学式配比)是否正确。

考点之二:阿伏加德罗常数问题
【考向分析】《考纲·说明》明确要求“了解物质的量的单位——摩尔(mol)、摩尔质量、气体摩尔体积、物质的量浓度、阿伏加德罗常数的含义”。结合阿伏加德罗常数判断一定量的物质所含有的某种粒子数目的多少,是历年来高考的热点题型之一,所涉及的知识非常丰富,试题以选择题和填空题的方式来进行命制,着力考查物质的量与微粒(原子、分子、离子等)数目、气体体积(标准状况下)之间的相互关系,等等。正确理解概念,掌握以物质的量为中心的计算,才能做到迅速、准确地解决问题。
【例2】(2015新课标Ⅱ)NA代表阿伏加德罗常数的值。下列叙述正确的是( )
A.60g丙醇中存在的共价键总数为10 NA
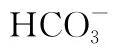
C.钠在空气中燃烧可生成多种氧化物。23g钠充分燃烧时转移电子数为1 NA

【答案】C
【考点指津】阿伏加德罗常数(NA)是历年高考的热点,经久不衰,常常在考题中有意设置一些极易疏忽的干扰因素。为此,在分析解答这类问题时,要特别注意以下几点:
1.只有气体的体积受外界条件(温度、压强等)的影响,而质量、物质的量不受温度、压强的影响。例如,常温常压下,32g O2所含的氧气分子数为NA,其说法是正确的。另外,要特别注意用22.4L·mol-1计算时必须满足两个条件:“标准状况”和“气态”。
2.要熟悉常见物质的聚集状态。考查气体摩尔体积时,常用在标准状况下的非气态物质来迷惑考生。例如,H2O在标准状况下是固液混合态;SO3在标准状况下是固态;CH2Cl2、CHCl3、CCl4及碳原子数大于4的烃等在标准状况下均为非气态,等等。
3.要防止误入“水解陷阱”,忘记考虑水解因素而致错。对于溶液中的离子,考查电解质溶液中粒子数目或浓度时常常设置弱电解质的电离和盐类水解方面的陷阱。对于胶体中的粒子数的考查,要注意胶体粒子是由多个微粒组合而成。
4.要注意等质量的同素异形体、同分异构体、最简式相同的物质中所含的原子数目一定相同。
5.要熟悉一些常见物质晶体结构中的化学键数目。1mol金刚石中含有2mol C—C共价键、1mol石墨中含有1.5mol C—C共价键、1mol晶体硅中含2mol Si—Si共价键、1mol SiO2中含有4mol Si—O共价键等。
6.要注意某些物质或者几种物质的混合物可能发生反应的情况。例如,常温常压下,由于NO2与N2O4间存在着化学平衡,则46g NO2气体中含有的分子数应小于NA。
7.要重视特殊的氧化还原反应中,转移电子数目的计算。例如,Na2O2+H2O,H2S+SO2,等等。
8.要重视物质的量与各量之间的关系及使用范围。例如,n=m/M、n=N/NA、n=V/Vm、n=C·V。
9.要认真审题。审题过程中要注意题目概念的层次,要特别注意试题中一些关键性的字、词,要边阅读边思考,谨防题设“陷阱”。同时,对常见的一些设陷方式要千万警惕,在认真审题的基础上利用自己掌握的概念仔细分析、认真比较,做出正确判断。
考点之三:弱电解质平衡问题
【考向分析】《考纲·说明》明确要求“了解弱电解质在水溶液中的电离平衡。了解盐类水解的原理、影响盐类水解程度的主要因素、盐类水解的应用”。弱电解质的电离及盐类水解平衡,是近年高考的新热点题型之一,所涉及的知识面较多且广,试题以选择题和填空题的方式来进行命制,着力考查运用弱电解质的电离、盐类的水解、电荷守恒、物料守恒等知识来分析和解决与化学实验、化工生产相结合问题。正确理解概念,揭示规律,结合图表数据进行分析判断,才能迅速、准确地解决问题。
【例3】(2013安徽)已知NaHSO3溶液显酸性,溶液中存在以下平衡:
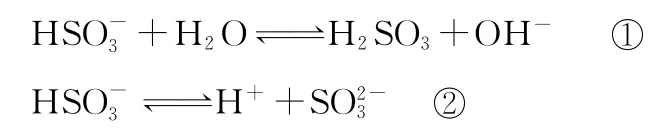
向0.1mol·L-1的NaHSO3溶液中分别加入以下物质,下列有关说法正确的是( )
A.加入少量金属Na,平衡①左移,平衡②右移,溶液中c(HSO3-)增大

【分析与解答】依据题给水解和电离反应式可知,NaHSO3溶液显酸性,说明HSO的电离程度大于其水解。A选项,加入的Na与水反应生成NaOH,与HSO反应,故减小,错误;B选项,该溶液中存在电荷守恒,故前的系数为2,错误;C选项,加入少量NaOH,增大,减小,c(OH-)增大,c(H+)减小,正确;D选项,错误。
【答案】C
【考点指津】这类问题涉及弱电解质的电离平衡移动方向,其解答问题的切入点就是利用化学平衡等相关知识进行解答。
1.改变温度:升高温度平衡向右移动,降低温度平衡向左移动。


若把英语例句中的主谓语结构不加以转换,直译成“1919年的五四运动目睹了新红学的开端……”,就会造成译文不太符合汉语中“以人为主”的思维,显得佶屈聱牙,因此这里在翻译时对英语原文进行了一些处理,将该句中的主谓语结构转换成了汉语中的状语,使得译文更加切合汉语思维,如此,中国读者读起来便不会觉得拗口了。

考点之四:氧化还原反应问题
【考向分析】《考纲·说明》明确要求“了解氧化还原反应的本质是电子的转移。了解常见的氧化还原反应。掌握常见氧化还原反应的配平和相关计算”。氧化还原反应问题贯穿于高中化学的全过程,是历年高考的热点题型之一。所涉及的知识面广,试题以选择题和填空题的方式进行命制,着力考查以生产生活、科技成果为背景材料渗透氧化还原反应的基本概念、电子转移分析和判断,结合工艺和化学实验,设置有关氧化还反应的核心计算,并侧重电子转移守恒的灵活运用,等等。把握概念,揭示规律,才能做到迅速、准确地解决问题。
A.消耗硫酸亚铁铵的物质量为n(2-x)mol
C.反应中发生转移的电子数为3nx mol
D.在FeO·FeyCrxO3中3x=y

【答案】A
1.强弱规律
在一个氧化还原反应中,各物质(微粒)的氧化性、还原性强弱分别为:

根据这个规律,可以帮助我们判断出氧化还原反应中各物质(微粒)的氧化性或还原性的相对强弱;帮助我们选择合适的氧化剂或还原剂;帮助我们判断一个氧化还原反应能否发生。
2.价态变化规律
(1)中间变两头——歧化反应。例如:
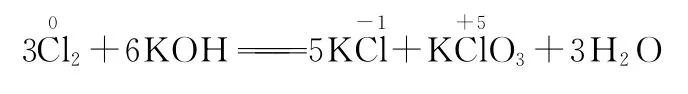
(2)两头变中间——归中反应(不同价态的同种元素之间的反应)。例如:

说明:当氧化剂为强的氧化剂或者氧化剂过量时,还原剂可转化成比其邻位价态更高的产物(但不可出现交叉现象);反之亦然。例如:

根据这个规律,可以准确判断氧化还原反应中的氧化产物和还原产物,标明电子转移的关系。
3.次序规律
在氧化还原反应中,一种氧化剂(或还原剂)与多种还原剂(或氧化剂)相遇时,总是依据还原性(或氧化性)强弱顺序先后被氧化(或被还原)。
根据这个规律,可判断氧化还原反应发生的先后次序,写出对应的正确的化学方程式。例如,把Cl2通入FeBr2溶液中,Cl2的强氧化性可将Fe2+、Br-氧化;由于还原性Fe2+>Br-,所以,当通入少量Cl2时,Cl2首先将Fe2+氧化;当Cl2足量时,方可把Fe2+、Br-一并氧化。
4.守恒规律
在一个氧化还原反应中,氧化剂得到电子的数目等于还原剂失去电子的数目。
根据这个规律,可以进行氧化反应方程式的配平以及涉及氧化还原反应的各种计算。
考点之五:可逆电池问题
【考向分析】《考纲·说明》明确要求“了解原电池和电解池的工作原理,能写出电极反应和电池反应方程式。了解常见化学电源的种类及其工作原理。理解金属发生电化学腐蚀的原因,金属腐蚀的危害,防止金属腐蚀的措施”。电化学是历年高考的热点内容之一,所涉及的知识面广,试题以选择题和填空题的方式来进行命制,着力考查以生产生活、科技成果为背景材料渗透电池、电解原理,电极反应的书写,电子转移、两极产物、pH等相关计算,金属腐蚀及防护方法,特别是结合工艺和化学实验,设置有关可逆电池的问题,等等。把握概念、揭示本质,才能做到吸收信息、迁移运用,解决问题。
【例5】(2011新课标)铁镍蓄电池又称爱迪生电池,放电时的总反应为Fe+Ni2O3+3H2OFe(OH)2+2Ni(OH)2,下列有关该电池的说法不正确的是( )
A.电池的电解液为碱性溶液,正极为Ni2O3、负极为Fe
C.电池充电过程中,阴极附近溶液的pH降低
【分析与解答】本题是一道涉及电池方面的信息迁移题,题目中给出了铅蓄电池的总反应式,并据此来回答题中的相关问题,有一定难度。为此,要解决好这类问题,必须明确两点:一是蓄电池的放电起了什么作用呢?(回答:原电池);二是蓄电池的充电起了什么作用呢?(回答:电解池)。而后,再依据电子转移的方向来进行切入,就能由题中给出的可逆电池总反应来确定出原电池的正、负极和电解池的阴、阳极。其关系如下:

同时,从上述电子转移情况及电池相关知识,即可迅速写出原电池和电解池的反应式。



【答案】C
【考点指津】可逆电池的考题属于原电池与电解池原理的综合运用,要正确解答此类试题,其关键就是必须认真阅读试题题干,理解题示信息,切实把握好以下几点:
1.可充电电池分为放电和充电两过程。放电是原电池反应,其相关知识可依据原电池原理进行分析;充电是电解池反应,其相关知识可依据电解原理进行分析。
2.判断电池放电时的电极极性和材料,可先标出放电(原电池)总反应式电子转移的方向和数目,失去电子的一极为负极,该物质即为负极材料;得到电子的一极为正极,该物质可为正极材料。判断电池充电时的电极极性和材料,方法同前,失去电子的一极为阳极,该物质即为阳极材料;得到电子的一极为阴极,该物质即为阴极材料。
3.书写可充电电池电极反应时,一般都是先书写放电的电极反应式。①先标出原电池总反应式电子转移的方向和数目,指出参与负极和正极反应的物质;②写出一个比较容易书写的电极反应式(要注意电极产物是否与电解质溶液共存);③要在遵循电子守恒的基础上,用总反应式减去写出的电极反应式即得另一电极反应式。对于充电的电极反应来说,则其书写方法与放电的电极反应过程相反,即充电的阳极反应为放电正极反应的逆过程,充电的阴极反应为放电负极反应的逆过程。
4.判断可充电电池的氧化还原过程,可根据电极反应式进行分析,放电(原电池)的负极及充电(电解池)的阳极均失去电子,其变价元素被氧化,放电(原电池)的正极及充电(电解池)的阴极均得到电子,其变价元素被还原,发生了还原反应。
5.溶液中阴、阳离子移动方向的判断。①放电时阳离子移向正极,阴离子移向负极;②充电时阳离子移向阴极(-),阴离子移向阳极(+)。
6.可充电电池充电时与电源的连接关系:原电池的负极与外电源的负极相连,原电池的正极与外电源的正极相连。
总之,重视“核心”考点,揭示“真题”规律,做到回归教材,立足基础,着力打造知识体系的建构和运用,才是高考取得好成绩的制胜法宝。
(作者单位:河北省衡水市故城县教育局教研室)

