Cr对V2.1TiNi0.3贮氢合金结构和电化学性能的影响
宋茂成 张荣华 雪峰 赵朝勇 崔旭梅 刘甜甜 同艳维 庞立娟 邓刚
(1西华大学材料科学与工程学院,成都610039)
(2攀枝花学院材料工程学院,攀枝花617000)
(3攀枝花学院生物与化学工程学院,攀枝花617000)
Cr对V2.1TiNi0.3贮氢合金结构和电化学性能的影响
宋茂成1,2张荣华1,2雪峰*,2赵朝勇2崔旭梅2刘甜甜1,2同艳维3庞立娟2邓刚2
(1西华大学材料科学与工程学院,成都610039)
(2攀枝花学院材料工程学院,攀枝花617000)
(3攀枝花学院生物与化学工程学院,攀枝花617000)
研究了Cr添加量对V2.1TiNi0.3Crx(x=0,0.2,0.4,0.6)贮氢合金的结构和电化学性能的影响。结果表明,所有合金均由V基固溶体主相和TiNi基第二相组成,且第二相呈网状分布在晶界上,部分呈颗粒状分布于合金主相之中。随着Cr含量增大,合金主相的晶胞体积与合金电极的最大放电容量逐渐减小,而循环稳定性逐渐增加,同时合金电极的动力学性能得到改善。在合金中添加Cr使合金电极的活化性能变差,但添加量的进一步增多对其活化性能影响不大。综合考虑,V2.1TiNi0.3Cr0.4合金的电化学性能最好,最大放电容量可达442.20 mAh·g-1,20次充放电循环后容量保持率达81.91%。
钒基贮氢合金;镍氢电池;Cr添加;显微结构;电化学性能
0 引言
镍氢(Ni-MH)电池是一种环境友好型且具有优良电化学及安全性能的高能绿色二次储能电池,其性能的优异性主要取决于负极贮氢合金材料。迄今为止,研究人员已开发出稀土系、镁系、钒基固溶体系等贮氢合金,其中,只有钒基固溶体贮氢合金在室温下能可逆吸放氢且具有贮氢量大、氢扩散速率快等优点,被认为是最有前途的贮氢材料之一[1-4]。
钒基固溶体贮氢合金主要有V-Ti,V-Ti-Fe,VTi-Cr,V-Ti-Mn,V-Ti-Cr,V-Ti-Co及V-Ti-Ni体系,其贮氢容量是传统稀土贮氢合金的3倍左右,吸氢生成VH(bct)和VH2(fcc)两种氢化物,充放电理论容量高达1 018 mAh·g-1,是高能绿色MH-Ni电池负极材料的绝佳选择[5-7]。然而,初期的钒基固溶体合金还不能用作电极材料,直到1995年,Tsukahara等[8]在V3Ti合金中添加Ni制备出V3TiNix(0≤x≤0.75)贮氢合金,改善了合金在碱液中的电催化活性,钒基固溶体贮氢合金电极才开始得到广泛研究。Iwakura等[9-10]的研究表明,在放电电流密度为25 mA·g-1时,V2.1TiNi0.3储氢合金的放电容量达468~540 mAh·g-1,是目前放电容量最大的V-Ti-Ni系贮氢合金,但该合金的充放电循环稳定性及动力学性能较差。据报道,在贮氢合金中引入Cr元素能有效提其高循环稳定性及高倍率放电性能[11-12]。贾彦敏等[13]在V2.1TiNi0.4Zr0.06Cu0.03合金中添加Cr明显提高了合金电极的循环寿命和动力学性能。Hiroshi Inoue等[14]采用Cr部分替代V2.1TiNi0.3中的V,发现随Cr含量增加,合金的循环稳定性和高倍率放电性能大幅度提高。目前,尚未见添加Cr对V2.1TiNi0.3贮氢合金性能和结构影响的报道。因此,本文在该合金基础之上,系统研究了Cr添加量对V2.1TiNi0.3Crx(x=0,0.2,0.4,0.6)贮氢合金结构和电化学性能的影响。
1 实验部分
实验用纯度均大于99.9%的V、Ti、Ni、Cr作为原料,合金在非自耗真空电弧炉中以氩气为保护气氛熔炼而成。将熔炼后的一份铸态合金经抛光、腐蚀后,用DMM-440C型金相显微镜观察、拍摄合金的金相组织,用带能谱的扫描电镜(SEM,TESCAN VEGAⅡXMH型)对合金做形貌观察和成分分析,采用型号为DX-2700的X射线衍射仪对合金的相结构进行分析。
另一份合金去掉氧化表面后放入氢化装置的反应器中,检漏之后,室温下抽真空10 min,首先将反应器加热至500℃,并且保温10 min;其次向反应器中通入2.5 MPa的氢气并保温30 min,然后放掉装置中的氢,再抽10 min真空,如此反复氢化4次,最后一次结束时,将其抽真空至室温,取出样品将合金研磨成粉过200目筛子,最终制得氢化合金粉。按1∶4(质量比)的比例称取合金粉与羟基镍粉并混合均匀,然后在泡沫镍上以12 MPa压力冷压成直径为10 mm的圆柱型电极片,以此为研究电极。
合金电极的电化学性能均在三电极体系中进行测试,以合金电极作负极,烧结式Ni(OH)2/NiOOH片作正极,用隔膜将两者隔开,Hg/HgO用作参比电极,所用电解液浓度为7 mol·L-1的KOH溶液。测试温度设定303 K,测试仪器为LANHE蓝电电池测试系统。进行充放电性能测试时,充电电流密度为100 mA·g-1,充电时间为320 min,静置5 min后,以60 mA·g-1的放电电流密度进行恒流放电,其截止电压为0.6 V;进行高倍率放电测试时,以100 mA·g-1充电320 min,待合金电极完全活化后,再分别以60、100、200、400、600 mA·g-1的放电电流密度放电,截止电压均为0.6 V,最后均再以60 mA·g-1放电至0.6 V;进行极化曲线测试时,待合金电极完全活化后,将其放电到放电深度(DOD)为50%,之后在CHI600E型电化学工作站上进行线性扫描以测试合金电极的线性极化曲线,扫描速率为1 mV·s-1,扫描范围是-0.5~+0.5 mV;进行恒电位阶跃放电时,以相同电流密度充放电使电极完全活后再以100 mA·g-1充电480 min使合金电极满充后,静置一段时间,再对其施加+500 mV的阶跃电压以做恒电位放电测试,其放电时间设为60 min。
2 结果与讨论
2.1 V2.1TiNi0.3Crx(x=0~0.6)合金的结构
图1为铸态块体V2.1TiNi0.3Crx(x=0~0.6)合金的X射线衍射图。从图1可知,所得合金均由体心立方结构(bcc)的V基固溶体主相及TiNi基第二相组成。其中,随合金中Cr含量量的增加,具有bcc的V基固溶体主相的衍射峰向高角度方向逐渐偏移。V基固溶体主相的晶胞参数及体积经计算后的结果如表1所示。从表中可看出,随着x值的增大,V基固溶体主相的晶胞参数及晶胞体积均逐渐减小,这可能是因为Cr的原子半径(0.127 nm)比V(0.135 nm)和Ti(0.145 nm)的原子半径小,Cr原子以取代的形式进入合金固溶体中[15]。

图1 V2.1TiNi0.3Crx(x=0~0.6)合金的XRD图Fig.1XRD patterns of the V2.1TiNi0.3Crx(x=0~0.6)alloys

表1 V2.1TiNi0.3Crx(x=0~0.6)合金中主相的晶胞参数和晶胞体积Table 1Cell parameters and volumes of the main phase in the V2.1TiNi0.3Crx(x=0~0.6)alloys

图3 V2.1TiNi0.3Cr0.4合金的扫描电镜及能谱图Fig.3SEM image and energy dispersive spectrometry spectra of V2.1TiNi0.3Cr0.4alloy
V2.1TiNi0.3Crx(x=0~0.6)合金的金相显微组织如图2所示。图3为V2.1TiNi0.3Cr0.4合金中不同区域的能谱分析图,其中图3(a)中的A、B和C分别表示V2.1TiNi0.3Cr0.4合金中晶内、晶界、晶内颗粒物的能谱区域,图3(b)、图3(c)和图3(d)分别对应图3(a)中A、B和C区域的能谱分析结果。由图2可知,随着合金中Cr添加量的增加,合金的晶粒逐渐得到细化,TiNi基第二相含量逐渐增多。根据图3(b)可知:合金晶内组织V含量最高,重量百分含量为62.95%,其它各元素含量只有37.05%,故而合金主相为V基固溶体,其中晶内Cr元素的含量占12.41%。从图3 (c)可知:晶界上Ti、Ni含量共占86.28%,Ti、Ni含量比近似为1∶1。因此,晶界组织为NiTi基第二相,其中晶界处的Cr含量仅为2.41%。由以上能谱分析可知,Cr元素主要分布在固溶体主相中,晶界附近有少量Cr分布。另外,晶内的第二相中也含有少量的Cr,见图3(d)。根据图1、图2和图3,再结合文献[14,16]可以判定该组合金主要由呈树枝晶结构的V基固溶体主相(图2中浅灰色)和以三维网状结构分布在主相晶界上及分布于固溶体主相中呈颗粒状的TiNi基第二相(图2中深灰色)组成。其中,Ti和Ni主要存在于第二相中,Cr主要分布在主相固溶体主相之中,在主相晶界附近也有少许Cr原子。
2.2 V2.1TiNi0.3Crx(x=0~0.6)合金的活化性能、最大放电容量及循环稳定性
图4是V2.1TiNi0.3Crx(x=0~0.6)合金电极的活化及循环稳定性曲线图,表2列出了所测合金电极的电化学性能参数,其中Cmax为最大放电容量、C20为循环第20次时的容量及C20/Cmax为容量保持率。从图4和表2可以得知:
Cr的添加明显降低了合金电极的活化性能及首次放电容量。较之对照组(x=0),添加Cr后的合金电极在6次循环后(x=0.4时,合金电极在5循环后)达到最大放电容量,而合金的首次放电容量由266.80 mAh·g-1降低到165~170 mAh·g-1,表明Cr添加使合金电极的活化性能及首次放电性能变差。其主要原因可能是在充放电过程中合金电极表面形成Cr的氧化膜,致使合金电极中的TiNi基第二相的催化作用降低,最终使合金电极在电解液中的活化及放电性能变差[17]。
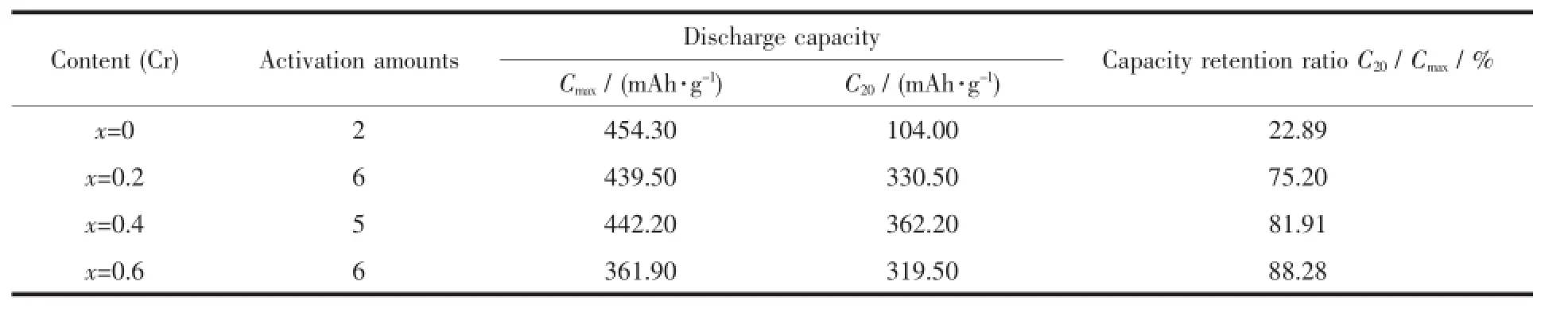
表2 V2.1TiNi0.3Crx(x=0~0.6)合金电极的活化次数、放电容量及循环稳定性Table 2Activation amounts,discharge capacity and cycle stability of V2.1TiNi0.3Crx(x=0~0.6)alloy electrodes

图4 V2.1TiNi0.3Crx(x=0~0.6)合金电极的循环稳定性曲线Fig.4Cycle stability curves of V2.1TiNi0.3Crx(x=0~0.6) alloy electrodes
合金电极的最大放电容量随Cr添加量的增多呈减小的趋势。当Cr添加量x≤0.4时,合金电极的最大放电容量轻微降低,由x=0时的454.30 mAh· g-1降到x=0.4时的442.20 mAh·g-1。当Cr添加量进一步增加时,合金电极的最大放电容量降低到361.90 mAh·g-1。出现这种趋势一方面是由于Cr的原子半径比V和Ti的原子半径小,Cr含量的增加致使V基固溶体相的晶胞体积减小,从而其内部压力增大,氢原子难以被吸收,故而合金的放电容量减小[15];另一方面是因为Cr主要存在于固溶体主相中,Cr的加入使合金中具有吸放氢性能的主相含量减少。
Cr的添加显著提高了合金电极的循环稳定性。从图4可以看出合金电极活化后其放电容量均随充放电循环次数的增加逐渐降低,这主要是因为在充放电循环过程中主要吸氢元素V逐渐溶解于电解液中,同时在电极表面形成一层氧化膜,致使合金的电化学活性降低及活性物质颗粒间的接触电阻增大[18-20]。对照组合金电极经20次充放电的容量保持率仅为22.89%;当添加Cr时,合金电极的容量保持率显著提高,并随Cr添加量的增加而增加,在Cr含量达到0.4时,合金的容量保持率增加到81.91%;当x=0.6时,其容量保持率达到最大(88.28%)。向合金中添加Cr可有效地提高其循环稳定性,这主要是因为在添加Cr元素之后,合金电极在充放电过程中其表面会形成较致密的Cr2O3钝化膜,这种膜会有效的阻止合金电极内部元素被电解液腐蚀[14,21]。
综合分析可知,尽管在V2.1TiNi0.3合金电极中添加Cr降低了合金电极的活化性能,同时也在一定程度上降低了合金电极的最大放电容量,但是Cr的添加显著提高了合金电极的循环稳定性。
2.3 合金电极的放电性能
据报道,合金的压力-组分-温度(PCT)曲线同合金电极的放电电压曲线有着极其类似的变化规律,其放电曲线平台越平坦,合金电极的放电性能与循环稳定性越好[22]。图5为V2.1TiNi0.3Crx(x=0~0.6)合金电极在303 K、放电电流密度为60 mA·g-1的放电曲线。由图可知,合金电极在放电开始到结束之时,电极电势逐渐降低,这是由于合金电极在充电过程中吸收的氢不断被氧化所致[23]。同样可得知,随着Cr含量的增加,合金电极的放电平台逐渐升高,宽度先增加后减小,平台斜率减小。通常认为,合金电极的放电电压与电解液的浓度、电极内部电阻及电极的表面活性相关,而在放电电流密度不大的情况下,合金电极的放电电压则主要是由电极表面的活性来决定的[24-25]。这说明适量的Cr添加可以降低合金电极的内部电阻,从而提高合金电极的动力学性能及电化学寿命。

图5 V2.1TiNi0.3Crx(x=0~0.6)合金电极的放电性能曲线Fig.5Discharge property curves of V2.1TiNi0.3Crx(x=0~0.6)alloy electrodes
文献[26]报道,添加适量的Ti到合金中可降低其氢平衡压,保持合金的贮氢量几乎不变,这可能是因为Ti的引入提高了合金氢化物VH2的稳定性能,而添加Cr元素后,会使合金放电的平台压升高,而使其放电平台斜率变小。因此可知,合金电极的放电平台压、循环稳定性及放电性能与Ti、Cr含量都存在一定的关系,在本研究中V2.1TiNi0.3Cr0.4合金电极表现出最好的放电性能。
2.4 合金的动力学性能
在电池性能测试中,表征合金电极实际应用价值的是高倍率放电性能(HRD),它直接用于衡量Ni-MH电池的大电流放电能力[27]。在同等大小放电电流密度下,合金电极HRD值越大,说明合金电极的充放电动力学性能越好。合金电极的高倍率放电性能通过下式得到[28]:


图6 V2.1TiNi0.3Crx(x=0~0.6)合金电极高倍率放电性能曲线Fig.6High-rate dischargeability curves of V2.1TiNi0.3Crx(x=0~0.6)alloy electrodes
上式中,Cd为放电电流为Id时合金电极的放电容量(mAh·g-1),C60是以大电流放电后,再以小电流I=60 mA·g-1放电时所得合金电极剩余放电容量(mAh· g-1)。图6是V2.1TiNi0.3Crx(x=0~0.6)合金电极在温度为303 K,经完全活化之后在放电电流密度为60、100、200、400、600 mA·g-1的条件下的高倍率放电性能曲线图。从图中可知,随放电电流密度的增大,所有合金电极的放电性能均逐渐降低,这主要是由于大的放电电流密度使氢原子在合金颗粒内部扩散速度加快,使其来不及产生电化学反应,从而以氢气形式溢出,最终使参加电化学反应的氢原子数量大大减少,放电容量降低。Cr添加明显改善了合金电极的高倍率放电性能,在相同的放电电流密度下,合金电极的放电性能都是随着Cr含量的增加先升高后降低,在x=0.4时达到最佳。例如,在放电电流密度为200 mA·g-1时,合金电极的高倍率放电性能(HRD200)由x=0时的22.50%增大到x=0.4时的73.40%,随后又降低到x=0.6时的70.50%。
图7是303K时经过完全活化后的V2.1TiNi0.3Crx(x=0~0.6)合金电极50%DOD极化曲线,表3是根据极化曲线斜率计算所得到的合金电极的交换电流密度I0。从表中可知:随着Cr含量的增加,合金的交换电流密度先增大后减小,这表明合金电极表面的电荷转移速率先增加后减小,这与高倍率放电规律相吻合。

图7 303 K时V2.1TiNi0.3Crx(x=0~0.6)合金电极50% DOD的线性极化曲线Fig.7Linear polarization curves of V2.1TiNi0.3Crx(x=0~0.6)alloy electrodes measured at 50%DOD and 303 K
图8是V2.1TiNi0.3Crx(x=0~0.6)合金电极在施加+500 mV电压时的恒电位阶跃曲线图。由图知:该曲线由两部分组成,第一部分电流随时间迅速下降,在阶跃电位下颗粒表面的氢迅速放电完全;第二部分电流随时间之间近似线性变化,此时合金颗粒内部氢原子在浓度驱动力下向表面扩散并放电。根据文献[29]中公式可计算得出氢扩散系数,其公式如下所示:

表3 V2.1TiNi0.3Crx(x=0~0.6)合金电极的电化学动力学参数Table 3Electrochemical kinetic parameters of the V2.1TiNi0.3Crx(x=0~0.6)alloy electrodes

图8 V2.1TiNi0.3Crx(x=0~0.6)合金电极的恒电位曲线Fig.8Constant potential discharge curves of V2.1TiNi0.3Crx(x=0~0.6)alloy electrodes

其中,i为扩散电流密度(mA·g-1),D为氢的扩散系数(cm2·s-1),r为合金颗粒半径(cm),t为恒电位放电时间(s),dlgi/dt为恒电位放电直线部分斜率。计算结果如表3所示。由表可知:随Cr添加量的增加,氢的扩散系数先增加后减小,当x=0.4时,合金电极中氢的扩散系数最大,可达到1.95×10-10cm2·s-1。其主要原因可能是合金中添加Cr使合金的晶胞体积减小,其内部氢压增大,从而更有利于氢在合金中的扩散[14]。
3 结论
(1)V2.1TiNi0.3Crx(x=0~0.6)合金均由bcc结构的V基固溶体主相和TiNi基第二相组成。随着Cr添加量的增加,合金相的晶胞参数和晶胞体积均逐渐减小,但合金相的结构无明显改变。
(2)添加Cr使V2.1TiNi0.3合金电极的活化性能变差,但添加量的进一步增多对其活化性能影响不大。合金电极的最大放电容量随着Cr含量的增加有降低的趋势,循环稳定性及其放电平台均随着Cr添加量的增加而升高,在x=0.6时,经过20次充放电后的容量保持率C20/Cmax达到最大值88.28%。合金电极的高倍率放电性能、交换电流密度以及氢的扩散系数均随着Cr含量的增加先升高后降低,在x=0.4时其相应的值最大。
(3)当Cr添加量为x=0.4时,合金电极具有最佳的综合电化学性能,其最大放电容量为442.20 mAh·g-1,循环20次后的容量保持率为81.91%。
[1]Zhang Y,Li B,Ren H,et al.Int.J.Hydrogen Energy,2007, 32(15):3420-3426
[2]Tian X,Yun G,Wang H,et al.Int.J.Hydrogen Energy,2014, 39(16):8474-8481
[3]LIU Zhi-Hong(刘志红).Thesis for the Masterate of Chongqing University(重庆大学硕士论文).2008.
[4]LI Rong(李荣),ZHOU Shang-Qi(周上棋),LIANG Guo-Ming (梁国明),et al.J.Mater.Rev.(材料导报),2004,18(5):89-91
[5]LI Shu-Cun(李书存),ZHAO Min-Shou(赵敏寿).Rare Met. (稀有金属),2007,31(4):558-564
[6]YAN Yi-Gang(严义刚),YAN Kang-Ping(闫康平),CHEN Yun-Gui(陈云贵).Rare Met.(稀有金属),2004,28(4):738-743
[7]GUO Xin(郭欣),LI Shu-Cun(李书存),WANG Li(王丽),et al. Chinese J.Inorg.Chem.(无机化学学报),2014,30(9):2019-2024
[8]Tsukahara M,Takahashi K,Mishima T,et al.J.Alloys Compd., 1995,226(1):203-207
[9]Iwakura C,Choi W K,Miyauchi R,et al.J.Electrochem. Soc.,2000,147(7):2503-2506
[10]DAI Fa-Bang(代发帮),CHEN Li-Xin(陈立新),LI Jian(刘剑),et al.J.Rare Metal Mater.Eng.(稀有金属材料与工程),2005,34(9):1500-1504
[11]Yu J,Liu B,Cho K,et al.J.Alloys Compd.,1998,278(1):283-290
[12]LIU Shou-Ping(刘守平),XU An-Lian(徐爱莲),TIAN Zhong -Qing(田中青),et al.J.Funct.Mater.(功能材料),2007,38 (2):286-288
[13]JIA Yan-Min(贾彦敏),LIU Fei-Ye(刘飞烨),XIAO Xue-Zhang(肖学章),et al.J.Acta Phys.-Chim.Sin.(物理化学学报),2009,25(2):247-252
[14]Inoue H,Koyama S,Higuchi E.J.Electrochim.Acta,2012, 59:23-31
[15]LI Rong(李荣),ZHOU Shang-Qi(周上祺),LIU Shou-Ping(刘守平),et al.Chin.J.Nonferrous Met.(中国有色金属学报), 2010,20(4):706-711
[16]Chai Y,Zhao M.Int.J.Hydrogen Energy,2005,30(3):279-283
[17]ZHANG Yong(张勇),GUO Sheng-Wu(郭生武).J.Rare Metal Mater.Eng.(稀有金属材料与工程),2000,29(1):262-265
[18]Kim J,Lee H,Lee P S,et al.J.Alloys Compd.,2003,348 (1):293-300
[19]Iwakura C,Shin-ya R,Miyanohara K,et al.J.Electrochim. Acta,2001,46(18):2781-2786
[20]LI Shu-Cun(李书存),ZHAO Mi-Shou(赵敏寿).J.Rare Metal Mater.Eng.(稀有金属材料与工程),2012,41(2):285-288
[21]Li C,Wang X.J.Alloys Compd.,1998,270(1):246-254
[22]Lee H,Lee K,Lee J.J.Alloys Compd.,1997,260(1):201-207
[23]LEI Yong-Quan(雷永泉),LI Zhou-Peng(李洲鹏),CHEN Chang-Pin(陈长聘),et al.J.Mater.Sci.Eng.(材料科学与工程学报),1990,1:000
[24]ZHEN Qing-Jun(郑青军),ZHOU Chuan-Hua(周传华).J. Power Technol.(电源技术),1999,23(6):298-301
[25]MA Song-Yan(马松艳),ZHAO Dong-Jiang(赵东江).J.Power Technol.(电源技术),1994,4:3
[26]CHEN Chang-Guo(陈昌国),WANG Chang-Jiang(王常江).J. Mater.Rev.(材料导报),2008,21(11):68-71
[27]ZHANG Yu-Jie(张玉洁),YANG Meng(杨猛),DING Yi(丁毅),et al.J.Surface Technol.(表面技术),2008,37(4):9-11
[28]ZHU Yun-Feng(朱云峰).Thesis for the Doctorate of Zhejiang University(浙江大学博士论文).2003.
[29]Zheng G,Popov B N,White R E.J.Electrochem.Soc.,1995, 142:2695-2698
Effect of Chromium Addition on Microstructures and
Electrochemical Properties of V2.1TiNi0.3Alloy
SONG Mao-Cheng1,2ZHANG Rong-Hua1,2ZHANG Xue-Feng*,2ZHAO Chao-Yong2CUI Xu-Mei2LIU Tian-Tian1,2TONG Yan-Wei3PANG Li-Juan2DENG Gang2
(1College of Materials Science and Engineering,Xihua University,Chengdu 610039,China)
(2College of Materials Engineering,Panzhihua University,Panzhihua,Sichuan 617000,China)
(3College of Biological and Chemical Engineering,Panzhihua University,Panzhihua,Sichuan 617000,China)
The microstructures and electrochemical properties of the V2.1TiNi0.3Crx(x=0,0.2,0.4,0.6)hydrogen storage electrode alloys were investigated.The results showed that all of the alloys were consisted of the V-based solid solution main phase with a body centered cubic(bcc)structure and the TiNi-based secondary phases.The secondary phases were mainly in the grain boundaries with network distribution,and some of the secondary phase particles were distributed in the main phase.The cell volumes of the main phase and the maximum discharge capacity of the alloy electrodes decreased with the increase of Chromium(Cr)content,while the cycle stability of the alloy electrodes was gradually increased.At the same time,the kinetic performance of the alloy electrodes improved.The activation performance of the alloy electrodes deteriorated when the Chromium element was added, but further increase of Cr content did not change the activation performance significantly.The V2.1TiNi0.3Cr0.4alloyshowed the best electrochemical properties among the investigated alloys.Its maximum discharge capacity reached 442.20 mAh·g-1,and its capacity retention ratio after 20 cycles was 81.91%.
V-based hydrogen storage alloy;Ni-MH battery;Cr addition;microstructure;electrochemical property
O614.61+1
A
1001-4861(2016)06-0975-08
10.11862/CJIC.2016.124
2015-10-01。收修改稿日期:2015-12-21。
四川省科技支撑计划项目(No.2012GZX0089)和四川省科技创新研究团队建设项目(No.2015TD0008)资助。
*通信联系人。E-mail:wzyzxf@163.com

