球磨辅助高温固相法制备Li1.0Na0.2Ni0.13Co0.13Mn0.54O2正极材料及其性能
王力臻 易祖良 张林森 方华 王诗文
(1郑州轻工业学院,郑州450002)
(2河南省表界面重点实验室,郑州450002)
球磨辅助高温固相法制备Li1.0Na0.2Ni0.13Co0.13Mn0.54O2正极材料及其性能
王力臻*,1,2易祖良1张林森1方华1王诗文1
(1郑州轻工业学院,郑州450002)
(2河南省表界面重点实验室,郑州450002)
以乙酸盐(乙酸锂、乙酸钠、乙酸钴、乙酸镍、乙酸锰等)为原材料,采用球磨辅助高温固相法制备Li1.0Na0.2Ni0.13Co0.13Mn0.54O2正极材料。借助XRD、SEM等表征材料的结构和形貌,利用循环伏安、恒流充放电、交流阻抗等方法研究材料的电化学性能。结果表明,钠的掺杂导致颗粒表面光滑度降低,形成Na0.77MnO2.05新相。0.05C活化过程中,掺钠样品和未掺钠样品首次放电比容量分别为258.4 mAh·g-1和215.8 mAh·g-1,库伦效率分别为75.2%和72.8%;2C放电比容量分别为116.3 mAh·g-1和106.2 mAh· g-1。研究发现,掺钠可减小首次充放电过程的不可逆容量,提高容量保持率;改善倍率性能与容量恢复特性;降低SEI膜阻抗和电荷转移阻抗;掺钠后样品首次循环就可以基本完成Li2MnO3组分向稳定结构的转化,而未掺杂的样品需要两次循环才能逐步完成该过程;XPS结果表明,掺钠样品中Ni2+、Co3+、Mn4+所占比例明显提高,改善了样品的稳定性和电化学性能;循环200次后的XRD结果表明掺钠与未掺钠材料在脱嵌锂反应中的相变化过程基本一致,良好有序的层状结构遭到破坏是循环过程中容量衰减的主要原因。
锂离子电池;Li1.0Na0.2Ni0.13Co0.13Mn0.54O2;球磨;掺钠
目前,商业化锂离子电池正极材料(如:磷酸亚铁锂、锰酸锂、三元材料等)存在克容量相对较小的特点,限制了在规定体积或重量范围内电池容量等性能的提升,所以寻求具有高比容量的正极活性物质成为人们对锂离子电池正极材料研究的热点之一。富锂层状正极材料xLi2MnO3·(1-x)LiMO2(M=Ni、Co、Mn等)具有较高的放电比容量(250 mAh·g-1左右),被众多学者视为下一代锂离子电池正极材料的理想之选[1-2]。胡伟等[3]用碳酸盐共沉淀法合成(Mn0.75Ni0.25)CO3前驱体,以Li2CO3为锂源,通过高温固相法合成富锂材料0.5Li2MnO3·0.5LiMn0.5Ni0.5O2,在2.5~4.6 V,0.2 mA·cm-2充放电条件下,放电比容量高达248 mAh·g-1。Kim等[4]以硝酸盐为原料,采用蔗糖燃烧法合成Li[Li1/6Mn1/2Ni1/6Co1/6]O2,材料在2.0~4.8 V、0.2C条件下首次放电比容量为225 mAh·g-1,经50次循环后,比容量降为175 mAh·g-1。然而,富锂锰基层状正极材料自身存在首次充放电过程中不可逆容量损失较大[5]、高倍率下容量衰减较大等[6-7]缺点。
采用金属元素(如Al[8-9]、Mg[10]、Ru[11]、Fe[12]等)对富锂材料进行体相掺杂,合成价格低廉、电化性能优良的正极材料是当前研究热点之一。王洪等[12]采用共沉淀法合成了铁、铝共掺杂富锂材料Li[Li0.2Mn0.4Fe0.3Al0.1]O2,该材料在电压2.0~4.6 V、电流密度50 mA·g-1下初始放电比容量达到241 mAh·g-1,50次循环后容量衰减率为7%。钠具有和锂相似的物理化学性质和储能机制,且地壳中分布广泛,将钠应用于富锂材料中,目前也有相关研究[13-14]。Enshan Han等[13]用共沉淀法研究了Li1.17-xNaxNi0.10Co0.10Mn0.63O2(x= 0、0.02、0.04、0.06、0.08)材料的性能。研究发现电压2.0~4.8 V,电流密度50 mA·g-1下掺钠材料放电比容量在230~280 mAh·g-1之间,材料倍率性能在x= 0.06时得到明显提升。Lim[14]等采用喷雾热解法制备了Li1.167-xNaxNi0.18Mn0.548Co0.105O2(0≤x≤0.1)正极材料,研究发现Na掺杂量在x=0.05时材料的倍率性能和循环性能得到明显改善。
本文试验以金属乙酸盐为原材料,采用球磨辅助高温固相法制备掺钠材料Li1.0Na0.2Ni0.13Co0.13Mn0.54O2,用相同方法制备富锂材料Li1.2Ni0.13Co0.13Mn0.54O2做对比。并利用相关的物理表征和电化学测试研究掺杂钠元素对材料整体性能的影响。
1 实验部分
1.1 材料合成
常温常压下,将乙酸锂、乙酸钠、乙酸钴、乙酸镍、乙酸锰按化学计量比称量后放入玛瑙球磨罐中,无水乙醇作分散剂,400 rad·min-1球磨30 min后接着300 rad·min-1,球磨8 h。取出混合物后转入真空干燥箱100℃真空干燥得到前驱体,接着将前驱体于马弗炉中高温焙烧。焙烧分低温和高温两阶段,先于500℃下预烧6 h,取出研磨后接着在800℃下焙烧10 h时间,充分研磨后得到Li1.0Na0.2Ni0.13Co0.13Mn0.54O2的样品。作为对比试验,同样方法合成Li1.2Ni0.13Co0.13Mn0.54O2样品。记LN0为Li1.2Ni0.13Co0.13Mn0.54O2样品,LN2为Li1.0Na0.2Ni0.13Co0.13Mn0.54O2样品。
1.2 物性表征
采用美国Perkins Elmer公司生产的Diamond TG/DTA热分析仪对干燥后的前驱体进行测试。采用D-max2550VX射线衍射仪进行结构分析,以Cu Kα耙作为辐射源,管电压40 kV,电流100 mA,扫描速度为4°·min-1,扫描范围2θ为10°~80°。采用日本电子株式会社生产的JSM-5600LV型扫描电子显微镜观察样品的表面形貌。采用美国热电ESCALAB 250Xi型X射线光电子能谱仪(XPS)表征样品表面元素及其价态。
1.3 电化学性能测试
按照8∶1∶1的质量比分别称量样品、SP和PVDF (10%PVDF的NMP溶液),加NMP搅拌使其混合均匀。将膏状物均匀涂覆在铝箔表面,烘干后用模具制得14 mm的圆片作为正极片。将正极片放入真空干燥箱100℃真空干燥12 h取出,以10 MPa压制成型备用。负极为金属锂片,隔膜为Celgard2400,电解液为1 mol·L-1的LiPF6/(DMC+EC,体积比1∶1),在充满氩气的德国布劳恩手套箱中组装成CR2016型号的纽扣电池,室温下静置12 h。
利用所组装的扣式电池,以正极为研究电极,锂片为辅助电极和参比电极进行电化学测试。采用美国Arbin电池测试系统进行充放电测试,充放电电压范围为2.0~4.8 V。采用瑞士万通Autolab电化学工作站进行交流阻抗测试和循环伏安测试,交流信号频率范围为100 000~0.005 Hz,交流幅值为5 mV;循环伏安扫描电位范围为2.0~4.8 V,扫速为0.1 mV·s-1。
2 结果与讨论
2.1 前驱体TG-DTG分析
对LN0和LN2样品的前驱体进行热重分析,TG-DTG曲线如图1所示。由低温开始,热分解过程依次可分为吸附水和结晶水的失去过程、有机物和乙酸盐的分解过程、氧化物生成和初结晶过程、晶粒的生长过程这4个过程。对比2组DTG曲线可以看出,LN2样品前驱体第二和第三个过程较LN0样品相对复杂,这应与掺钠后形成复杂含钠化合物的分解有关。500℃以后LN0样品的前驱体质量基本不再变化,而LN2样品的前驱体在600℃附近存在较大的质量损失,结合XRD结果,这主要是NaxMnO2新相的生成导致的[15]。
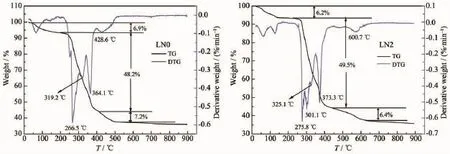
图1 样品前驱体的TG-DTG曲线Fig.1TG-DTG curves of the precursor of samples
2.2 XRD结果分析
图2为2组样品的XRD图。由图中的衍射峰可知LN0样品的结构可归纳为空间群R3m的α-NaFeO2结构[16]。其中,2θ=20°~24°的衍射峰归属于空间群C2/m单斜对称性的(020)和(110)晶面,是Li2MnO3的特征峰[17]。除2θ=16°附近的衍射峰之外,LN2样品的主要衍射峰与LN0的衍射峰基本一致。2θ=16°附近衍射峰对应着新相Na0.70MnO2.05(JCPDS 27-0751),说明LN2样品因钠离子的引入而出现新相,该新相为六方晶系,P2结构[18]。
表1为主要衍射峰(003)和(104)峰的2θ值和d值。从表1中看出,掺钠后,LN2样品的主要衍射峰位置左移[19],d值增大,说明Na+进入了晶格,增大了层间距。表2为样品的晶格参数。由表2可知,样品的I(003)/I(104)均大于1.2,表明合成的样品阳离子混排现象较小。c/a均大于4.899,并且(018)和(110)衍射峰分裂程度较好,表明合成的样品具有良好层状有序结构[20]。和LN0样品相比,LN2样品的c/a值增大,I(003)/ I(104)值增大,表明掺钠后样品层状结构更为理想。
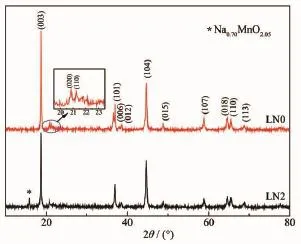
图2 样品的XRD图Fig.2XRD patterns of samples

表1 样品(003)和(104)峰的2θ值和d值Table 1Value of 2θ and d of(003)and(104)of samples
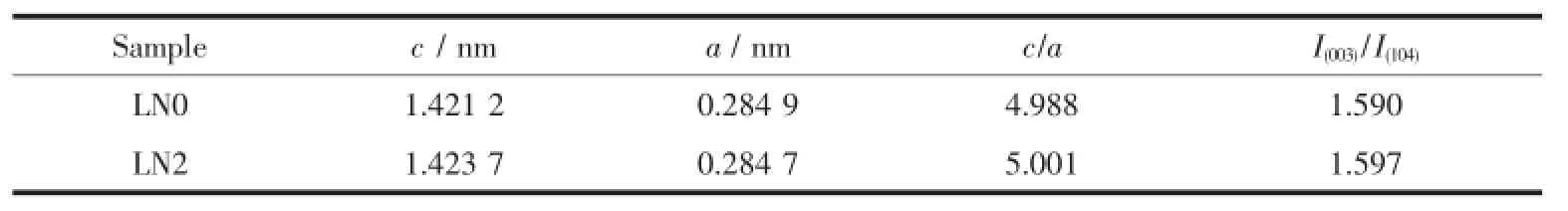
表2 样品的晶格参数Table 2Parameter of crystal lattice of samples
2.3 材料的形貌分析
从图3可以看出LN0样品颗粒呈类球形,表面光滑,一次颗粒粒径大约0.2~0.5 μm,并且颗粒分布相对均匀。LN2样品颗粒形状不规则,表面光滑度降低,掺钠能够影响样品颗粒的分布和表面光滑度,这可能是由于部分钠在反应过程中形成第二相Na0.70MnO2.05导致的。

图3 样品的SEM图Fig.3SEM images of samples
2.4 XPS能谱分析
图4(A)、(B)、(C)、(D)分别显示了样品Ni2p、Co2p、Mn2p、Na1s的XPS谱图的拟合结果。表2显示了拟合后各元素的XPS结合能。图4(A)、(B)、(C)中可以看出样品LN0和LN2的Ni2p、Co2p、Mn2p结合能差别不大。图4(D)中1 069.9 eV的能谱峰可归属于Na1s[21]。
图4(A)是LN0和LN2样品Ni2p的XPS谱图,LN0与LN2样品的峰位基本一致,均可以看做是由Ni2p3/2主峰、Ni2p1/2主峰和振起伴峰(S1、S2)组成。由拟合结果可知,LN0样品Ni2p3/2主峰可分为853.3 eV和854.3 eV,其中853.3 eV对应于Ni2+,这与文献[22]报道的Ni2+2p3/2(855.6 eV)谱峰十分吻合,且振起伴峰(S1、S2,峰位约大于主峰6 eV)同样表明了Ni2+的存在[23];854.3 eV对应于Ni3+,这与文献[24]中报道的关于Ni3+Ni2p3/2(856.3 eV)的峰位大致吻合,峰位的差异是由于具体化学环境和测试条件不同造成的。根据Ni2p3/2拟合峰面积数据可计算Ni2+与Ni3+的百分比,LN0样品Ni2+∶Ni3+=49.9∶50.1,LN2样品Ni2+∶Ni3+=54.2∶45.8。
图4(B)是LN0和LN2样品Co2p的XPS谱峰,它们均可以看做是由Co2p3/2主峰和卫星峰(S1)、Co2p1/2主峰和卫星峰(S2)组成。卫星峰S1和S2的出现与Co3+在八面体场或类八面体场中的特征十分吻合,证明了Co3+的存在[25]。由拟合结果可知,LN0样品Co2p3/2主峰可分为778.7 eV和779.4 eV,Co2p1/2主峰可分为793.8 eV和795.2 eV,其中778.7 eV和793.8 eV对应于Co3+,779.4 eV和795.2 eV对应于Co2+,LN2样品拟合结果与LN0基本一致。因为Co2p3/2范围内有较强的Ni L3M23M23俄歇谱[23],我们选择Co2p1/2区域的拟合结果来计算Co3+和Co2+的百分比,LN0样品Co2+∶Co3+=39.8∶60.2,LN2样品Co2+∶Co3+=30.5∶69.5。

图4 样品LN0和LN2的XPS谱图Fig.4XPS spectra of LN0 and LN2 samples
图4(C)是Mn2p的XPS能谱图。LN0与LN2样品的谱峰均由Mn2p3/2和Mn2p1/2峰组成。通过拟合数据可以知道,LN0样品Mn2p3/2主峰可分为640.6 eV和641.7 eV,根据之前的报道[26],可将640.6 eV对应于Mn3+,641.7 eV对应于Mn4+,LN2样品拟合结果与LN0基本一致。根据Mn2p3/2的拟合结果计算Mn3+和Mn4+的百分比,可得LN0样品Mn3+∶Mn4+= 28.2∶71.8,LN2样品Mn3+∶Mn4+=22.8∶77.2。
由晶体场理论,在八面体场中,中心离子d轨道发生能级分裂形成t2g轨道和eg轨道,eg轨道中的单电子会导致电子轨道的不对称占据,这会引发Jahn-Teller效应[27]。比较Ni2+、Co3+、Mn4+与Ni3+、Co4+、Mn3+的d电子排布,Ni2+为、Co3+为、Mn4+为它们中没有奇数的eg电子,因此能避免Jahn-Teller效应的发生;而Ni3+为有奇数eg电子)、Co2+为(有奇数eg电子)、Mn3+为由电子排布规律可知,Ni2+、Co3+、Mn4+显然比Ni3+、Co2+、Mn3+更稳定。由以上分析并结合XPS拟合结果可知,LN2样品中Ni2+、Co3+、Mn4+含量比LN0样品明显提高,这极大的改善了LN2样品的稳定性,从而提高了样品的电化学性能。
2.4 首次充放电曲线和微分容量曲线
将样品组装成的电池以0.05C活化2次,活化过程的充放电曲线和微分容量曲线对比结果如图5。
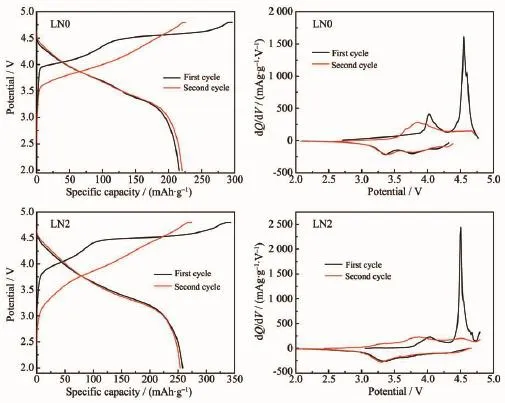
图5 样品前两周充放电曲线和微分容量曲线Fig.5Charge-discharge curves and differential capacity curves for initial two cycles of samples
从充放电曲线上看,LN0样品首次充电比容量296.1 mAh·g-1,放电比容量215.8 mAh·g-1,库伦效率72.8%。第二次充电比容量225.4 mAh·g-1,放电比容量220.7 mAh·g-1,库伦效率97.9%;LN2样品首次充电比容量343.5 mAh·g-1,放电比容量258.4 mAh· g-1,库伦效率75.2%。第二次充电比容量274.2 mAh· g-1,放电比容量254.1 mAh·g-1,库伦效率92.7%。对比LN0样品可知,LN2样品首次充电比容量提高47.4 mAh·g-1,放电比容量提高42.6 mAh·g-1,首次库伦效率提升2.4%。这可能是Na0.70MnO2.05新相促进了Li2MnO3组分中Li2O的脱出,导致充电比容量增大[13]。钠离子进入晶格导致层间距增大,并且Na0.70MnO2.05脱钠后形成更加有利于Li+的扩散通道,使得放电过程中更有利于Li+的嵌入,进而提高放电比容量,首次充放电过程不可逆容量损失得到一定程度降低。
微分容量曲线的峰与充放电曲线的平台相对应。LN0与LN2样品的微分容量曲线差别不大。首次充电过程对应的微分容量曲线于4.1和4.6 V电位附近出现峰,4.1 V电位附近的峰对应Ni2+的氧化过程;4.6 V附近的峰对应Li2MnO3组分脱锂失氧生成具有电化学活性的层状MnO2[6,28]的过程。首次放电过程于4.3、3.7和3.4 V电位附近出现峰,分别对应于Co4+、Ni4+和Mn4+的还原过程[29]。第二次充电过程中,4.1 V电位附近的氧化峰位置左移且峰形变宽,这是由于Mn3+与Ni2+的氧化过程发生重叠导致的;4.6 V附近对应Li2MnO3组分脱锂失氧过程的峰消失,并于4.6 V附近显示出对应于Co3+氧化过程的弱峰[30],由于Co3+氧化过程所对应的电压与Li2MnO3组分活化过程存在重叠,且只进行单电子转移,对材料比容量的贡献较小[31-34],因此在第二次充电过程中于4.6 V附近表现为弱峰。
2.5 循环伏安测试
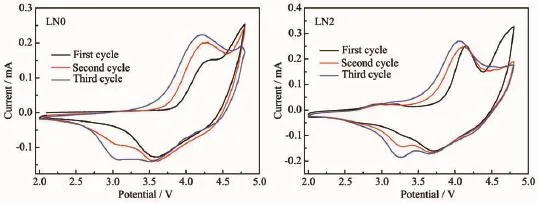
图6 样品的循环伏安曲线Fig.6CV curves of samples
图6为LN0样品和LN2样品在2.0~4.8 V,0.1 mV·s-1条件下循环3周得到的循环伏安曲线图。循环伏安曲线的峰与反应过程相对应,与微分容量曲线的结果相似。LN0样品首次在4.2 V的氧化峰对应于Ni2+的氧化过程,4.5~4.8 V电位范围内出现的氧化峰,主要对应Li2MnO3活化脱锂失氧产生电化学活性物质MnO2的过程[35]。随循环次数增大,4.2 V的氧化峰强度变大、峰形变宽,这是由于Mn3+与Ni2+的还原过程发生重叠以及更多的锰氧化物参与反应共同导致的;4.5~4.8 V电位范围内的氧化峰呈降低趋势,说明Li2MnO3组分在循环过程中因活化脱锂失氧而逐渐消失,样品内部发生重组形成相对稳定的结构[36],与此同时产生出更多的具有电化学活性的锰氧化物。4.3 V出现的弱还原峰对应于Co4+的还原过程,3.6 V的还原峰对应于Ni4+的还原过程,3.2 V的还原峰对应于Mn4+的还原过程,随循环次数增加,3.2 V电位附近的还原峰强度逐渐增大,这同样表明了经活化后,样品中更多的锰参与了电化学反应[37]。通过对比发现,LN2循环伏安曲线的峰位置与LN0的基本一致,这表明样品的氧化还原反应过程基本一致;但是,掺钠后样品首次循环就可以基本完成Li2MnO3组分向稳定结构的转化,而不掺杂的样品需要两次循环才能逐步完成该过程,说明掺钠可以促进Li2MnO3组分的活化,LN2样品仅需一次充放电活化过程就已经基本形成稳定的结够,对该材料在实际中的应用具有积极的现实意义。
2.6 倍率性能测试
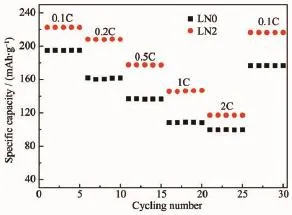
图7 样品的倍率性能图Fig.7Rate capacity curves of samples
样品活化2次后进行倍率测试,图7为样品倍率性能图。随着充放电倍率的增大,2组样品放电比容量降低,2C倍率循环后改为0.1C倍率充放电,容量有一定程度的恢复。0.1C倍率下LN0样品和LN2样品放电比容量分别为194.8 mAh·g-1和222.5 mAh·g-1左右,2C倍率时放电比容量分别为99.5 mAh·g-1和117.2 mAh·g-1,占0.1C放电比容量的51.1%和52.7%。LN0样品和LN2样品0.1C倍率恢复时容量分别达到176.6 mAh·g-1和216.3 mAh· g-1,容量恢复率分别为90.7%、97.2%。由此可知,掺钠改善了材料的倍率性能、循环稳定性与容量恢复特性。这一方面跟少量钠进入晶格,增大层间距,使得Li+脱嵌更加容易有关;另一方面是由于Na0.70MnO2.05新相的存在提高了样品的倍率性能[13,38]。
2.7 循环寿命测试
图8为两组样品2C循环200次的寿命曲线。LN0样品初始放电比容量106.2 mAh·g-1,200次循环后保持54.4 mAh·g-1,容量保持率51.2%。LN2样品初始放电比容量116.3 mAh·g-1,200次循环后保持70.2 mAh·g-1,容量保持率60.4%,比LN0样品提高9.2%。掺钠能增大锂离子扩散通道,降低Li2O从晶格中脱出时导致样品结构的不稳定性,进而提高样品的循环稳定性能[13]。
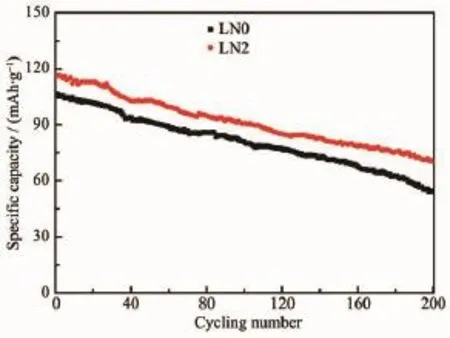
图8 样品2C倍率下的循环性能图Fig.8Cycle performance plots of samples at 2C rate
2.8 交流阻抗测试
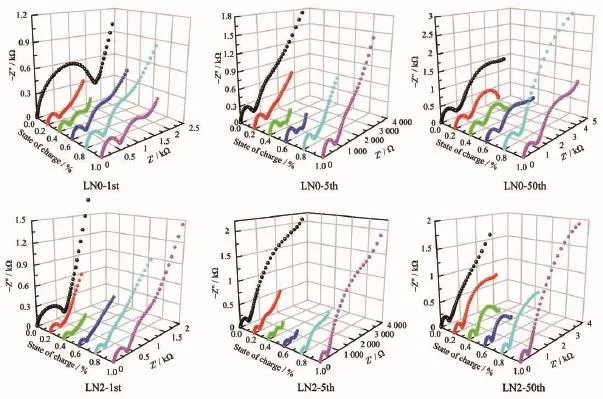
图9 样品在不同SOC下的交流阻抗Fig.9Electrochemical impedance spectra of samples with different SOC
将两组样品组装成扣式电池,测得首次、5次循环后、50次循环后电池再次充电过程中不同荷电态(0%SOC、20%SOC、40%SOC、60%SOC、80%SOC、100%SOC)的交流阻抗图谱,分别以1st、5th和50th表示。结果见图9。使用ZsimpWin软件对数据进行拟合处理,等效电路如图10,拟合结果如图11所示。
从图9可以看出,交流阻抗曲线由高频区圆弧加上低频区直线组成。图10为数据拟合的等效电路图,其中RS代表电极体系的欧姆电阻,包括隔膜中的溶液欧姆电阻和电极本身的欧姆电阻等;Rsf和CPE1代表锂离子通过SEI膜的阻抗;Rct和CPE2代表在电极/电解液界面电荷转移过程的阻抗;ZW代表Warburg阻抗;这里采用常相位元件CPE1和CPE2代替纯电容进行拟合[39]。等效电路中Rsf和Rct的拟合结果见图11。
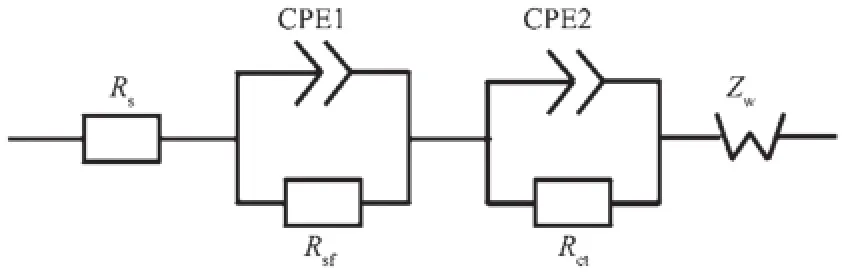
图10 等效电路图Fig.10Equivalent circuit diagram
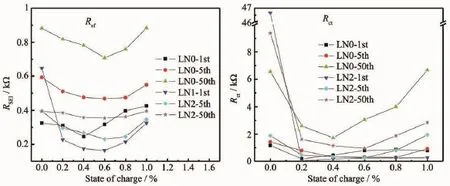
图11 等效电路元件Rsf和Rct的拟合结果Fig.11Fitting results of equivalent circuit component Rsfand Rct
从拟合结果可以看出,2组样品随荷电态增加,Rsf和Rct整体上呈现先减小后增大的趋势;随循环次数加大,Rsf和Rct整体上呈增大趋势,这也正解释了在循环稳定性测试中放电比容量衰减,电化学性能下降这一现象。阻抗值的变化可能由电极表面与电解液发生反应形成的含锂碳酸酯类化合物或碳酸锂等[40]混合物有关,或者是与样品自身结构重组变化有关。对比两组样品的阻抗数据,LN2样品的Rsf和Rct较低,这是第二相中的Na+可以增大层间距,增大Li+扩散通道,提高主体材料离子电导率[41-42]所导致的结果。阻抗值的降低能够促进电化学反应的进行,提高放电比容量,改善倍率性能。由于多次循环中Na0.77MnO2.05能够起到稳定样品结构的作用,LN2样品中的Li+在SEI膜和电极活性材料界面处中的迁移阻力相对LN0样品较小[13],循环性能也因此得到改善。
2.9 样品2C循环200次后XRD图
拆解电池,将循环后的正极片清洗后进行XRD测试,测试结果如图12所示(LN0′为循环后的LN0样品,LN2′为循环后的LN2样品):

图12 样品200次循环后的XRD图Fig.12XRD patterns of samples after 200 cycles
从图12可以看出,经多次循环后,2组样品变化结果基本相近:Li2MnO3的特征峰020、010消失,这是因为在循环过程中Li2MnO3发生不可逆的脱锂失氧反应转变为MnO2,该过程主要对应于活化过程的不可逆容量损失(Li2MnO3→2Li++0.5O2+MnO2+ 2e)[43]。(003)、(101)、(104)主要衍射峰显著减弱,表征层状结构的(018)和(110)分裂峰基本消失,这表明良好有序的层状结构在多次循环后被破坏或转化为其他结构,这是材料多次循环过程中容量衰减的主要原因。LN2样品在2θ=16°附近的峰在循环后消失,表明在多次充放电过程中Na0.77MnO2.05结构中的Na+逐步被Li+取代。结合循环前后XRD测试结果,可认为LN0样品和LN2样品在脱嵌锂反应中的结构变化过程基本一致。但根据2.7中2C倍率下的循环200周测试结果,说明掺钠对延缓结构变化有积极作用。
3 结论
采用球磨辅助高温固相反应制备了Li1.0Na0.2Ni0.13Co0.13Mn0.54O2样品。XRD结果显示部分钠离子掺杂进入样品晶格中,增大层间距;另外一部分钠形成Na0.77MnO2.05新相。SEM结果表明掺钠能够影响样品颗粒的分布和表面光滑度。XPS结果表明,掺钠可以提高样品中Ni2+、Co3+、Mn4+的比例,这极大的改善了样品的稳定性,从而提高了样品的电化学性能。与未掺钠样品相比:Li1.0Na0.2Ni0.13Co0.13Mn0.54O2样品首次放电比容量258.4 mAh·g-1,增大了42.6 mAh·g-1,库伦效率75.2%,提高2.4%;倍率性能明显改善;循环测试中,2C放电比容量116.3 mAh·g-1,200次循环后保持70.2 mAh·g-1,容量保持率60.4%,提高9.2%。交流阻抗测试结果表明,掺钠能够降低SEI膜阻抗和电化学反应阻抗。循环伏安研究表明掺钠后样品首次循环就可以基本完成Li2MnO3组分向稳定结构的转化,而未掺杂的样品需要两次循环才能逐步完成该过程。循环200次后的XRD结果表明掺钠样品中的Na+会逐步被Li+取代,掺钠前后在脱嵌锂反应中的相变化过程基本一致,样品良好有序的层状结构遭到破坏是循环过程中容量衰减的主要原因。掺钠能够提高样品倍率性能,改善循环稳定性和恢复特性。
[1]DU Ke(杜柯),HU Guo-Rong(胡国荣).Chin.Sci.Bull.(科学通报),2012,57(10):794-804
[2]WANG Chun-Lei(王春雷),JIANG You-Xuan(蒋佑煊), KONG Ji-Zhou(孔继周),et al.Chin.J.Power Sources(电源技术),2015,39(12):2763-2767
[3]HU Wei(胡伟),XIE Hui(谢辉),ZHANG Qian(张骞),et al. World Nonferrous Metal(世界有色金属),2009(3):35-37
[4]Kim G Y,Yi S B,Park Y J,et al.Mater.Res.Bull.,2008, 43(12):3543-3552
[5]LIU Yan-Yan(刘燕燕),LIU Dao-Tan(刘道坦),CHEN Li-Quan(陈立泉).J.Chin.Ceram.Soc.(硅酸盐学报),2015,43 (1):8-13
[6]Armstrong A R,Holzapfel M,Novák P,et al.J.Am.Chem. Soc.,2006,128(26):8694-8698
[7]Hong Y S,Park Y J,Ryu K S.J.Mater.Chem.,2004,14(9): 1424-1429
[8]Jafta C J,Ozoemena K I,Mathe M K,et al.Electrochim. Acta,2012,85(12):411-422
[9]YE Yan-Yan(叶艳艳),ZHANG Hai-Lang(张海朗).New Chem.Mater.(化工新型材料),2013,41(1):41-45
[10]Jin X,Xu Q J,Liu H M,et al.Electrochim.Acta,2014,136 (8):19-26
[11]Song B H,Lai M O,Lu L.Electrochim.Acta,2012,80(1): 187-195
[12]WANG Hong(王洪),GUO Chun-Tai(郭春泰),WANG Da-An(王大安).Mater.Rev.(材料导报),2013,27(1):79-82
[13]Han E H,Jing Q M,Zhu L Z,et al.J.Alloys Compd., 2015,618(1):629-634
[14]Lim S N,Seo J Y,Jung D S,et al.J.Alloys Compd.,2015, 623(2):55-61
[15]Parant J P,Olazcuaga R,Devalette M,et al.J.Solid State Chem.,1971,3(1):1-11
[16]Johnson C S,Li N,Lefief C,et al.Chem.Mater.,2008,20 (19):6095-6106
[17]Thackeray M,Kang S H,Johnson C,et al.Electrochem. Commun.,2006,8(9):1531-1538
[18]YANG Shun-Yi(杨顺毅),WANG Xian-You(王先友),LIU Zi-Ling(刘子玲),et al.J.Cent.South Univ.:Science and Technology(中南大学学报:自然科学版),2011,42(8):2245-2251
[19]ZHU Wei-Xiong(朱伟雄),LI Xin-Hai(李新海),WANG Zhi-Xing(王志兴),et al.Chin.J.Nonferrous Met.(中国有色金属学报),2013,23(4):1047-1052
[20]Li D,Sasaki Y,Kobayakawa K,et al.J.Power Sources,2006, 157(1):488-493
[21]Shu H B,Wang X Y,Wen W C,et al.Electrochim.Acta, 2013,89(2):479-487
[22]Li L,Zhang X,Chen R,et al.J.Power Sources,2014,249 (3):28-34
[23]Kosova N V,Devyatkina E T,Kaichev V V.J.Power Sources, 2007,174(2):735-740
[24]Sivaprakash S,Majumder S B.Solid State Ionics,2010,181 (15/16):730-739
[25]Moses A W,Flores H G G,Kim J G,et al.Appl.Surf.Sci., 2007,253(10):4782-4791
[26]Park J S,Roh K C,Lee J W,et al.J.Power Sources,2013, 230(5):138-142
[27]Chang Z R,Chen Z J,Wu F,et al.Electrochim.Acta,2008, 53(8):5927-5933
[28]Lu Z H,Dahn J R.J.Electrochem.Soc.,2002,149(7):A815-A822
[29]Martha S K,Nanda J,Veith J M,et al.J.Power Sources, 2012,199(2):220-226
[30]Kim J H,Park C W,Sun Y K.Solid State Ionics,2003,164 (1/2):43-49
[31]Mizushima K,Jones P C,Wiseman P J,et al.Mater.Res. Bull.,1980,15(6):783-789
[32]Ozawa K.Solid State Ionics,1994,69(3/4):212-221
[33]Aurbach D,Markovsky B,Rodkin A,et al.Electrochim. Acta,2002,47(27):4291-4306
[34]Ohzuku T,Ueda A,Nagayama M,et al.Electrochim.Acta, 1993,38(9):1159-1167
[35]Li F,Zhao S X,Wang K Z,et al.Electrochim.Acta,2013, 97(5):17-22
[36]Jin X,Xu Q J,Yuan X L,et al.Electrochim.Acta,2013,52 (13):605-610
[37]Zhu Z Y,Zhu L W.J.Power Sources,2014,256(6):178-182
[38]Du K,Yang F,Hu G R,et al.J.Power Sources,2013,244 (15):29-34
[39]Du K,Huang J L,Cao Y B,et al.J.Alloys Compd.,2013, 574(10):377-382
[40]Martha S K,Nanda J,Veith G M,et al.J.Power Sources, 2012,216(10):179-186
[41]NAN Ce-Wen(南策文).Acta Phys.Sin.(物理学报),1987,36 (2):191-198
[42]YANG Shun-Yi(杨顺毅),WANG Xian-You(王先友),WU Wen(伍文),et al.J.Cent.South Univ.:Science and Technology(中南大学学报:自然科学版),2009,40(1):72-77
[43]Song B,Lai M O,Lu L.Electrochim.Acta,2012,80(10):187 -195
Synthesis and Properties of Cathode Material Li1.0Na0.2Ni0.13Co0.13Mn0.54O2Prepared by Ball-Milling Assist High Temperature Solid State Method
WANG Li-Zhen*,1,2YI Zu-Liang1ZHANG Lin-Shen1FANG Hua1WANG Shi-Wen1
(1Zhengzhou Institute of Light Industry,Zhengzhou 450002,China)
(2Key Lab of Surface and Interface Science,Zhengzhou 450002,China)
The cathode material Li1.0Na0.2Ni0.13Co0.13Mn0.54O2was synthesized by ball-milling assist high temperature solid state method with acetate(lithium acetate,sodium acetate,cobaltous acetate,nickel acetate,manganese acetate)as raw materials.The structure,morphology were characterized by XRD,SEM.The electrochemical propertieswereinvestigatedbycyclicvoltammetry,charge-discharge,andelectrochemicalimpedance spectroscopy.The results showed that doped sodium causes the surface smoothness reduced and the formation of new phase Na0.77MnO2.05.The initial charge and discharge capacities are 258.4 mAh·g-1and 215.8 mAh·g-1of the sample doped sodium and bank,respectively,with the initial coulombic efficiencies of 75.2%and 72.8%at a rate of 0.05C;their discharge capacity was 116.3 mAh·g-1and 106.2 mAh·g-1at a rate of 2C.Sodium doped can reduce the irreversible capacity in the initial charge/discharge cycle,improve the discharge specific capacity retention,improve the rate performance and capacity recovery features,reduce the SEI film impedance and charge transfer impedance.The sample doping sodium can basically complete the transformation of the Li2MnO3to the stable structure at the first cycle,however,the bank sample need two cycles to complete the transformation process.The XPS result showed that the proportion of Ni2+,Co3+,Mn4+increased significantly after sodium doped which can improve the stability and the electrochemical properties of the sample.The XRD results after 200 cycles showed that the sample doping sodium and the bank have a basically consistent phase change in the reaction of insertion/deinsertion of lithium ion and the damage of good layered structure leads to poor cycling stability.
lithium ion battery;Li1.0Na0.2Ni0.13Co0.13Mn0.54O2;ball milling;sodium-doped
TM911
A
1001-4861(2016)06-1009-10
10.11862/CJIC.2016.138
2015-12-30。收修改稿日期:2016-04-25。
国家自然科学基金面上项目(No.21471135)资助。
*通信联系人。E-mail:wlz@zzuli.edu.cn;会员登记号:S06N9121M1008。

