横看成岭侧成峰,远近高低各不同
——例说氯水的性质
河北 王民会
横看成岭侧成峰,远近高低各不同
——例说氯水的性质
河北 王民会
氯水的多种成分决定了它具有多重性质:①Cl2的强氧化性;②HClO、ClO-的强氧化性;③HCl的强酸性;④HClO的弱酸性;⑤Cl-的性质。⑥主要存在Cl2+H2OH++Cl-+HClO平衡体系。在不同的反应中,氯水中起作用的成分不同,一般从以下6个角度考查。
一、从新制氯水中存在的微粒角度
氯气的水溶液称为氯水,在25℃时,1体积水可溶解2.26体积的氯气。在常温下,溶于水的部分氯气与水发生反应,离子方程式为Cl2+H2OH++Cl-+HClO。
【例1】下列说法正确的是( )
A.新制氯水中存在的分子为Cl2、H2O、HClO、HCl
B.新制氯水中存在的离子H+、Cl-、ClO-、少量OH
C.新制氯水中存在的溶质HCl、HClO
D.液氯和氯水都是混合物
【解析】盐酸是强酸,完全电离,在溶液中不存在HCl分子,A错误;次氯酸是弱酸写离子方程式时用分子式表达,但是它仍有少部分发生电离,生成H+和ClO-,B正确;我们习惯方程式右边是反应产物,易忘记这是一个可逆反应,氯水中还存在氯气,溶质应为Cl2、HCl、HClO,C错误;液氯是氯气经过降温加压得到的纯净物,D错误。
【答案】B
二、从氧化还原反应角度
以新制的氯水为载体,考查Cl2和HClO、ClO-的强氧化性,表现形式为①氧化剂、还原剂、被氧化、被还原等概念的判断,②氧化性(还原性)强弱比较及其应用,③计算电子转移的数目等。
【例2】下列说法正确的是( )
A.(2014山东)Cl2+2Br-2Cl-+Br2与Zn+Cu2+Zn2++Cu反应中均为单质被还原的置换反应
B.(2015四川)漂粉精作消毒剂时,起还原作用
C.(2015安徽)在NaClO和NaCl混合溶液中H+、NH、SO、Br-可以大量共存
D.(2015安徽)向NaClO和NaCl混合溶液中加入浓盐酸,每产生1molCl2,转移电子约为6.02×1023个
E.向BaCl2溶液中通入适量的SO2气体,产生白色沉淀BaSO3,再滴入几滴氯水BaSO3转化为BaSO4
【解析】Zn+Cu2+Zn2++Cu的反应中Zn单质化合价升高被氧化,A错误;漂粉精作消毒剂时,是利用次氯酸根离子的强氧化性,B错误;ClO-具有强氧化性,在酸性条件下,将Br-氧化为Br2或者从H+和ClO-生成HClO角度分析,C错误;方程式为:NaClO+2HClNaCl+H2O+Cl2↑,生成1molCl2,根据Cl2~e-,转移电子约为6.02×1023个,D正确;向BaCl2溶液中通入适量的SO2气体,不会产生沉淀,因为弱酸H2SO3不能制备强酸HCl;滴入几滴氯水,SO2+2H2O+Cl2H2SO4+2HCl,SO2被氧化为H2SO4,产生不溶于酸的BaSO4沉淀,E错误。
【答案】D
【例3】下列由实验现象得出的结论正确的是( )
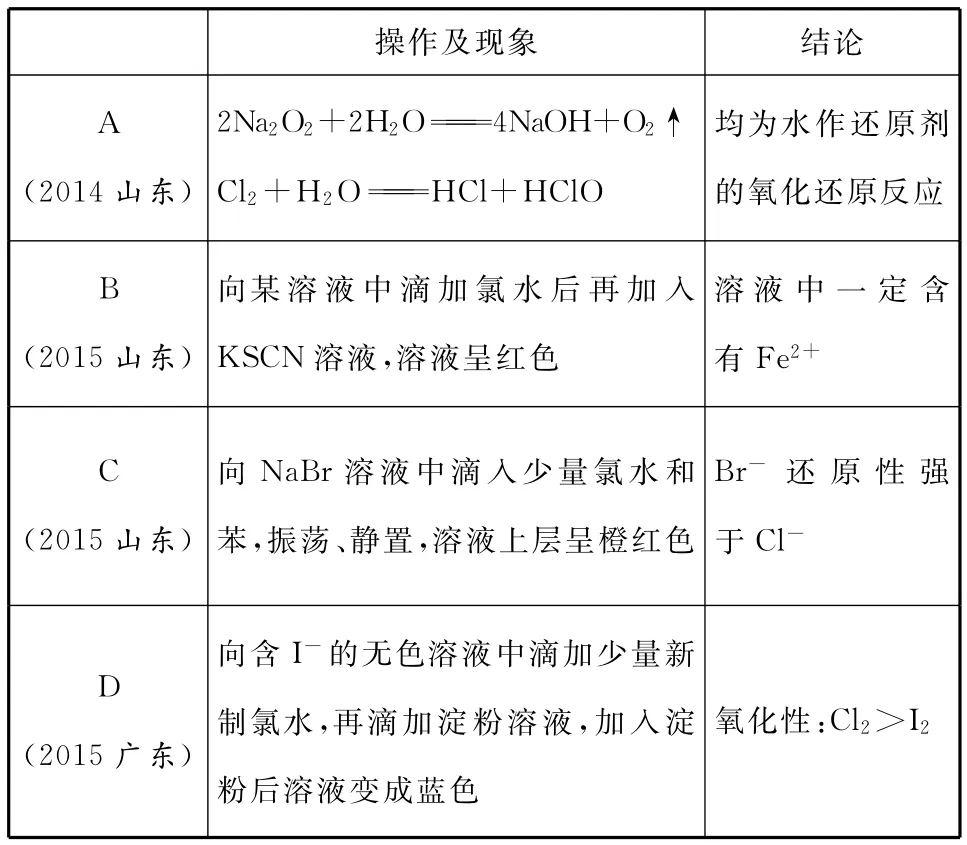
_____________ ___________操作及现象结论A 均为水作还原剂(2014山东)2Na2O2+2H2O4NaOH+O2↑Cl2+H2OHCl+HClO 的氧化还原反应B(2015山东)向某溶液中滴加氯水后再加入KSCN溶液,溶液呈红色溶液中一定含有Fe2+C(2015山东)向NaBr溶液中滴入少量氯水和苯,振荡、静置,溶液上层呈橙红色Br-还原性强于Cl -D(2015广东)向含I-的无色溶液中滴加少量新制氯水,再滴加淀粉溶液,加入淀粉后溶液变成蓝色氧化性:Cl2>I 2
【解析】Na2O2与H2O的反应中氧化剂、还原剂均为Na2O2,Cl2与H2O的反应中氧化剂、还原剂均为Cl2,A错误;Cl2+2Fe2+2Fe3++2Cl-,但该溶液可能原来含有Fe2+或Fe3+,也会出现上述现象,B错误;上层呈橙红色,说明Cl2+2NaBrBr2+2NaCl,则Br-的还原性强于Cl-,C正确;淀粉溶液变成蓝色则生成了I2,说明氯水把I-氧化成了I2,故氧化性:Cl2>I2,D正确。
【答案】CD
三、从离子反应角度
以新制的氯水中微粒为载体,考查离子共存、离子方程式的书写、离子推断和Cl-离子检验。
【例4】下列叙述合理的是( )

【解析】不满足电荷守恒和原子守恒,正确的离子方程式为Cl2+2OH-Cl-+ClO-+H2O,A错误;酸性溶液中不能大量存在ClO-,或者说ClO-具有强氧化性将I-氧化为I2,B项错误;HClO是弱酸不能拆开写,应以分子形式存在,正确的是Cl2+H2OH++Cl-+HClO,C项错误。
【答案】D
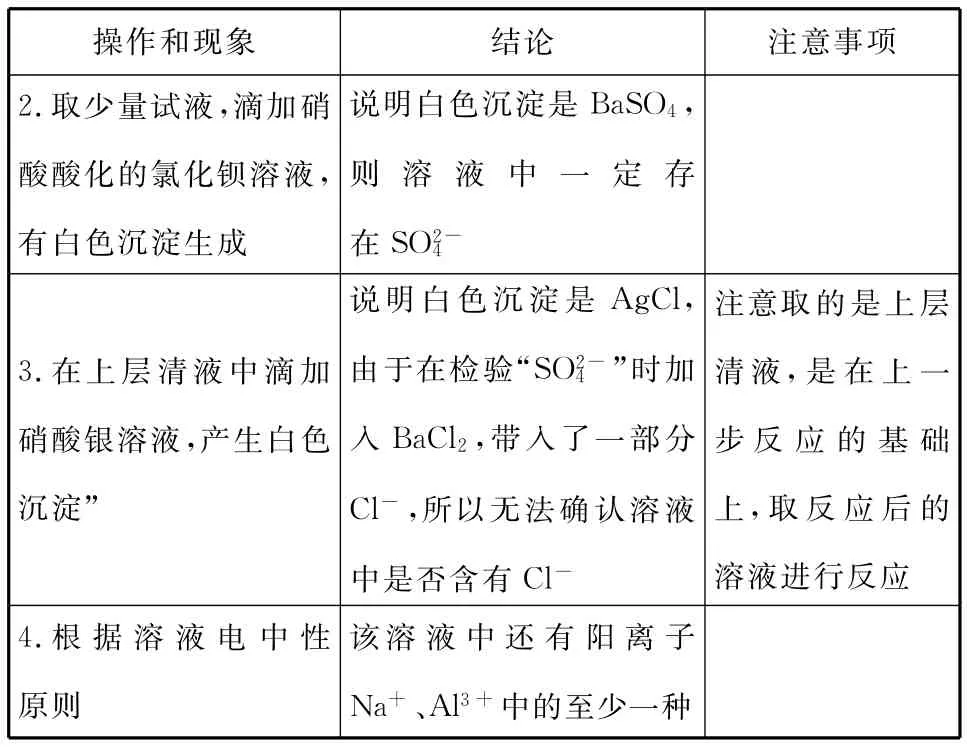
【例5】(2014上海)某未知溶液可能含Cl-、CO、Na+、SO、Al3+,将溶液滴在蓝色石蕊试纸上,试纸变红。取少量试液,滴加硝酸酸化的氯化钡溶液,有白色沉淀生成;在上层清液中滴加硝酸银溶液,产生白色沉淀。下列判断合理的是( )
A.一定有Cl-
C.一定没有Al3+
【答案】BD

操作和现象结论注意事项1.“将溶液滴在蓝色石蕊试纸上,试纸变红”说明溶液显酸性,则CO2-3一定不存在(CO2-3H2O+CO2↑)+2H +
续表
四、从化学平衡角度
以新制氯水中Cl2+H2OH++Cl-+HClO为载体考查平衡体系中微粒浓度的大小比较、影响平衡移动的因素、对动态平衡原理的正确理解。
【例6】下列说法正确的是( )
A.(2009广东)氯水中∶
c(Cl2)=2[c(ClO-)+c(Cl-)+c(HCl)]
B.(2009广东)氯水中∶
c(Cl-)>c(H+)>c(OH-)>c(ClO-)
C.(2015北京)某消毒液的主要成分为NaClO,还含有一定量的NaOH,该消毒液的pH约为12的主要原因是ClO-+H2OHClO+OH-(已知:饱和NaClO溶液的pH约为11)
D.1mol Cl2溶于水参与反应,转移的电子个数为NA
E.向饱和氯水中加入碳酸钙,可制取较高浓度的次氯酸
【解析】A项中c(Cl2)表示氯气分子的平衡浓度,而等式右边应与氯气分子的消耗浓度相等,A错误;B项,氯气与水反应后生成完全电离的盐酸和部分电离的HClO,c(H+)应是二者电离之和,故c(H+)>c(Cl-),B错误;饱和NaClO溶液的pH约为11,而该消毒液的pH约为12>11,主要原因是含有一定量的NaOH,C错误;Cl2+H2OHCl+HClO是可逆反应,参与反应的Cl2小于1mol,所以转移的电子数目小于NA,D错误;Cl2+H2OHCl+HClO,加入CaCO3,HClO的酸性比碳酸酸性弱,HClO与CaCO3不反应,而2HCl+CaCO3CaCl2+H2O+CO2↑,平衡正向移动,次氯酸浓度增大,E正确。
【答案】E
五、氯水的不稳定性和漂白性
氯水不稳定,长久放置的氯水最终为稀盐酸,原因是次氯酸见光分解,2HClO2HCl+O2↑,同理,漂白粉或漂粉精失效的原因也是如此。
【例7】(2015上海)下列物质见光不会分解的是( )
A.HClO B.NH4Cl
C.HNO3D.AgNO3
【解析】次氯酸光照分解为氯化氢和氧气,硝酸及硝酸盐对光和热均不稳定,故选B。
【答案】B
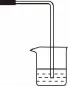
【例8】某同学用下图所示的方法研究物质的性质,其中气体a主要成分是氯气,杂质是空气和水蒸气。回答下列问题:

(1)该项研究(实验)的主要目的是________。
(2)浓硫酸的作用是________;与研究目的直接相关的实验现象是____________。
(3)该实验设计存在事故隐患,事故表现是________;请在如上图的D处以图的形式表明克服事故隐患的措施。
【解析】本题的实验目的是探究氯气跟水反应生成的HClO具有漂白作用,干燥的氯气无漂白作用,依据此目的本题设计了氯气分别与干燥的有色布条和湿润的有色布条作用。事故隐患是Cl2有毒,污染环境。
【答案】(1)比较Cl2与HClO谁有漂白性
(2)吸收气体a中的水 B内的布条不变色,C内的布条褪色
(3)多余的Cl2污染空气 D处如图所示
六、从氯水成分的实验探究角度
1.实验探究含酚酞的NaOH的稀溶液红色突然消失原理
【例9】某化学研究小组探究新制饱和氯水的组成和性质:先观察氯水的外观,再用胶头滴管将该氯水逐滴滴入含有酚酞的NaOH溶液中,边滴边振荡,并连续观察现象,发现溶液的红色逐渐褪去得到无色溶液。请回答下列问题:
(1)请写出新制饱和氯水中含有氯元素物质的化学式:______________________________________________________。
(2)若不再进行更多的实验,请说明能快速判断氯水中含有Cl2的主要依据:__________________________________。
(3)根据预测,实验中溶液红色褪去的原因可能有两种,请用简要的文字说明之:①________;②________。
(4)通过实验进一步探究溶液红色褪去的原因究竟是上述中的①还是②,请简述实验的方法、现象和结论:____。
(5)SO2和Cl2都能用于漂白,若将SO2和Cl2等物质的量混合通入品红溶液,能达到“强强联合”的漂白效果吗?
【解答】(1)Cl2、HCl(或Cl-)、HClO。
(2)氯水显浅黄绿色。
(3)①HCl中和了NaOH;②HClO漂白(氧化)了酚酞。
(4)取无色溶液3mL盛于另一支洁净的试管中,加2滴NaOH溶液,振荡,观察现象。若溶液复现红色,则证明溶液红色褪去的原因是HCl中和了NaOH;若溶液仍为无色,则证明溶液红色褪去的原因是HClO漂白(氧化)了酚酞。
(5)不能,因为SO2和Cl2会发生如下反应:SO2+Cl2+2H2OH2SO4+2HCl,生成的盐酸和稀硫酸无漂白性,从而减弱漂白效果或失去漂白效果。
2.探究氯水的成分和性质
【例10】(2014江苏)在探究新制饱和氯水成分的实验中,根据实验现象得出的结论不正确的是( )
A.氯水的颜色呈浅黄绿色,说明氯水中含有Cl2
B.向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含有Cl-
C.向氯水中加入NaHCO3粉末,有气泡产生,说明氯水中含有H+
D.向FeCl2溶液中滴加氯水,溶液颜色变成棕黄色,说明氯水中含有HClO
【解析】Cl2的颜色为黄绿色,正因为氯水中溶解了黄绿色的Cl2,才使得氯水显示了浅黄绿色,A正确;Cl-与Ag+结合生成AgCl白色沉淀,B正确;Cl2与水反应生成HCl和HClO,H+与NaHCO3反应生成CO2气体,C正确;氯水中的Cl2也能将Fe2+氧化为Fe3+,D错误。
【答案】D
(作者单位:河北省石家庄市鹿泉区第一中学)

