驾驭阿伏加德罗定律 突破化学平衡计算瓶颈
黑龙江 卢国锋
驾驭阿伏加德罗定律 突破化学平衡计算瓶颈
黑龙江 卢国锋
阿伏加德罗定律是以气体为研究对象,揭示温度、压强、体积、粒子数四者关系的定律。唯有对阿伏加德罗定律全方位、深层次的理解,才能有效解决气体参与化学平衡的相关计算。
一、深入解读阿伏加德罗定律
1.研究对象“气体”的理解:①所处温度、压强下,物质状态为气体;②被比较气体既可以是纯净气体又可以是混合气体;③通常应用在不同气体之间的比较,当然也可以是同一种气体的比较。
2.表述内容的理解:决定气体体积只有两个因素,气体分子数和气体分子间距离,气体分子间距离只与温度和压强有关,同温同压时任何气体分子间距离都相等,此时气体体积只与气体分子数有关,体积相同则气体分子数一定相同。
阿伏加德罗定律的可以表述为气体“四同”规律—同温、同压、同体积必定同分子数。拓展为三同定一同,①若两种气体温度、压强、分子数三者相同,则两种气体体积一定相同;②若两种气体温度、体积、分子数三者相同,则两种气体压强一定相同;③若两种气体压强、体积、分子数三者相同,则两种气体温度一定相同。
3.阿伏加德罗定律推论理解
“四同”中有两同,即同温同压或同温同体积时,体积和压强与气体分子数成正比关系。
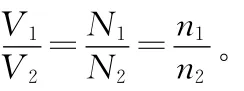
结论1:若反应在恒温恒压体系中进行,气体的体积分数就等于气体的物质的量分数。
结论2:同T、p任何气体的气体摩尔体积都是定值,只要求掌握标准状况下(温度为0℃压强为101kPa)气体摩尔体积22.4L/mol。使用22.4L/mol,一定看条件和状态。

结论3:同T、p气体的密度之比等于摩尔质量之比。
结论4:同温同压同质量的气体,体积与摩尔质量成反比。

结论5:混合气体的总压强等于各组分气体分压之和。
二、化学平衡计算应用举隅
例1 (2014新课标)下图为气相直接水合法中乙烯的平衡转化率与温度、压强的关系[其中n(H2O)∶n(C2H4)=1∶1]。列式计算乙烯水合制乙醇反应在图中A点的平衡常数K=_______________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
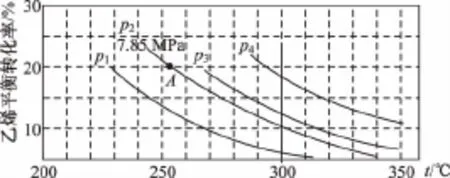
【解析】写出相关反应方程式C2H4(g)+H2O(g)C2H5OH(g),结合信息写出平衡常数表达式Kp=。设C2H4、H2O的起始物质的量分别为1mol,利用三段法计算平衡各组分物质的量,进而计算分压带入表达式计算。设C2H4、H2O的起始物质的量分别为1mol,A点乙烯转化率为20%,参加反应的乙烯为0.2mol,则:

开始(mol)1 1 0
转化(mol)0.2 0 .2 0.2
平衡(mol) 0.8 0 .8 0.2

例2 (2015四川)一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g)幑幐2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示:
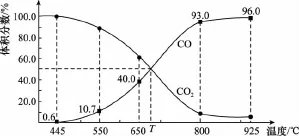
已知:气体分压(p分)=气体总压(p总)×体积分数。下列说法正确的是( )
A.550℃时,若充入惰性气体,v正、v逆均减小,平衡不移动
B.650℃时,反应达平衡后CO2的转化率为25.0%
C.T℃时,若充入等体积的CO2和CO,平衡向逆反应方向移动
D.925℃时,用平衡分压代替平衡浓度表示的化学平衡常数Kp=24.0p总
【解析】A项,可变的恒压密闭容器中反应,若充入惰性气体,相当于减小压强,则v正、v逆均减小,正反应是气体体积增大的反应,则平衡正向移动,A错误;B项,由图可知,650℃时,反应达平衡后CO的体积分数为40%,气体体积分数即为物质的量分数不包括碳,设开始加入的二氧化碳为1mol,转化了xmol,


(作者单位:黑龙江省大庆第五十六中学)

