物质的分类、离子反应考点聚焦
陕西 马亚楼
物质的分类、离子反应考点聚焦
陕西 马亚楼
物质的分类及离子反应是高中化学学习的基础,也是常考的热点。重点考查混合物与纯净物的分类、强弱电解质的分类、酸碱盐、氧化物的分类、胶体的性质和丁达尔效应、离子方程式的正误判断、离子共存的判断等知识,与以前所学的混合物、纯净物、酸碱盐、氧化物等概念紧密相连。为此,笔者将其常见的考点分类例析于下,以期对读者有所帮助。
考点一:物质的分类
考点点击:物质的分类贯穿于化学的始终,主要考查中学阶段常见的物质分类标准(单一分类、树状分类、交叉分类等),其中,纯净物与混合物、单质与化合物、氧化物的分类为考查的重点,也是该部分内容的难点及易错点。纯净物与混合物的本质区别是物质中含有几种物质(一种物质的为纯净物,两种或两种以上的物质属于混合物);单质与化合物的区别是物质中含有几种元素,含有一种的即为单质,两种及其以上的为化合物;氧化物即为由两种元素组成,其中一种元素为氧元素的纯净物。
例1 下列关于物质分类的说法正确的是( )
A.金刚石、白磷都属于单质
B.漂白粉、石英都属于纯净物
C.氯化铵、次氯酸都属于强电解质
D.干冰、盐酸都属于纯净物
解析:本题主要考查物质分类的有关知识。由一种元素组成的纯净物是单质,金刚石是碳元素形成的单质,白磷是磷元素形成的单质,故A正确;由一种物质组成的是纯净物,由不同种物质组成的物质是混合物,漂白粉是次氯酸钙和氯化钙组成的混合物,石英是二氧化硅,属于纯净物,B错误;在溶液中或熔融状态下完全电离出离子的化合物是强电解质,不能完全电离,存在电离平衡的是弱电解质,氯化铵是强电解质,次氯酸是弱电解质,C不正确;干冰是二氧化碳的固体,所以属于纯净物,而盐酸是混合物,D不正确。
答案:A
评注:本题主要考查物质的分类,明确有关概念与含义是解题的关键。此类题给出几种物质,判断是单质还是化合物、纯净物还是混合物、电解质还是非电解质。此类题中特别注意含有混合物的不一定是混合物,如误将冰水混合物认为是混合物,含有纯净物的不一定是纯净物,如纯净的空气误认为是纯净物等出现错误判断。出现这些错误主要是对概念和物质的组成没有弄清楚。因而弄清楚基本概念和物质的组成是解这类题的关键。
考点二:胶体的丁达尔效应辨析
考点点击:胶体的本质特征是胶体的微粒直径介于1~100nm之间。胶体的性质有:布朗运动、丁达尔效应、电泳、胶体的聚沉等,重点考查利用丁达尔效应这种胶体特有的性质来区别胶体与溶液。胶体、溶液、浊液都是把一种(或多种)物质分散在另一种(或多种)物质中所得到的体系,但按照分散质粒子的大小可分为溶液、胶体和浊液,溶质粒子(分子或离子)直径小于1nm的为溶液;分散质离子直径在1~100nm之间的为胶体;分散质粒子直径大于100nm的为浊液。胶体和溶液都属于稳定的分散系,而浊液是不稳定的分散系。胶体能产生丁达尔效应、电泳现象,而溶液则不能。
例2 关于胶体和溶液的区别,下列叙述中正确的是( )
A.溶液呈电中性,胶体带有电荷
B.溶液中溶质微粒一定不带电,胶体中分散质微粒带有电荷
C.溶液中分散质微粒能透过滤纸,胶体中分散质微粒不能透过滤纸
D.溶液中通过一束光线没有特殊现象,胶体中通过一束光线出现明亮的光带
解析:胶体本身是不带电,只是其表面积较大,吸附了溶液中的离子而带了电荷,故A项错;溶液中的溶质,要看能否电离,若是非电解质,则不导电,也即不会移动,B项错;布朗运动本身即是无规律的运动,C项错;丁达尔效应可以用来区分溶液和胶体,D项正确。
答案:D
评注:本题主要考查胶体和溶液性质的比较。本题容易错选B,由于对溶液中溶质理解受非电解质的干扰,实质上溶液中的溶质是非电解质时,溶液不导电,是电解质时,则导电。错选C是由于没有弄清溶液、胶体和浊液分散质粒子半径的大小,其实胶体和溶液的分散质均能透过滤纸。
考点三:电解质和非电解质的辨析
考点点击:电解质(包括酸、碱、盐、水等)和非电解质(包括非金属氧化物、NH3、大多数有机物等)和弱电解质(包括弱酸、弱碱、少数盐、水等)。判断化合物所属的类型是高考的热点之一。
例3 下列说法下列正确的是( )
A.强电解质的水溶液中不存在溶质分子,弱电解质的水溶液中存在溶质分子和离子
B.强电解质的水溶液导电性强于弱电解质的水溶液
C.强电解质都是离子化合物,弱电解质都是共价化合物
D.强电解质易溶于水,弱电解质难溶于水
解析:强电解质溶于水后,全部电离,不存在溶质分子,而弱电解质溶于水后,只部分电离,存在电离平衡,水溶液中存在溶质分子和离子,故A正确。溶液的导电性是由溶液中的离子浓度大小及离子所带的电荷所决定的,若强电解质溶液是稀溶液,则溶液中离子浓度很小,导电性就很弱,故B不正确。强电解质部分是离子化合物,部分是共价化合物,如H2SO4是强酸,也是强电解质,但属于共价化合物,故C不正确。强电解质与溶解性大小无关,如BaSO4难溶于水,但属于强电解质,而NH3·H2O易溶于水,但属于弱电解质。
答案:A
评注:本题主要考查强弱电解质的实质。容易错选C、D。主要是对强弱电解质的含义理解不清。解析这类试题时必须对强弱电解质的含义及其外延理解清。如强电解质部分是离子化合物,部分是共价化合物,强弱电解质与其易溶还是难溶没有直接关系,溶液的导电性是由溶液中的离子浓度大小及离子所带的电荷所决定的,强电解质不一定导电性就强于弱电解质等。
考点四:离子反应发生条件的判断
考点点击:对于复分解反应,若生成难溶物质、难电离或易挥发的物质中的一种,均可发生;对于氧化还原反应,通常遵循“强制弱”的规律,即强氧化剂可以制取弱氧化剂,强还原剂可以制取弱还原剂;金属活动性顺序表前面的金属单质(K、Ca、Na除外)可以把后面的金属元素从其化合物中置换出来;金属活动顺序表排在氢前面的金属单质可以把酸中的氢元素从其化合物中置换出来。
例4 在下列实验中能发生离子反应的是( )
A.NaCl溶液与KOH溶液混合
B.点燃H2和Cl2的混合气体
C.NaOH溶液和CuSO4溶液混合
D.大理石与盐酸的反应
解析:A中尽管有自由移动的离子,但离子间不反应;B中反应物为两种气体,无离子;C中OH-与Cu2+反应生成Cu(OH)2沉淀;D中CaCO3与H+反应生成CO2气体。
答案:CD
评注:本题主要考查离子反应,判断一个化学反应是不是离子反应,关键是看有没有离子参加反应或生成。解题时首先看反应物(或生成物)中有无离子,然后再根据离子反应发生的条件进行判断即可。
考点五:离子反应的书写与正误判断
考点点击:离子反应的实质是离子的重新组合,可以用离子方程式表示反应的实质。一般情况下会在选择题中考查离子方程式的正误判断,在填空题中考查离子方程式的书写。在书写与判断时要注意两个守恒、物质是否可拆、物质的用量、是否漏掉某种离子等方面考虑。
离子方程式书写时必须注意:
1.要遵循反应事实,不能臆造化学反应。
2.要遵循元素原子守恒及电荷守恒,若是氧化还原反应要遵循电子守恒。
3.要遵循拆写原则(反应物和生成物都一样)。
5.要注意题中有关量的关系(如过量、足量、少量等),如用氨水吸收少量的SO2:2NH3·H2O+SO2===。只有过量的CO2、SO2、H2S等气体分别与碱溶液或某些盐反应时,才能生成这些气体对应的酸式根离子。
6.书写关于酸式盐与量有关的离子反应方程式时,一般按量不足的物质的离子的物质的量之比为标准,而足量的物质其参加反应的离子的物质的量之比不一定与化学式相符合。如果没有明确的用量,写成恰好完全反应的情况。
例5 (2015山东)下列表示对应化学反应的离子方程式正确的是( )
A.向稀HNO3中滴加Na2SO3溶液:+2H+=== SO2↑+H2O
B.向Na2SiO3溶液中通入过量SO2:SiO23-+SO2+ H2O ===H2SiO3↓+
C.向Al2(SO4)3溶液中加入过量的NH3·H2O: Al3++4NH3·H2O===[Al(OH)4]-+
D.向CuSO4溶液中加入Na2O2:2Na2O2+2Cu2++2H2O ===4Na++2Cu(OH)2↓+O2↑
解析:稀硝酸与Na2SO3发生氧化还原反应,生成、NO和H2O,A错误;过量的SO2与Na2SiO3溶液反应生成,B错误;Al(OH)3不与弱碱反应,所以Al2(SO4)3与过量氨水反应生成Al(OH)3,C错误;Na2O2与H2O反应生成NaOH和O2,NaOH与CuSO4反应生成Cu(OH)2和Na2SO4,两个方程式加和可得离子方程式,D正确。
答案:D
评注:本题考查离子方程式的书写,涉及氧化还原反应、复分解反应和多步反应。本题容易错选C,错在没有看清过量二字,由于Al(OH)3不与弱碱反应,故Al2(SO4)3与过量氨水反应生成Al(OH)3,而不是[Al(OH)4]-。在书写离子方程式时特别要注意题目中的“适量”“过量”等。
考点六 离子共存的辨析
考点点击:离子共存知识是高考的热点、重点,该部分考查的内容包括离子反应发生的条件、氧化还原反应、物质的电离与水解、溶液酸碱性的计算、电极反应式的正误判断、离子的推断等。解此类题时要注意:看清题干中的要求和题目中的隐含条件。此类试题题干中一般出现能大量共存或不能大量共存的字样,同时还隐含有无色溶液、酸性溶液、碱性溶液或pH等,所以解题时必须看清题目的要求,方可正确解答。
例6 水溶液中能大量共存的一组离子是( )
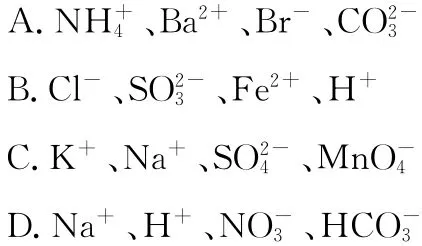
解析:Ba2+和反应生成BaCO3沉淀,不能大量共存,A错误;和H+反应生成SO2,不能大量共存,B错误;C中四种离子不反应,可以大量共存,C正确;H+和会反应生成CO2、H2O,不能大量共存,D错误。
答案:C
评注:本题主要考查常见离子的共存。若对SO2-3和H+反应生成SO2这一过程没有搞清,容易错选B。离子共存是一种重要的常见题型,解这类题必须熟悉离子间反应规律,凡彼此间能发生反应的离子就不能大量共存:①彼此能发生氧化还原反应的离子不能共存,如在酸性条件下等能发生氧化还原反应。②彼此能生成弱电解质的离子不能大量共存,如H+与OH-、ClO-、CH3COO-、AlO2-、CN-、F-等不能共存。③彼此能生成沉淀或微溶物的离子不能大量共存。如Ag+与Cl-、Br-、I-;Ba2+与;Ca2+与、F-等不能大量共存。④彼此能生成气体的离子不能大量共存。如H+与HSO-3、S2-、HS-及NH+4与OH-等不能大量共存。
(作者单位:陕西省永寿县中学)

