抓关键 找联系 破难点
——略谈非金属及其化合物的复习
宁夏 王开山
抓关键 找联系 破难点
——略谈非金属及其化合物的复习
宁夏 王开山
元素及其化合物知识似肌肉组织一样附着在以氧化还原反应、离子反应、电化学、平衡理论、物质结构等概念和理论骨架上,其特点是散,碎、杂、乱。怎样更好的复习元素及其化合物的知识呢?笔者在高三复习过程中通过归纳关键词抓住典型元素及其化合物的典型性质,通过发散思维与基本概念和基本理论建立起联系进行复习收到了比较好的效果。现以典型非金属元素及其化合物为例略述如下:
一、硅
四面体结构、原子晶体、反常等
1.四面体结构
①Si—O键的键能为452kJ·mol-1,在自然界中硅主要以“Si—O”四面体结构形成硅酸盐等。
②晶体硅、二氧化硅等为四面体网状结构。
③在硅酸和高浓度硅酸钠溶液中并不存在单独的H2SiO3分子或SiO2-3独立结构单元,而实际上是通过分子间的脱水形成的一个个“SiO4”四面体连缀,从而形成长链形结构,使得硅酸和硅酸钠都具有一定的黏性。
2.原子晶体
晶体硅、二氧化硅晶体、金刚砂(SiC)、Si3N4等为原子晶体,熔沸点高,硬度大。Si均采用sp3杂化形式。
3.反常
①Si的还原性强于C,但C却能在高温下还原出Si,即SiO2+C ===Si+2CO。
②通常只有金属单质才能从酸中置换出氢气,非金属单质一般能与氧化性酸作用,但常温下Si与HF反应置换出H2。
③很多酸可有对应的酸酐与水反应制得,但硅酸不能由其酸酐SiO2和水反应制得。
④非金属氧化物的熔、沸点一般较低,但SiO2的熔、沸点却很高。
⑤一般情况下,非金属元素单质,熔、沸点低,硬度小,但硅的熔、沸点高,硬度大。
二、氯
关键词:歧化、归中、新制氯水、杀菌效率等
1.歧化、归中
①氯气与水、碱溶液等在常温或高温发生歧化反应生成-1价氯化物和次氯酸盐或氯酸盐等。
②浓盐酸具有较强的还原性,会与次氯酸盐或氯酸盐等发生归中反应生成氯气,这也是氯气常见的替代制法。
2.新制氯水
新制氯水成分复杂,经常会考查其酸性、氧化性、漂白性等。
3.杀菌效率
随着新型的含氯消毒剂不断出现,经常考查含氯消毒剂参与的氧化还原反应配平以及含氯消毒剂的杀菌效率评价和比较等。
三、硫
关键词:氧化性、还原性、离子浓度大小比较、脱硫等
1.氧化性
浓硫酸具有强氧化性,二氧化硫具有弱氧化性。
2.还原性
+4价硫元素、-2价硫元素等具有强还原性,可与常见氧化剂发生反应。
3.离子浓度大小比较
S2-为二元弱酸阴离子,经常会考查Na2S、NaHS等溶液中离子浓度大小比较问题。
4.脱硫
由于SO2是大气污染物,根据SO2的酸性氧化物性质和还原性经常用碱溶液和氧气对其进行吸收,使其转化为亚硫酸盐或硫酸盐,达到脱硫的目的。
四、氮
关键词:化合价多样性、强氧化性、守恒、平衡等
1.化合价多样性
N元素有-3、0、+1、+2、+3、+4、+5五种化合价,对应的物质种类繁多,不同化合价之间的转化要用氧化还原反应进行分析和解答。
2.强氧化性
无论浓稀硝酸都具有强氧化性,酸性条件下的硝酸盐也具有强氧化性,在溶液中会与还原性的微粒发生反应。
3.守恒
硝酸与金属反应的计算经常利用电子守恒和元素守恒进行解答。
4.平衡
N2O4和NO2之间的相互转化可以建立起平衡:以该平衡为素材可以结合图象考查化学反应速率的计算、影响化学反应速率的因素、化学平衡的移动、化学平衡常数的计算等。
典型高考试题赏析
【例1】下列有关说法正确的是( )
A.(2015安徽)SiO2既能和NaOH溶液反应又能和氢氟酸反应,所以是两性氧化物
B.(2015北京)某消毒液的主要成分为NaClO,该消毒液与洁厕灵(主要成分为HCl)混用,产生有毒Cl2∶2H++
C.(2015重庆)SO2和SO3混合气体通入Ba(NO3)2溶液可得到BaSO3和BaSO4
D.(2014安徽)Na2S溶液中粒子浓度大小关系:c(Na+)>c(HS-)>c(OH-)>c(H2S)
【解析】本题考查重要非金属元素的单质及其化合物的典型性质。A项考查SiO2与氢氟酸反应的特殊性,SiO2和氢氟酸反应是由于生成了SiF4气体,SiO2与盐酸、硫酸等并不发生反应,不是两性氧化物,错误;B项考查NaClO溶液的强氧化性,NaClO溶液与HCl会发生Cl元素的归中反应:2H++Cl-+ClO-===Cl2↑+H2O,正确;C项考查SO2的强还原性以及酸性条件下NO3-的强氧化性。SO2和SO3混合气体通入Ba(NO3)2溶液中,溶液呈酸性,具有强氧化性,+4价硫元素具有强还原性,最终只得到BaSO4沉淀,错误;D项考查二元弱酸阴离子S2-的分步水解。Na2S溶液呈碱性,OH-来自于H2O的电离和S2-的水解,所以溶液中粒子浓度大小关系为c(Na+)>c(OH-)>c(HS-)>c(H2S),错误。
【答案】B
【例2】(2013上海,节选)实验室二氧化硫尾气吸收与工业烟气脱硫的化学原理相通。石灰-石膏法和碱法是常用的烟气脱硫法。石灰-石膏法的吸收反应为SO2+吸收产物亚硫酸钙由管道输送至氧化塔氧化,反应为2CaSO4·2H2O。其流程如下图:
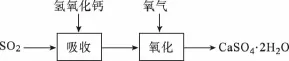
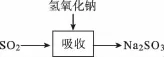
已知:
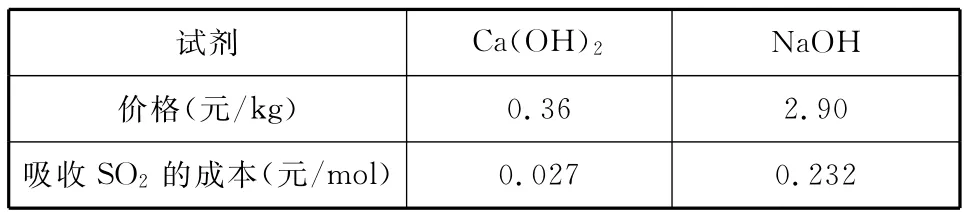
___________试剂Ca(OH)2NaOH______ _______价格(元/kg)0.36 2.90______吸收SO2的成本(元/mol)0.027 0.232______
石灰-石膏法和碱法吸收二氧化硫的化学原理相同之处是___________________。和碱法相比,石灰-石膏法的优点是_________________,缺点是___________________。
在石灰-石膏法和碱法的基础上,设计一个改进的、能实现物料循环的烟气脱硫方案(用流程图表示)。
【解析】由于二氧化硫是大气污染物,所以可以利用二氧化硫为酸性氧化物的性质和还原性将其转化成可利用的亚硫酸盐或硫酸盐。根据两个转化图示,可知都是利用了二氧化硫酸性氧化物的性质与碱进行反应。利用题中有关信息可知采用石灰-石膏法所用原料易得、成本低等,但因Ca(OH)2碱性弱,导致吸收速率慢、效率低;依据上述流程操作存在的缺点可以首先利用氢氧化钠溶液吸收,再将亚硫酸钠与Ca(OH)2反应生成CaSO3和NaOH,能实现NaOH的循环使用。
【答案】利用SO2是酸性氧化物,可与碱反应 原料易得,吸收成本低 吸收速率慢,效率低

【例3】(2015重庆)ClO2与Cl2的氧化性相近。在自来水消毒和果蔬保鲜等方面应用广泛。某兴趣小组通过图1装置(夹持装置略)对其制备、吸收、释放和应用进行了研究。

图1
(1)仪器D的名称是________。安装F中导管时,应选用图2中的________。

图2
(2)打开B的活塞,A中发生反应:2NaClO3+4HCl ===2ClO2↑+Cl2↑+2NaCl+2H2O。为使ClO2在D中被稳定剂充分吸收,滴加稀盐酸的速度宜________(填“快”或“慢”)。
(3)关闭B的活塞,ClO2在D中被稳定剂完全吸收生成NaClO2,此时F中溶液的颜色不变,则装置C的作用是__________________________________________________。
(4)已知在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2,该反应的离子方程式为_________________,在ClO2释放实验中,打开E的活塞,D中发生反应,则装置F的作用是____________________________________。
(5)已吸收ClO2气体的稳定剂Ⅰ和稳定剂Ⅱ,加酸后释放ClO2的浓度随时间的变化如图3所示,若将其用于水果保鲜,你认为效果较好的稳定剂是_________________,原因是__________________________________________________。

图3
【解析】该题以稀盐酸和NaClO3发生归中反应生成ClO2和Cl2为素材,结合反应装置和图象全面考查混合物的分离、检验及使用效果评价等。
(1)根据仪器特征,仪器D的名称是锥形瓶;根据操作分析,F装置应是Cl2和KI反应,所以应长管进气,短管出气,选b。
(2)为使ClO2在D中被稳定剂充分吸收,滴加稀盐酸的速度要慢。
(3)F装置中若有Cl2,则发生Cl2+2KI ===2KCl+I2,淀粉遇碘变蓝,所以F中溶液的颜色不变,则装置C的作用是吸收Cl2。
(4)在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2,该反应的离子方程式为4H++5ClO2-=== Cl-+4ClO2↑+2H2O;在ClO2释放实验中,打开E的活塞,D中发生反应,则装置F的作用是验证是否有ClO2生成。
(5)根据图3可知稳定剂Ⅱ可以缓慢释放ClO2,能较长时间维持保鲜所需的浓度,所以稳定剂Ⅱ效果较好。
【答案】(1)锥形瓶 b
(2)慢
(3)吸收Cl2
(5)稳定剂Ⅱ 稳定剂Ⅱ可以缓慢释放ClO2,能较长时间维持保鲜所需的浓度
(作者单位:宁夏育才中学)

