龙须藤总黄酮中5,7,3′,4′,5′-五甲氧基黄酮在大鼠体内的药动学研究
杨俊腾,周毅生,莫海珊,吴晓敏
(广东药学院 中药学院,广东 广州 510006)
龙须藤总黄酮中5,7,3′,4′,5′-五甲氧基黄酮在大鼠体内的药动学研究
杨俊腾,周毅生,莫海珊,吴晓敏
(广东药学院 中药学院,广东 广州 510006)
摘要:目的 建立测定大鼠血浆中5,7,3′,4′,5′-五甲氧基黄酮浓度的HPLC法,并研究其药动学行为。方法 2组大鼠分别灌胃给予龙须藤总黄酮(给药剂量为60 mg/kg)和5,7,3′,4′,5′-五甲氧基黄酮(给药剂量为113 mg/kg),采用高效液相色谱法测定血浆中5,7,3′,4′,5′-五甲氧基黄酮的浓度,以软件DAS 2.0计算药动学参数。结果 大鼠灌胃5,7,3′,4′,5′-五甲氧基黄酮和龙须藤总黄酮后,5,7,3′,4′,5′-五甲氧基黄酮的体内过程均符合单室模型,主要药动学参数如下:AUC0~∞分别为(5.502±1.302)、(4.192±0.232) (mg·h)/L,Cmax分别为(0.689±0.065)、(0.758 ±0.157) mg/L,Tmax分别为(3.111±0.434)、(1.430±0.365) h,T1/2分别为(2.444±0.287)、(2.700±0.890) h。结论 以小剂量龙须藤总黄酮给药较单体给药时5,7,3′,4′,5′-五甲氧基黄酮血药浓度峰值高,吸收速率常数大,达峰时间短,龙须藤总黄酮中共存的其他成分可能有促进5,7,3′,4′,5′-五甲氧基黄酮吸收的作用。
关键词:龙须藤总黄酮; 5,7,3′,4′,5′-五甲氧基黄酮; 药动学; 大鼠
龙须藤为豆科苏木亚科羊蹄甲属植物龙须藤Bauhiniachampionii(Benth.) Benth.的干燥藤茎,别名过岗园龙、九龙藤、梅花入骨丹等,主要分布于广东、广西、福建等省区,收载于《广东省中药材标准》,味苦、涩,性平,能祛风除湿、活血止痛、健脾理气等[1]。关于龙须藤的提取纯化与质量标准的研究已有相关报道[2-4]。大量研究表明,龙须藤具有抗感染、镇痛、抗癌等生物活性,其中龙须藤总黄酮在抗感染、抗类风湿性关节炎方面有良好的活性[5-9]。从龙须藤药材中分离的5,7,3′,4′,5′-五甲氧基黄酮具有抗癌、镇痛抗感染作用[10-11]。关于龙须藤总黄酮中5,7,3′,4′,5′-五甲氧基黄酮在大鼠体内的药动学行为未见文献报道,本文旨在对比研究龙须藤总黄酮中5,7,3′,4′,5′-五甲氧基黄酮和单体5,7,3′,4′,5′-五甲氧基黄酮在大鼠体内的药动学行为,为阐明5,7,3′,4′,5′-五甲氧基黄酮的药动学特征提供依据。
1仪器与材料
1.1仪器
1.2药品与试剂
5,7,3′,4′,5′-五甲氧基黄酮(批号:111765-200601,质量分数98%,中国食品药品检定研究院);龙须藤总黄酮(自制,质量分数98%);淫羊藿苷(批号:110737-200415,质量分数98%,中国食品药品检定研究院);乙腈、甲醇(色谱级,瑞典Oceanpak公司);蒸馏水(广州屈臣氏食品饮料有限公司)。
1.3动物
SPF级SD大鼠12只,雌雄各半,体质量200~250 g,由广州中医药大学实验动物中心提供,合格证号:SCXK(粤)2013-0020。
2方法与结果
2.1龙须藤总黄酮的提取与分离[6]
取龙须藤药材10 kg,粉碎,按药材与提取溶剂比为1∶10(kg∶L),加体积分数70%乙醇100 L,回流提取3次,每次2 h,合并提取液后减压回收乙醇至无醇味,将回收乙醇后的水溶液用同倍量乙酸乙酯萃取4次,合并乙酸乙酯层,减压回收乙酸乙酯,得乙酸乙酯干浸膏720 g。取乙酸乙酯干浸膏55 g,采用硅胶柱层析,上样量与硅胶量比为1∶10(g∶g),采用二氯甲烷-乙酸乙酯(体积比8∶1~4∶1)梯度洗脱,TLC跟踪分析,合并相同部位,得龙须藤总黄酮1.0 g。经HPLC测定,5,7,3′,4′,5′-五甲氧基黄酮质量分数为24.0%,3′,4′-亚甲二氧基-5,5,6,7-四甲氧基黄酮质量分数为14.6%,5,6,7,3′,4′,5′-六甲氧基黄酮质量分数为28.0%,3者总质量分数达66.6%。
国内也有一些研究:刘诚等(2012)从老乡、校友、共同工作经历衡量独立董事和 CEO 的社会关系,并发现这些关系与董事会的独立性正相关;陆瑶等(2016)重点考察了独立董事与CEO之间的老乡关系对公司违规的影响;李维安等(2017)从董事会成员与CEO之间的老乡、工作、校友关系、年龄和性别相似度度量董事会的社会独立性,发现董事会社会独立性越高,违规公司的CEO越容易发生变更。
2.2溶液的配制
2.2.1对照品溶液的制备精密称取5,7,3′,4′,5′-五甲氧基黄酮9.72 mg,置于10 mL容量瓶中,加甲醇定容,吸取1 mL和0.1 mL分别置于2个100 mL容量瓶中,加甲醇定容,配成质量浓度为9.72 mg/L和0.972 mg/L的对照品溶液。
2.2.2内标溶液的制备精密称取淫羊藿苷11.3 mg,置于10 mL容量瓶中,加甲醇定容,吸取1 mL置于100 mL容量瓶中,甲醇定容,配成质量浓度为11.3 mg/L的淫羊藿苷对照品溶液。
2.2.3药液的配制分别称取龙须藤总黄酮98 mg和5,7,3′,4′,5′-五甲氧基黄酮183 mg,以质量分数10%丙二醇生理盐水溶液配制成质量浓度为8.16 mg/mL的龙须藤总黄酮混悬液和质量浓度为7.62 mg/mL的5,7,3′,4′,5′-五甲氧基黄酮混悬液,使用前充分摇匀。
2.3色谱条件
色谱柱:Phenomenex Luna C18(4.6 mm×250 mm,5 μm);流动相:乙腈-水(0~10 min,30%~40%乙腈;10~26 min,40%~48%乙腈;26~30 min,48%~30%乙腈;30~40 min,30%乙腈);流速:1 mL/min;柱温:30 ℃;检测波长:326 nm;进样量:50 μL。
2.4血浆样品的处理方法
取离心得到的血浆200 μL,加入质量浓度为11.3 mg/L的淫羊藿苷内标10 μL,涡旋混合3 min,加入乙腈600 μL,涡旋混合3 min,以12 000 r/min离心20 min,取上清液,50 ℃、N2吹至约100 μL,加乙酸乙酯400 μL,涡旋1 min,静置后以3 000 r/min离心5 min,取乙酸乙酯层,50 ℃、N2吹干,残渣加甲醇200 μL复溶,12 000 r/min离心10 min,0.22 μm微孔滤膜滤过,取50 μL进样分析。
2.5方法学考察
2.5.1专属性考察取空白血浆,不加内标溶液,其余按“2.4”项下方法操作,色谱图见图1-A;空白血浆加5,7,3′,4′,5′-五甲氧基黄酮对照品,按“2.4”项下方法操作,色谱图见图1-B(其中5,7,3′,4′,5′-五甲氧基黄酮对照品的质量浓度为0.486 0 mg/L,淫羊藿苷的质量浓度为0.565 0 mg/L);大鼠灌胃给药5,7,3′,4′,5′-五甲氧基黄酮1 h后,按“2.4”项下方法操作,色谱图见图1-C;大鼠灌胃给予龙须藤总黄酮30 min后,按“2.4”项下方法操作,色谱图见图1-D。可见:该色谱条件下,能同时检测5,7,3′,4′,5′-五甲氧基黄酮和内标物淫羊藿苷,淫羊藿苷和5,7,3′,4′,5′-五甲氧基黄酮的保留时间分别为10 min和22.5 min,按5,7,3′,4′,5′-五甲氧基黄酮计算理论塔板数大于40 000,与血浆内源性物质及龙须藤总黄酮中其他成分分离良好,分离度大于1.5。
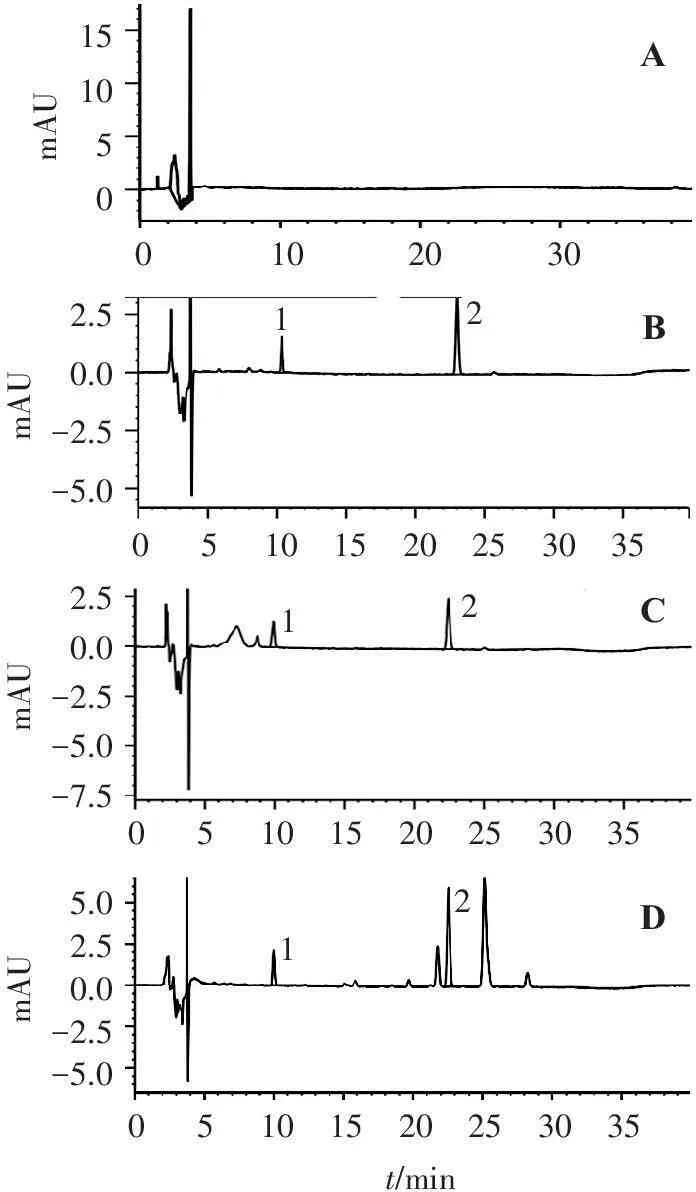
151050mAU1020300122.50.0-2.5-5.01221101520253035052.50.0-2.5-5.0-7.510152025303505101520253035055.02.50.0-2.5-5.0mAUmAUmAUt/minACBD
A.空白血浆; B.空白血浆加淫羊藿苷(0.565 0 mg/L)和5,7,3′,4′,5′-五甲氧基黄酮(0.486 0 mg/L); C.灌胃5,7,3′,4′,5′-五甲氧基黄酮后血浆样品; D.灌胃龙须藤总黄酮后血浆样品; 1.淫羊藿苷; 2.5,7,3′,4′,5′-五甲氧基黄酮。
图1血浆中5,7,3′,4′,5′-五甲氧基黄酮的色谱图
Figure 1Chromatograms of 5,7,3′,4′,5′-pentamethoxyflavone in plasma
2.5.2标准曲线的制备分别取质量浓度为0.972 mg/L的对照品溶液10、20、40、100、200 μL以及质量浓度为9.72 mg/L的对照品溶液40、50 μL,吹干溶剂,再分别加入空白血浆200 μL,配成质量浓度为0.048 6、0.097 2、0.194 4、0.486 0、0.972 0、1.944 0、2.430 0 mg/L的标准血浆样品。除“取离心得到的血浆200 μL”外,其余按“2.4”项下方法操作。以质量浓度为横坐标,5,7,3′,4′,5′-五甲氧基黄酮与淫羊藿苷的峰面积之比为纵坐标,得回归方程Y=6.512X+0.136 6,r=0.999 3,线性范围为0.048 6~2.430 0 mg/L。以S/N>10为定量限。
2.5.3精密度试验按“2.5.2”项下方法配制5,7,3′,4′,5′-五甲氧基黄酮低、中、高3个质量浓度(0.097 2、0.486 0、1.944 0 mg/L)的标准血浆样品,每个质量浓度平行5份,除“取离心得到的血浆200 μL”外,其余按“2.4”项下方法操作。各浓度于1日测定5次,计算日内精密度;连续测定3 d,计算日间精密度,结果见表1。表明低、中、高3个质量浓度样品的精密度试验结果RSD均小于15%。
表15,7,3′,4′,5′-五甲氧基黄酮的精密度试验结果
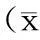
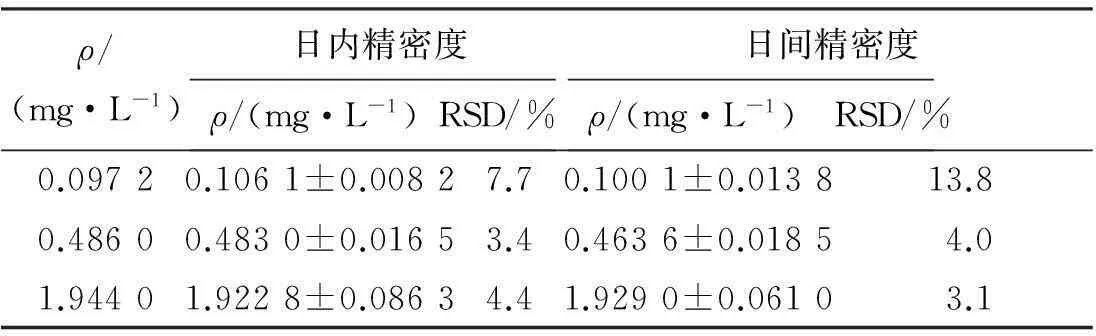
ρ/(mg·L-1)日内精密度ρ/(mg·L-1)RSD/%日间精密度ρ/(mg·L-1) RSD/%0.09720.1061±0.00827.70.1001±0.013813.80.48600.4830±0.01653.40.4636±0.01854.01.94401.9228±0.08634.41.9290±0.06103.1
2.5.4回收率试验按“2.5.2”项下方法制备5,7,3′,4′,5′-五甲氧基黄酮低、中、高3个质量浓度(0.097 2、0.486 0、1.944 0 mg/L)的标准血浆样品,每个质量浓度平行5份,除“取离心得到的血浆200 μL”外,其余按“2.4”项下方法操作。由标准曲线计算5,7,3′,4′,5′-五甲氧基黄酮的实测质量浓度,以实测质量浓度与配制质量浓度之比计算方法回收率。结果5,7,3′,4′,5′-五甲氧基黄酮低、中、高质量浓度的方法回收率分别为(109.2±8.4)%、(99.3±3.4)%、(95.8±5.2)%。
按“2.5.2”项下方法制备5,7,3′,4′,5′-五甲氧基黄酮低、中、高3个质量浓度(0.097 2、0.486 0、1.944 0 mg/L)的标准血浆样品,每个质量浓度平行5份,除“取离心得到的血浆200 μL”外,其余按“2.4”项下方法操作。同时,配制相同质量浓度的不含血浆的对照品和内标物溶液,按“2.3”项下色谱条件分析。以血浆样品中对照品与内标物峰面积比与相同质量浓度不含血浆的对照品和内标物溶液直接进样所得的峰面积比比较,计算提取回收率,结果5,7,3′,4′,5′-五甲氧基黄酮低、中、高质量浓度的提取回收率分别为(75.7±5.7)%、(79.4±8.1)%、(78.9±3.9)%。
2.5.5稳定性试验按“2.5.2”项下方法制备5,7,3′,4′,5′-五甲氧基黄酮低、中、高3个质量浓度(0.097 2、0.486 0、1.944 0 mg/L)的标准血浆样品,每个质量浓度平行3份,分别于4 ℃放置24 h,-20 ℃放置5 d,反复冻融3次后,除“取离心得到的血浆200 μL”外,其余按“2.4”项下方法操作。以标准曲线计算浓度,结果见表2。表明低、中、高3个质量浓度样品的稳定性试验RSD均小于15%。

表2 5,7,3′,4′,5′-五甲氧基黄酮的稳定性试验结果
2.6药动学研究
健康SD大鼠12只,雌雄各半,随机分为2组,适应性饲养1周,给药前12h禁食不禁水。Ⅰ组灌胃5,7,3′,4′,5′-五甲氧基黄酮,剂量为113mg/kg,Ⅱ组灌胃龙须藤总黄酮,剂量为60mg/kg(以5,7,3′,4′,5′-五甲氧基黄酮算为14.4mg/kg)。Ⅰ组于给药后30min,1、1.5、2、4、6、8、10、12、24h,Ⅱ组于给药后5、15、30min,1、1.5、2、4、6、8、12、24h,分别从眼球后静脉丛取血0.5mL,置于肝素抗凝管中,以6 000r/min离心10min得血浆。按“2.4”项下方法操作,测定各血浆样品中的5,7,3′,4′,5′-五甲氧基黄酮的质量浓度。在测定样品过程中,按“2.5.2”项下方法制备5,7,3′,4′,5′-五甲氧基黄酮低、中、高3个质量浓度(0.097 2、0.486 0、1.944 0mg/L)的质控血浆样品,除“取离心得到的血浆200μL”外,其余按“2.4”项下方法操作,每日进行质控。
2.6.1药动学参数龙须藤总黄酮中5,7,3′,4′,5′-五甲氧基黄酮及单体5,7,3′,4′,5′-五甲氧基黄酮的平均血药质量浓度-时间曲线见图2,血药质量浓度数据采用DAS2.0软件计算主要药动学参数,结果见表3。5,7,3′,4′,5′-五甲氧基黄酮的血药质量浓度-时间数据拟合符合单室模型。
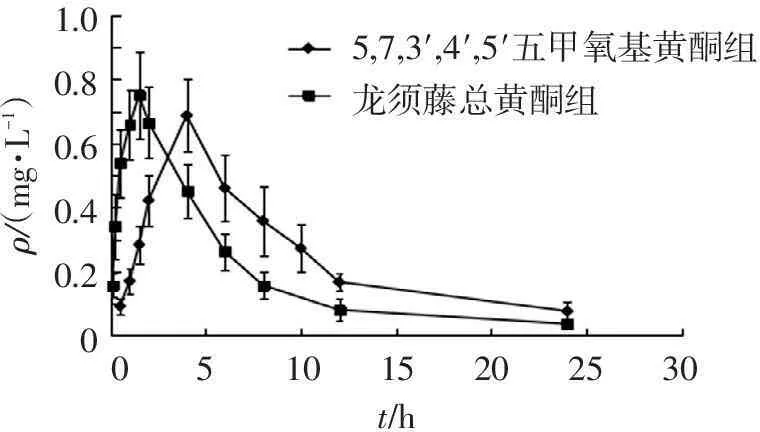
1.00.80.60.40.201015202530055,7,3′,4′,5′五甲氧基黄酮组龙须藤总黄酮组t/hρ/(mg?L-1)
图25,7,3′,4′,5′-五甲氧基黄酮的平均血药质量浓度-时间曲线

表35,7,3′,4′,5′-五甲氧基黄酮的主要药动学参数
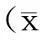

参数龙须藤总黄酮组5,7,3',4',5'-五甲氧基黄酮组Cmax/(mg·L-1)0.758±0.1570.689±0.065Tmax/h1.430±0.3653.111±0.434T1/2/h2.700±0.8902.444±0.287AUC0~t/(mg·h·L-1)4.162±0.2315.390±1.214AUC0~∞/(mg·h·L-1)4.192±0.2325.502±1.302k/h-10.289±0.1310.287±0.034ka/h-11.606±0.8010.369±0.058
2.6.2相对生物利用度根据以下公式计算相对生物利用度[12]:
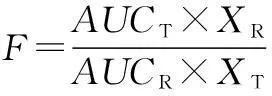
式中:F为相对生物利用度,AUCT、AUCR分别为龙须藤总黄酮组和5,7,3′,4′,5′-五甲氧基黄酮组的时间曲线下面积,XT为龙须藤总黄酮组的给药剂量(60 mg/kg,以5,7,3′,4′,5′-五甲氧基黄酮计为14.4 mg/kg),XR为5,7,3′,4′,5′-五甲氧基黄酮组的给药剂量(113 mg/kg)。计算得到5,7,3′,4′,5′-五甲氧基黄酮的相对生物利用度为581%。
3讨论
本文采用HPLC-UV法测定血浆中5,7,3′,4′,5′-五甲氧基黄酮的浓度,结果表明5,7,3′,4′,5′-五甲氧基黄酮在326 nm处有最大吸收,峰形好,基线稳定,故选取326 nm为检测波长,所选内标物淫羊藿苷能与龙须藤总黄酮中的其他成分及血浆内源性成分达到很好的分离。在本文色谱条件下,龙须藤总黄酮中的5,7,3′,4′,5′-五甲氧基黄酮与相邻组分的分离度均大于1.5,按5,7,3′,4′,5′-五甲氧基黄酮计算理论塔板数不低于40 000,表明该法灵敏、准确。
根据本课题组前期5,7,3′,4′,5′-五甲氧基黄酮的抗炎镇痛试验[11],小鼠给药剂量折算成大鼠的给药剂量为0.028 4、0.056 8、0.113 6 g/kg,以5,7,3′,4′,5′-五甲氧基黄酮计龙须藤总黄酮的给药剂量为0.118、0.236、0.473 g/kg。经过反复试验,给予5,7,3′,4′,5′-五甲氧基黄酮单体低、中剂量,其血药质量浓度过低,难以得到完整的血药质量浓度-时间曲线,故采用0.113 g/kg为给药剂量。龙须藤总黄酮给予所折算的低剂量即可造成大鼠死亡,原因可能为龙须藤总黄酮中除含有5,7,3′,4′,5′-五甲氧基黄酮外,尚含有类似结构的5种多甲氧基黄酮成分[13],其中或存在毒性较大的成分,使得给予与单体给药时同等剂量的情况下造成大鼠死亡,难以进行等剂量的比较,故将剂量降为0.06 g/kg,则获得图2血药质量浓度-时间曲线。
由DAS2.0软件拟合结果所得药动学参数可知,以龙须藤总黄酮给药时,其中的5,7,3′,4′,5′-五甲氧基黄酮比单体给药的血药质量浓度峰值高,达峰时间短,吸收速率常数大,原因可能是5,7,3′,4′,5′-五甲氧基黄酮为多甲氧基黄酮,结构中没有羟基等亲水基团,在水溶液为主的胃肠道中难以溶解,吸收过程受到溶解度的限制。单体给药可能因在胃肠道中溶解性差而导致吸收缓慢,而以龙须藤总黄酮给药时,可能因混合物中含有的其他多甲氧基黄酮或其他成分可促进5,7,3′,4′,5′-五甲氧基黄酮的溶解,使得5,7,3′,4′,5′-五甲氧基黄酮吸收加快,导致达峰时间变短,达峰浓度值升高。5,7,3′,4′,5′-五甲氧基黄酮单体给药剂量约为龙须藤总黄酮所含5,7,3′,4′,5′-五甲氧基黄酮的7.8倍,但是两者的药时曲线下面积相差不大,原因可能为龙须藤总黄酮中的其他成分促进5,7,3′,4′,5′-五甲氧基黄酮的吸收,而单体给药时,由于吸收差导致吸收进血的量减少,从而使得龙须藤总黄酮中5,7,3′,4′,5′-五甲氧基黄酮的相对生物利用度升高。
据此推测,龙须藤总黄酮中存在的类似结构成分或其他类成分可能具有促进5,7,3′,4′,5′-五甲氧基黄酮的吸收的作用。为全面了解5,7,3′,4′,5′-五甲氧基黄酮的体内动力学行为,尚需进一步进行体内分布研究。
参考文献:
[1] 广东省食品药品监督管理局.广东省中药材标准:第二册[M].广州:广东科技出版社,2004:114-115.
[2] 赵永恒,周毅生,王嵩,等.星点设计-效应面法优化龙须藤提取工艺[J].中国实验方剂学杂志,2014,20(6):36-39.
[3] 林丽微,周毅生,周臻,等.基于药效学跟踪试验提取分离龙须藤总黄酮及其含量测定[J].中国实验方剂学杂志,2015,21(5):103-106.
[4] 易荆丽,张嘉家,周毅生,等.HPLC测定龙须藤中2种多甲氧基黄酮的含量[J].中国实验方剂学杂志,2013,19(18):155-157.
[5] 易荆丽,张嘉家,周毅生,等.龙须藤提取物的镇痛抗炎作用[J].广东药学院学报,2012,28(6):647-651.
[6] 林丽微,周毅生,周臻,等.龙须藤总黄酮对膝关节炎模型大鼠的抗炎作用[J].广东药学院学报,2014,30(5):608-611.
[7] 叶蕻芝,陈加守,李西海,等.梅花入骨丹多糖对SW1353软骨肉瘤细胞活性的影响[J].福建中医药大学学报,2011,21(6):32-34.
[8] 余方荣,李西海,蔡亮亮,等.梅花入骨丹总黄酮对人软骨肉瘤细胞活性的影响[J].福建中医药大学学报,2012,22(1):24-25.
[9] 张玉琴.龙须藤抗类风湿关节炎的药效物质基础及作用机制研究[D].福州:福建中医药大学,2013.
[10] CAI H,SALE S,BRITTON R G,et al. Pharmacokinetics in mice and metabolism in murine and human liver fractions of the putative cancer chemopreventive agents 3′,4′,5′,5,7-pentamethoxyflavone and tricin (4′,5,7-trihydroxy-3′,5′-dimethoxyflavone)[J]. Cancer Chemother Pharmacol,2011,67(2):255-263.
[11] 易荆丽,赵永恒,周毅生,等.5,7,3′,4′,5′-五甲氧基黄酮的镇痛抗炎作用研究[J].中成药,2014,36(12):2609-2611.
[12] 刘建平.生物药剂学与药物动力学[M].4版.北京:人民卫生出版社,2011:341-346.
[13] CHIEN C C,YUH P C,HONG Y H,et al. New flavones fromBauhiniachampioniiBenth[J]. Chem Pharm Bull,1984,32(1):166-169.
(责任编辑:陈翔)
Study on the pharmacokinetics of 5,7,3′,4′,5′-pentamethoxyflavone in total flavonoids fromBauhiniachampionii(Benth.) Benth. in rats
YANG Junteng,ZHOU Yisheng,MO Haishan,WU Xiaomin
(SchoolofTraditionalChineseMedicine,GuangdongPharmaceuticalUniversity,Guangzhou510006,China)
Abstract:Objective To develop a HPLC method for the determination of 5,7,3′,4′,5′-pentamethoxy-flavon in rat plasma and study pharmacokinetics of 5,7,3′,4′,5′-pentamethoxyflavone in total flavonoids from Bauhinia championii (Benth.) Benth. in rats after intragastric administration. Methods The two groups of rats were orally treated with total flavonoids from B. championii (the dose was 60 mg/kg) and 5,7,3′,4′,5′-pentamethoxyflavon (the dose was 113 mg/kg). The concentration of 5,7,3′,4′,5′-pentamethoxyflavon in plasma was determined by HPLC. The pharmacokinetic parameters were calculated with DAS 2.0 program. Results Metabolic process of 5,7,3′,4′,5′-pentamethoxyflavon was fit with single compartment model after intragastric administration. The main pharmacokinetic parameters were as follows: AUC0~∞were (5.502±1.302) (mg·h)/L and (4.192±0.232) (mg·h)/L,Cspanwere (0.689±0.065) mg/L and (0.758±0.157) mg/L,Tspanwere (3.111±0.434) h and (1.430±0.365) h,T1/2were (2.444±0.287) h and (2.700±0.890) h. Conclusion When small dose of total flavonoids from B. championii was administered,the Cspanwas higher,the absorption rate constant was bigger,and the Tspanwas shorter than those of monomer administration. Other ingredients of total flavonoids from B. championii can promote the absorption and change the distribution of 5,7,3′,4′,5′-pentamethoxyflavon.
Key words:total flavonoids from Bauhinia championii (Benth.) Benth.; 5,7,3′,4′,5′-pentamethoxyflavone; pharmacokinetics; rat
DOI:10.16809/j.cnki.1006-8783.2015110501
中图分类号:R965
文献标志码:A
文章编号:1006-8783(2016)01-0009-05
作者简介:杨俊腾(1990—),女,2013级硕士研究生,Email:yjt060913@126.com;通信作者:周毅生(1957—),男,教授,硕士生导师,从事药物新剂型及新技术研究,电话:020-39352168,Email:yishzhou@aliyun.com。
收稿日期:2015-11-05
网络出版时间:2016-01-18 10:03网络出版地址:http://www.cnki.net/kcms/detail/44.1413.R.20160118.1003.003.html

