不同栽培条件下辣椒果实辣椒素含量的分析与QTL定位
王 宁 张正海 王立浩 张宝玺
(中国农业科学院蔬菜花卉研究所,北京 100081)
王宁,女,硕士研究生,专业方向:蔬菜遗传育种,E-mail:andy2012win@163.com
不同栽培条件下辣椒果实辣椒素含量的分析与QTL定位
王 宁 张正海 王立浩 张宝玺*
(中国农业科学院蔬菜花卉研究所,北京 100081)
王宁,女,硕士研究生,专业方向:蔬菜遗传育种,E-mail:andy2012win@163.com
摘 要:利用辣味辣椒Perennial(Capsicum annuum)和无辣味辣椒83-58种内重组自交系群体构建的辣椒种内遗传图谱,以温室和露地栽培条件下无辣味辣椒77013A与重组自交系群体各株系杂交F1果实的辣椒素和二氢辣椒素含量作为表型性状进行分析。结果表明,温室和露地栽培条件下辣椒素和二氢辣椒素的含量和比值差异明显。对露地和温室栽培条件下辣椒果实辣椒素和二氢辣椒素含量、总和及其比值进行了QTL定位,共获得16个关于辣椒素和二氢辣椒素含量的QTL位点,分布在辣椒第2、4、12号染色体上,2号染色体上同时控制辣椒素、二氢辣椒素、二者比值和辣椒素总量的主效QTL位点cap2.1、dhp2.1、C/D2.1和(C+D)2.1,均在露地和温室被检测到,其LOD值大于5.0,贡献率为20.2%~76.6%,侧翼标记均为BD76366和Pun1,12号染色体上调控辣椒素总量的微效QTL也在温室和露地同时被检测到,其他QTL位点未在两种环境下同时定位到。
关键词:辣味;辣椒素类物质;环境;QTL
辣椒(Capsicum annuum)是茄科辣椒属的一种重要蔬菜作物,在世界范围内广泛种植。辣椒因其独特的辛辣刺激性而广为人们喜爱(Govindarajan,1985;Perkins et al .,2002)。人们感觉到“辣味”,是辣椒中的辣椒素与人体神经系统中的辣椒素受体(Transient receptor potential vanilloid 1,TRPV1)结合,而使人产生的一种轻微痛觉刺激(Caterina et al.,1997)。辣椒中辣椒素类物质主要存在于辣椒的胎座组织和隔膜中,其中以辣椒素(capsaicin,CAP)和二氢辣椒素(dihydrocapsaicin,DHP)为主,两者含量达到了辣椒素总量的80%以上(Kozukue et al.,2005)。研究表明,控制辣椒辣味的单显性基因Pun1位于2号染色体上,编码酰基转移酶(acyltransferase)(Lee et al.,2005;Lang et al., 2006),Kim等(2001)找到了一个Pun1的候选基因SB2-66,在胎座中特异表达,编码AT3。目前也发现了Pun1基因的3个无辣味突变位点pun11、pun12和pun13(Stewart et al.,2007;Stellari et al.,2010),并以此开发了特异的分子标记(Wyatt et al.,2012)。
辣椒素的含量决定了辣味的强弱,表现为数量遗传(Zewdie & Bosland,2000a,2000b;Ben-Chaim et al.,2006),辣椒素类物质受环境条件的影响(Harvell & Bosland,1997;Gurung et al.,2011),Phimchan等(2012)的研究表明,干旱胁迫会影响不同辣度材料的辣椒素积累水平,彭琼等(2015)认为轻度干旱能显著提高辣椒果实中辣椒素类物质含量。对于辣椒素类物质的QTL定位研究,在7号染色体上找到两个QTL位点cap7.1和cap7.2(Blum et al.,2003;Paran et al.,2010),而后又在3、4、5、6、10和11号染色体上发现了辣椒素类物质含量的QTL位点(Ben-Chaim et al.,2006;Yarnes et al.,2013),目前1、2、9、12 号染色体还未定位到和辣椒素类物质含量相关的位点,而且关于不同环境下辣椒素和二氢辣椒素含量变化及相应的QTL定位比较分析的研究还较少。
本试验利用以SNP标记(KASPar分型技术)为主构建的一年生辣椒种内遗传图谱,以无辣味辣椒77013A与此种内图谱群体各株系杂交F1果实的辣椒素含量为表型性状,对露地和温室栽培环境下的辣椒素、二氢辣椒素含量、辣椒素总量和辣椒素/二氢辣椒素比值进行了QTL定位,为辣椒辣味即辣椒素含量高低的遗传控制研究提供参考。
1 材料与方法
1.1试材及取样
有辣味辣椒Perennial和无辣味辣椒83-58杂交种内重组自交系F7群体(RILs),以及无辣味辣椒77013A均由中国农业科学院蔬菜花卉研究所辣椒课题组提供。作图群体是Perennial×83-58以单粒传的方式构建的F7RILs群体,共113个株系(52个有辣味、61个无辣味);性状调查的群体以77013A为母本,分别以Perennial、83-58和RILs群体113个株系为父本,进行人工杂交获得115个杂交F1。
于2013年9月将RILs群体113个株系、83-58、Perennial和77013A各4株定植于本所廊坊基地日光温室,苗期提取基因组DNA;2014年3月和4月分别将77013A、 83-58、Perennial和115个杂交F1定植于中国农业科学院南口基地的露地和温室,3次重复,每个重复8株。定植后用温湿度记录仪实时记录环境温湿度变化,每隔2 h记录一次。
1.2辣椒素和二氢辣椒素的测定
果实青熟时(约授粉后60 d),采集77013A、83-58、Perennial和115个杂交F1正常青熟果实,摘除果柄、基部胎座和种子,65 ℃干燥24 h,用磨样机打成粉末,取0.500 g粉末利用超高效液相色谱(UPLC)技术测定辣椒素和二氢辣椒素含量。每个样本3个生物学重复,每个重复6个果实。UPLC由中国农业科学院农业部蔬菜品质监督检验测试中心完成,采用优化的提取方法,将称好的0.500 g辣椒粉末加入甲醇+四氢呋喃(1 V∶1 V)混合溶液25 mL,封口后摇床振荡30 min,然后置于37 ℃水浴条件使用超声波提取10 min,静置30 min后吸取上清液加入到上样瓶中,进行色谱分析。
1.3遗传连锁图谱构建
辣椒种内遗传图谱中以ES命名的400个SSR标记由本所辣椒课题组开发,其余521个SSR、228个CAPS和2个SCAR标记来自已报道的辣椒遗传图谱(Wu et al.,2009;Wyatt et al.,2012)。4个InDel标记和27个CAPS标记是本所辣椒课题组通过对试验双亲SlEF重测序对差异序列设计所得。SNP(KASpar)标记的序列由法国农业科学院提供,试验方法参照LGC公司的方法进行(http://www.kbioscience.co.uk)。将亲本和RILs群体中筛选到的多态性标记数据导入Joinmap 4.0软件(van Ooijen,2006)进行分析并构建遗传连锁图。图谱构建的LOD≥ 3.0,步长为0.5,算法为regression mapping,去除无效标记的阈值设为5.0,采用Kosambi函数(Kosambi,1943)计算遗传距离。然后结合露地和温室测定的辣椒素和二氢辣椒素含量数据,利用MapQTL 3.0软件区间作图法(Interval Mapping)进行QTL定位,将LOD阈值定为Permutation Test检验结果>95%时的值来确定QTL存在。
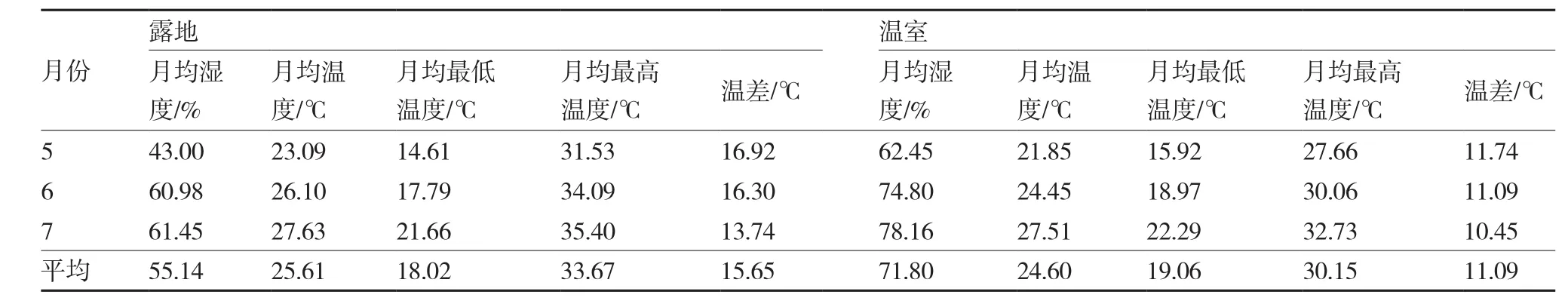
表1 温室与露地温度和湿度比较
2 结果与分析
2.1温室与露地的栽培环境差异
通过温湿度记录仪每2 h记录一次温室和露地的温湿度数据(表1)。5~7月,露地的月平均温度比温室高1.01 ℃,月平均最低温度比温室低1.04℃,月平均最高温度比温室高3.52 ℃,从而使露地温差比温室大4.56 ℃。在环境湿度上,露地平均湿度为55.14%,温室平均湿度为71.80%,温室湿度比露地高16.66个百分点。
2.2不同栽培条件下辣椒素含量变化
77013A与Perennial、83-58、RILs群体的115个杂交F1中,露地77013A×Perennial辣椒素总量为3 490.50 mg·kg-1,温室为4 419.72 mg·kg-1,温室比露地高26.6%;而77013A×RILs的辣椒素总量在露地平均为272.42 mg·kg-1,温室中平均为195.61 mg·kg-1,温室比露地低28.2%(表2)。77013A与RILs群体各株系113个F1中,有52个单株同时合成辣椒素和二氢辣椒素(图1,辣椒素和二氢辣椒素都为0的单株未列出),其中39个单株的辣椒素总量露地高于温室,剩余13个单株则是温室高于露地,露地整体的辣椒素总量高于温室。
除77013A×Perennial的F1辣椒素含量温室比露地高33.3%外;其余不论是辣椒素还是二氢辣椒素含量,露地条件下的测定值均高于温室的测定值(表2)。而温室中辣椒素与二氢辣椒素的比值则大于露地。综上可以看出:露地在高温且温差较大、湿度较低的环境下,辣椒素和二氢辣椒素的积累量大多高于温室。

表2 亲本和RILs群体中辣椒素类物质含量
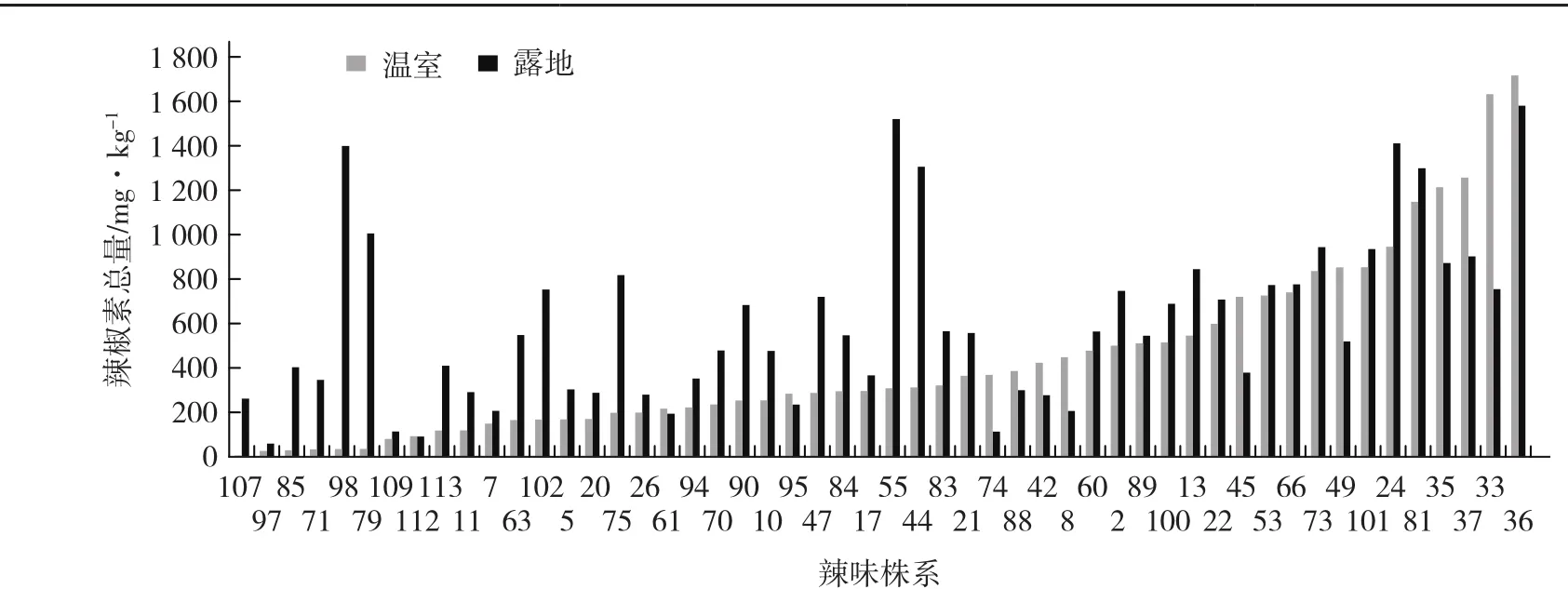
图1 有辣味的77013A×RILs F1群体在温室和露地条件下辣椒素类物质含量变化
2.3辣椒素含量的QTL定位
Perennial含辣椒素6 091.62 mg·kg-1,二氢辣椒素2 184.42 mg·kg-1,77013A两物质含量均为0。Perennial×77013A(辣味辣椒×无辣味辣椒)的F1辣椒素含量为2 513.61 mg·kg-1,二氢辣椒素为976.89 mg·kg-1,介于双亲Perennial与77013A之间,而83-58×77013(无辣味辣椒×无辣味辣椒)F1的辣椒素、二氢辣椒素含量均为0(表2)。可见辣椒素和二氢辣椒素含量的遗传表现为数量性状遗传的特点。且77013A与RILs群体测交一代中,辣椒素和二氢辣椒素的含量呈连续分布,可以利用构建的遗传图谱进行QTL定位。
在RILs群体中共检测到温室和露地环境下有关辣椒素、二氢辣椒素、辣椒素总量及辣椒素/二氢辣椒素的16个QTL位点,位于第2、4、12号染色体上(图2)。在温室和露地共同检测到的辣椒素QTL位点1个、二氢辣椒素QTL位点1个,辣椒素总量QTL位点2个,辣椒素/二氢辣椒素QTL位点1个(表3)。其中,除了辣椒素总量在12号染色体上露地和温室定位到了一个共同微效位点外,其他各项的共同位点均为位于P2b连锁群上的主效QTL,而其他微效QTL位点未在两种环境下同时检测到。温室中,辣椒素、二氢辣椒素和辣椒素总量均在P2c连锁群同一位置检测到微效位点;在露地环境下,辣椒素和二氢辣椒素均在12号染色体上定位到同一减效微效位点,二氢辣椒素在P4a连锁群上也检测到微效位点(表3)。

图2 辣椒素、二氢辣椒素、辣椒素总量及辣椒素/二氢辣椒素在RILs(83-58×Perennial)群体中的QTL定位G指温室QTL位点;F指露地QTL位点。
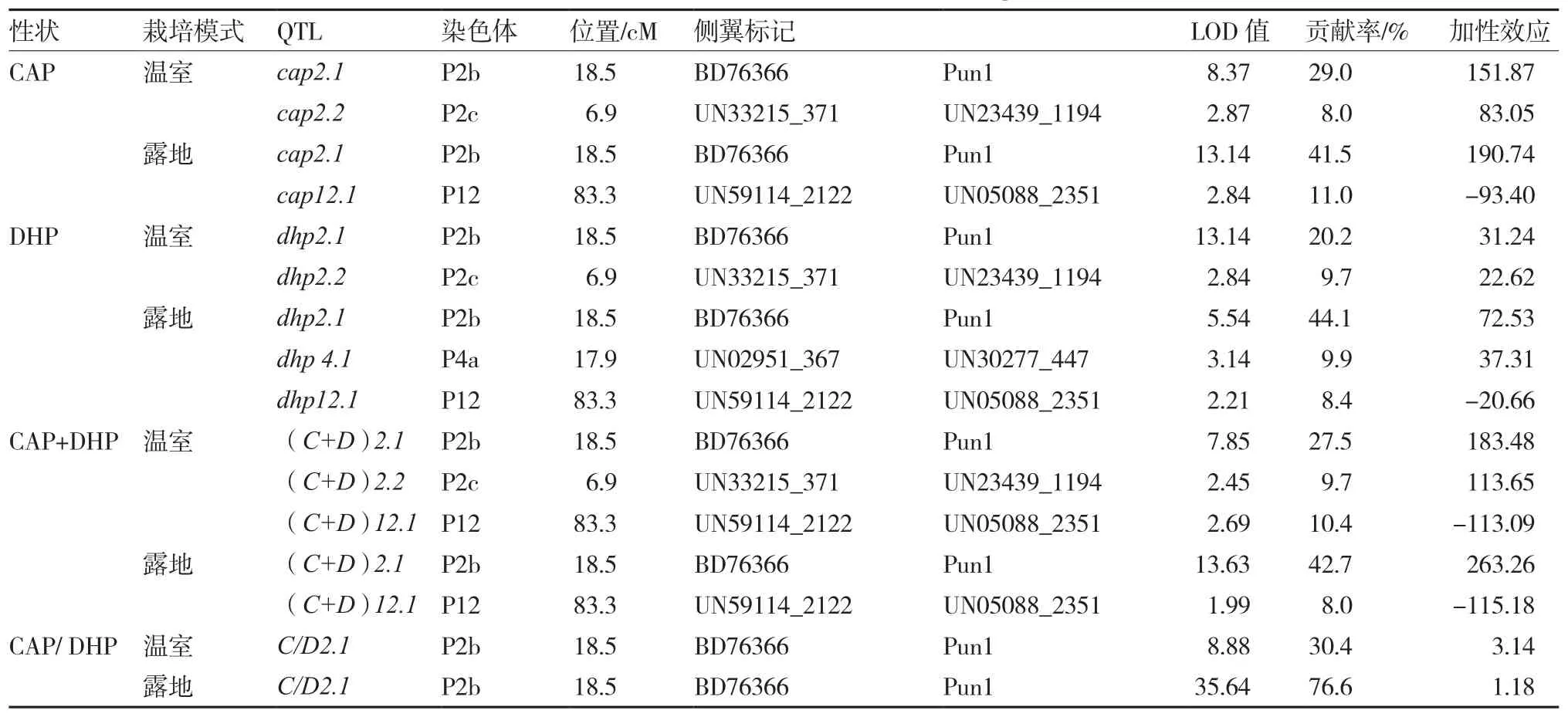
表3 辣椒素和二氢辣椒素在RILs群体的QTL定位
辣椒素(CAP):共检测到4个QTL位点,其中2个为温室和露地共同主效QTL位点,侧翼标记均为BD76366和Pun1,位于2号染色体上,均为加性效应。同时在2号染色体另一区域,温室检测到一微效QTL位点,而露地未检测到,侧翼标记为UN33215_371和UN23439_1194,贡献率为8.0%,表现为增效位点。而在12号染色体上仅在露地条件下检测到一微效QTL位点,贡献率11.0%,为减效位点,说明控制辣椒素含量的位点受环境调控。
二氢辣椒素(DHP):共检测到5个QTL位点,除了仅在露地条件下检测到位于P4a连锁群一微效QTL位点,其他位点位置均与辣椒素的QTL位点一致,只是贡献率有所差异。该微效QTL位点侧翼标记为UN02951_367和UN30277_447,贡献率为9.9%,表现为增效位点。
辣椒素总量(CAP+DHP):露地和温室分别在P2b和P12的相同位置检测到主效和微效QTL位点,温室还在P2c连锁群检测到微效QTL。
辣椒素/二氢辣椒素(CAP/ DHP):温室和露地均在2号染色体的BD76366和Pun1之间检测到控制辣椒素/二氢辣椒素的主效QTL位点,贡献率分别为30.4%和76.6%,加性效应,未在其他染色体上检测到其他QTL位点。
3 结论与讨论
分子遗传图谱的构建和QTL定位有助于辣椒的分子标记辅助育种选择,在以往的研究中,依靠RAPD、RFLP、SSR等标记构建的辣椒图谱取得了很大进展,但也存在图谱密度不够高、连锁群较多的问题(刘峰 等,2012;段蒙蒙,2014)。本试验利用种内F7重组自交系为作图群体,以KASPar技术分型SNP标记为主,结合SSR和CAPs标记构建的较高密度的遗传图谱,有利于进行农艺性状的定位和辅助育种。
对于辣味有无的遗传,通过辣味辣椒×无辣味辣椒(F1)辣椒素类物质的含量测定,可以看出辣味遗传为非质量性状,辣味强弱在分离群体中差异明显,辣椒素类物质含量受环境影响。Otha(1962)认为高温可以增加辣椒素类物质积累。本试验结果显示:和温室相比,露地表现为高温低湿、温差大,露地RILs测交群体的辣椒素类物质的含量大多高于温室,表明高温且温差较大、低湿环境更有利于辣椒素类物质的积累;辣椒素/二氢辣椒素则为温室高于露地,呈现相反的结果,说明环境条件对辣椒素和二氢辣椒素的影响是不同的。从露地和温室二氢辣椒素的含量看,露地二氢辣椒素含量升高得快,使得辣椒素与二氢辣椒素比值降低,环境因素对二氢辣椒素的影响较大。本试验测交一代群体中,大部分单株辣椒素总量露地高于温室,而少数则是露地低于温室,是试验误差还是环境敏感的遗传位点调控使然,还有待进一步探究。
本试验利用测交群体对辣椒素和二氢辣椒素含量进行QTL定位,得到的16个QTL位点,分别位于第2、4、12号染色体上,其中G-cap2.1、F-cap2.1、G-dhp2.1、F-dhp2.1、G-(C+D)2.1、F-(C+D)2.1、G-C/D2.1和F-C/D2.1同时被定位在了2号染色体上相同区域,且均为主效QTL位点,侧翼标记为Pun1与BD76366,不同环境下的贡献率有差别,且露地环境的贡献率均超过了40%,高于温室。QTL位点的重叠表明该位点同时调控辣椒素与二氢辣椒素的合成,也调控辣椒素与二氢辣椒素的比值及总量的大小。其他微效QTL位点中,G-cap2.2、G-dhp2.2和G-(C+D)2.2同时被定位在P2c连锁群的UN33215_371和UN23439_1194之间,而露地环境下未被检测到,表明该位点为温室所特有的;而在12号染色体上同时获得了露地调控辣椒素、二氢辣椒素和辣椒素总量的F-cap12.1、F-dhp12.1 和F-(C+D)12.1,温室仅在辣椒素总量上定位到G-(C+D)12.1位点,P2c和P12两处的微效位点可能为环境敏感的微效QTL。露地环境下还检测到位于4号染色体UN02951_367和UN30277_447之间的F-dhp4.1位点,本试验没有定位到关于辣椒素与二氢辣椒素比值的微效QTL位点。上述微效QTL位点调控了辣椒素和二氢辣椒素含量及辣椒素总量的变化,且在不同栽培环境下进行调控的QTL位点有所差异,说明环境因子(温度或湿度)通过影响某些QTL位点来调控两物质含量的变化,导致温室与露地辣椒素类物质含量及比值的差异。本试验利用种内RILs群体作图并进行QTL定位,RILs群体遗传背景较为相近,相比前人利用种间群体获得的位点相对要少一些(Ben-Chaim et al.,2006;Yarnes et al.,2013)。本试验发现了两种环境条件下存在差异的QTL位点,为以后系统研究环境对辣椒素类物质的影响提供了参考。而对于找到环境调控辣椒素类物质含量变化的微效QTL位点以及某一环境因子对辣椒素类物质含量的影响还需进一步深入研究。
参考文献
段蒙蒙.2014.辣椒种内遗传图谱的构建及植物学性状和抗疫病的QTL定位〔硕士论文〕.北京:中国农业科学院.
刘峰,王运生,田雪亮,茆振川,邹学校,谢丙炎.2012.辣椒转录组SSR挖掘及其多态性分析.园艺学报,39(1):168-174.彭琼,童建华,柏连阳,萧浪涛.2015.干旱胁迫对辣椒果实中辣椒素、二氢辣椒素及VC含量的影响.中国蔬菜,(12):44-47.
Ben-Chaim A,Borovsky Y,Falise M,Mazourek M,Kang B C,Paran I,Jahn M.2006.QTL analysis for capsaicinoid content in Capsicum.Theor Appl Genet,113:1481-1490.
Blum E,Mazourek M,O’Connell M A,Curry J,Thorup T,Liu K,Jahn M M,Paran I.2003.Molecular mapping of capsaicinoid biosynthesis genes and quantitative trait loci analysis for capsaicinoid content in Capsicum.Theor Appl Genet,108:79-86.
Caterina M J,Schumacher M A,Tominaga M,Rosen T A,Levine J D,Julius D.1997.The capsaicin receptor:a heat-activated ion channel in the pain pathway.Nature,389:816-824.
Govindarajan V S.1985.Capsicium production,technology,chemitry and quality,history,botany,cultivation and primary processing.CRC Crit Rev Food Sci Nutr,22:109-176.
Gurung T,Techawongstien S,Suriharn B,Techawongstien S.2011.Impact of environments on the accumulation of capsaicinoids in Capsicum spp.HortScience,46:1-6.
Harvell K,Bosland P W.1997.The environment produces a significant effect on pungency of chiles.HortScience,32:1292.
Kim M,Kim S,Kim S,Kim B D.2001.Isolation of cDNA clones differentially accumulated in the placenta of pungent pepper by suppression subtractive hybridization.Mol Cells,11:213-219.
Kosambi D.1943.The estimation of map distances from recombination values.Annals of Eugenics,12(1):172-175.
Kozukue N,Han J S,Kozukue E,Lee S J,Kim J A,Lee K R,Levin C E,Friedman M.2005.Analysis of eight capsaicinoids in peppers and pepper-containing foods by high-performance liquid chromatography and liquid chromatography-mass spectrometry.J Agric Food Chem,53:9172-9181.
Lang Y,Yanagawa S,Sasanuma T,Sasakuma T.2006.A gene encoding a putative acyl-transferase involved in pungency of Capsicum.Breeding Sci,56:55-62.
Lee C J,Yoo E Y,Shin J H,Lee J,Hwang H S,Kim B D.2005.Nonpungent Capsicum contains a deletion in the capsaicinoid synthetase gene,which allows early detection of pungency with SCAR markers.Mol Cells,19:262-267.
Otha Y.1962.Physiological and genetical studies on the pungency of Capsicum.IV.Secretory organs,receptacles and distribution of capsaicin in the Capsicum fruit.Japanese Journal of Breeding,12:179-183.
Paran I,Akler T,Jones G.2010.QTLs for capsaicinoids content in Capsicum // Prohens J,Rodriguez-Burruezo A.Advances in Genetics and Breeding of Capsicum and Eggplant.Valencia:Universidad Politécnica de Valencia:273-278.
Perkins B,Bushway R,Guthire K,Fan T,Stewart B,Prince A,Williams M.2002.Determination of capsaicinoids in salsa by liquid chromatography and enzyme immunoassay.JAOAC Int,85:82-85.
Phimchan P,Techawongstien S,Chanthai S,Bosland P W.2012.Impact of drought stress on the accumulation of capsaicinoids in Capsicum cultivars with different initial capsaicinoid levels.HortScience,47(9):1204-1209.
Stellari G M,Mazourek M,Jahn M M.2010.Contrasting modes for loss of pungency between cultivated and wild species of Capsicum.Heredity,104:460-471.
Stewart C J,Mazourek M,Stellari G M,O’Connell M,Jahn M.2007.Genetic control of pungency in C. chinense via the Pun1 locus.J Exp Bot,58:979-991.
van Ooijen J W.2006.JoinMap 4:software for the calculation of genetic linkage maps in experimental populations.Wageningen,Netherlands:Kyazma BV.
Wu F,Eannetta N T,Xu Y,Durrett R,Mazourek M,Jahn M M,Tanksley S D.2009.A COSII genetic map of the pepper genome provides a detailed picture of synteny with tomato and new insights into recent chromosome evolution in the genus Capsicum.Theor Appl Genet,118(7):1279-1293.
Wyatt L E,Eannetta N T,Stellari G M,Mazourek M.2012.Development and application of a suite of non-pungency markers for the Pun1 gene in pepper(Capsicum spp.).Mol Breeding,30:1525-1529.
Yarnes S C,Ashrafi H,Reyes-Chin-Wo S,Hill T A,Stoffel K M,van Deynze A,Gulick P.2013.Identification of QTLs for capsaicinoids,fruit quality,and plant architecture-related traits in an interspecific Capsicum RIL population.Genome,56 (1):61-74.
Zewdie Y,Bosland P W.2000a.Evaluation of genotype,environment,and genotype-by-environment interaction for capsaicinoids in Capsicum annuum L.Euphytica,111:185-190.
· 蔬菜史话 ·
Zewdie Y,Bosland P W.2000b.Pungency of chile(Capsicum annuum L.)is affected by node position.HortScience,35:1174.
Analysis and QTLs Identification of Pepper Fruit Capsaicin Content under Different Cultivation Conditions
WANG Ning,ZHANG Zheng-hai,WANG Li-hao,ZHANG Bao-xi*
(Institute of Vegetables and Flowers,Chinese Academy of Agricultural Sciences,Beijing 100081,China)
Abstract:In the present study,we constructed an intraspecific genetic map by using a recombinant inbred lines crossed by pungent pepper ‘Perennial’(Capsicum annuum) and non-pungent pepper ‘83-58’,and analyzed capsaicin and dihydrocapsaicin contents investigated on a test cross progeny by non-pungent pepper ‘77013A ’and RILs (‘83-58’בPerennial’) both in greenhouse and open fields. And the differences in capsaicin content,dihydrocapsaicin content,total capsaicinoids and capsaicin/dihydrocapsaicin ratio between greenhouse and open fields were obvious. We did QTL mapping on them and found 16 QTLs located in chromosome 2,4 and 12. The major QTL cap2.1,dhp2.1,C/D2.1 and (C+D)2.1 on chromosome 2 that controlling capsaicin content,dihydrocapsaicin content,total capsaicinoids content and capsaicin/dihydrocapsaicin ratio,was detected in both greenhouse and open fields. The LOD was above 5.0,accounting for 20.2%-76.6% of the phenotypic variation. The interval markers were BD76366 and Pun1. We also found minor QTLs in P12 that regulating total capsaicinoids content in 2 environments. Other minor QTLs were not detected at the same time in these 2 environments.
Key words:Pungency;Capsaicins;Environment;QTL
基金项目:公益研究所基金项目(1610032011011),国家“863”计划项目(2012AA100103002),中国农业科学院科技创新工程项目(CAAS-ASTIP-IVFCAAS),国家科技支撑项目(2011BAZ01732),创新工程农业部大宗蔬菜技术产业体系项目(CARS-25)
收稿日期:2015-04-16;接受日期:2015-06-02
*通讯作者(
Corresponding author):张宝玺,研究员,硕士生导师,专业方向:蔬菜遗传育种,E-mail:zhangbx@caas.cn

