蔗糖调节马铃薯块茎形成机制的研究进展
巩慧玲 孙梦遥 冯再平 袁惠君(兰州理工大学生命科学与工程学院,甘肃兰州 730050)
蔗糖调节马铃薯块茎形成机制的研究进展
巩慧玲 孙梦遥 冯再平 袁惠君
(兰州理工大学生命科学与工程学院,甘肃兰州 730050)
摘 要:高浓度蔗糖对马铃薯块茎形成具有显著的促进作用,蔗糖既能作为同化物维持马铃薯植株的生长,同时也能特异性地调控结薯相关基因的表达;此外,蔗糖也参与激素对马铃薯块茎形成的调节。本文综述了蔗糖调控马铃薯块茎形成机制的研究进展。
关键词:马铃薯;块茎形成;蔗糖;综述
巩慧玲,女,博士,副教授,专业方向:植物生理学,E-mail:gonghl@ lut.cn
块茎的形成是马铃薯繁殖的一个重要途径,是由环境(如短日照、低温等)、生化和遗传因子等多种因素相互作用的复杂发育过程,马铃薯形态学(如匍匐茎的生长及其顶端的膨大)和生化水平(如淀粉的合成和贮藏蛋白的积累)的变化与块茎的形成紧密相关(Sarkar,2008)。马铃薯块茎的形成受到许多不同基因的调控,如光敏色素(phytochrome,phy)(Jackson et al.,1996)、转录因子CONSTANS(CO)(González-Schain et al.,2012)和CYCLING DOF FACTOR 1(CDF1)(Kloosterman et al.,2013),以及可在组织间移动的分子FLOWERING LOCUST(StFT/SP6A)(Navarro et al.,2011)、POTATO HOMEOBOX1(StPOTH1)(Chen et al.,2003)、StBEL5(Chen et al.,2003)和miR172(Martin et al.,2009)等,除此之外,蔗糖(Xu et al.,1998)、激素(Bou-Torrent et al.,2011)和Ca2+(Jena et al.,1989)等也参与马铃薯块茎形成的调控。
蔗糖是植物叶片光合作用的主要产物,也是大多数植物体内运输的主要同化物。蔗糖在成熟叶片合成以后,除用于自身代谢外,主要是装载到维管组织并经过长距离运输到达植物的多种异养组织利用和贮藏(黄德宝和唐朝荣,2010)。在植物生长过程中,蔗糖除了为植物提供必要的能源物质外,同时也是参与植物生长发育、细胞周期、基因表达的一种必要的信号分子(Sheen et al.,1999;Raíces et al.,2003)。植物体内存在多条糖信号系统,分别是己糖激酶信号系统、依赖已糖但不依赖己糖激酶信号系统、依赖膜的信号系统以及蔗糖作为信号分子的蔗糖信号系统(Jang et al.,1997;单守明 等,2004)。马铃薯块茎作为马铃薯植株物质积累的库器官,与蔗糖的合成、运输、代谢有着紧密的联系,由于高浓度蔗糖能诱导马铃薯结薯,并可特异性的诱导结薯相关基因的表达,从而推测蔗糖可能作为信号分子调控马铃薯块茎的形成(Jefferson et al.,1990;Prat et al.,1990;Raíces et al.,2003)。
1 蔗糖可诱导马铃薯块茎的形成
将马铃薯单节茎段在高浓度蔗糖培养基上离体培养诱导微型薯,与低浓度蔗糖培养基相比,结薯率及大薯率明显提高(胡云海和蒋先明,1989);在大棚中,将马铃薯种植在装有河沙的桶内,分别用0、4%、8%蔗糖浇灌,发现8%蔗糖浇灌条件下马铃薯植株的结薯数量以及块茎干物质量明显高于4%蔗糖浇灌和不施蔗糖的处理(王迎男 等,2015),由此表明高浓度外源蔗糖对马铃薯完整植株和离体茎段均具有促进块茎形成的作用。Viola等(2001)用14C标记CO2,当马铃薯植株通过光合作用固定14CO2后,未发生变态膨大的匍匐茎中放射性单糖含量较高,而发生变态膨大的匍匐茎中放射性蔗糖含量较高,形成较大薯块处所在匍匐茎及膨大部位的主要糖类是被14C标记的蔗糖,且进一步研究发现,马铃薯匍匐茎中起分解蔗糖作用的可溶性酸性转化酶(soluble acid inverase,SAI)活性下降也是块茎形成时期的特点,表明块茎形成过程中蔗糖在匍匐茎发生膨大处积累,块茎形成有可能是在蔗糖含量升高的情况下发生的。除了蔗糖外,也有试验证明其他糖类,如葡萄糖、果糖以及葡萄糖和果糖1∶1混合,也有类似蔗糖诱导结薯的作用,但结薯率均不如蔗糖诱导结薯率高(胡云海和蒋先明,1989;杨彩菊,2006;罗玉和李灿辉,2012)。
2 蔗糖参与调控马铃薯块茎形成相关基因的表达
马铃薯块茎的发生从本质上讲,是相关基因在个体发育过程中程序性表达的结果(Prat et al.,1990;柳俊和谢从华,2001)。研究发现,马铃薯体内有大量蔗糖积累时或将马铃薯外植体转入高浓度蔗糖培养条件时,在结薯率提高的同时,部分与结薯相关的基因如马铃薯块茎贮藏蛋白(patatin)基因、钙依赖蛋白激酶I(Calcium-dependent protein kinase1,CDPK1)基因等被特异性诱导表达。
2.1 patatin
patatin是存在于马铃薯块茎中的一种糖蛋白,占块茎可溶性蛋白的40%左右,patatin按其编码基因5′非编码区有无22 bp插入序列,可分为patatin class I和patatin class II两种类型(Racusen & Foote,1980)。Visser等(1994)研究发现,patatin class I基因表达与块茎发生在时间、空间上均具有高度一致性,所以patatin通常被认为是马铃薯块茎形成的生化指标。在马铃薯体内导入patatin class I基因,增加了patatin的生物合成,马铃薯结薯率提高(司怀军 等,2006),从而证实patatin class I与马铃薯块茎形态建成相关。patatin class I具有特异性诱导表达的特点,能被高浓度蔗糖及短日照诱导大量表达,高浓度蔗糖培养的马铃薯单节茎段中patatin class I的表达量明显高于低浓度蔗糖培养的单节茎段(Jefferson et al.,1990),暗示了蔗糖可能是通过特异性调控patatin class I的表达而诱导马铃薯结薯。
2.2CDPK1
Ca2+被认为是调控马铃薯块茎形成的重要因素之一,CDPK1是存在于植物中的一类Ca2+靶蛋白,在块茎形成早期,发现CDPK1活性明显增加,所以CDPK1的活性通常被认为与马铃薯块茎形成相关(Macintosh et al.,1996)。CDPK1只在马铃薯匍匐茎膨大的部位特异性表达,该部位同时也是马铃薯体内蔗糖大量积累的位置,而其他部位未检测到CDPK1的表达(Raíces et al.,2001)。当马铃薯单节茎段离体培养时,高浓度的蔗糖可诱导CDPK1大量表达,而其他糖类如葡萄糖、果糖以及葡萄糖和果糖1∶1则不能调控CDPK1表达(Raíces et al.,2003),说明蔗糖可能作为信号分子,通过对CDPK1特异性诱导表达从而促进结薯。
2.3蔗糖转运蛋白(sucrose transporters,SUTs)
SUTs定位于植物韧皮部筛管细胞的质膜和细胞核内膜,已知的SUTs根据其不同特性分为3个亚群:SUT1、SUT2、SUT4,其中SUT1是高亲和质子共转运蛋白载体,与韧皮部蔗糖转运和卸载相关;SUT4是低亲和性载体,可调节马铃薯植株对光照的敏感度;SUT2则可能是糖信号感受器。在SUT4-RNAi转基因马铃薯叶片中蔗糖流出量明显增加,说明SUT4可能对植株体内SUT1起到抑制作用(Izabela et al.,2008)。
目前已明确马铃薯SUT1负责蔗糖在韧皮部的装载和长距离运输(Barker et al.,2000;Kühn et al.,2003)。Riesmeier等(1994)将反义SUT1 cDNA导入马铃薯体内,叶片中大量积累可溶性糖及淀粉,最终导致马铃薯块茎的减产,从而表明蔗糖分子的主动运输对马铃薯结薯具有直接促进作用。
SUT2在蔗糖转运蛋白家族中是与蔗糖分子亲和力最弱的成员,可能不具备携带和运输蔗糖的功能,但可受蔗糖的刺激增强表达,由于SUT2具有类似酵母葡萄糖信号感受器(酵母传感蛋白)的结构,在功能上SUT2与酵母传感蛋白一样,缺少运输活力,因此推测SUT2可能是质膜上蔗糖信号感受器(Barker et al.,2000;Reinders et al.,2002;Kühn et al.,2003),而其具体功能有待进一步研究。
Chincinska等(2013)研究发现,马铃薯SUT4虽然是蔗糖转运蛋白家族的成员,但具有促进光周期信号途径中CO基因对FT基因表达的抑制作用,从而增强马铃薯对光照时间的敏感度及抑制结薯。CO基因与FT基因一直以来被认为是光周期信号通路中控制结薯最重要的两个基因,FT基因大量表达能促进马铃薯块茎的形成,CO蛋白是FT基因的转录因子(Martínez-García et al.,2002;Gonzalez-Schain et al.,2008,2012)。在长日照条件下,马铃薯叶片中感知昼夜节律的phy中的phyB首先感知光照,而后光受体E3泛素化连接酶FLAVIN-BINDING,KELCH REPEAT,F-BOX1 (FKF1)与核蛋白GIGANTEA(GI)形成复合体,该复合体能够分解CO基因的转录因子CDF1(Bjorn et al.,2013;Suetsugu & Wada,2013),使CO基因表达并积累,从而使FT基因表达受到抑制。而FKF1与GI在短日照条件下表达的不同步导致CO蛋白积累量远远少于长日照,从而使FT基因大量表达并促进结薯(Rodriguez-Falcon et al.,2006;许真 等,2008;Navarro et al.,2011;Bjorn et al.,2013)。当SUT4基因被干扰后,在长日照条件SUT4-RNAi转基因植株与野生型植株的CO基因表达量较短日照条件都有较大幅度的升高,但SUT4-RNAi转基因植株中FT基因的表达量却没有因CO蛋白含量的升高而减少,在长日照下生长的SUT4-RNAi转基因植株,FT基因表达量与在短日照条件下无明显差异(Chincinska et al.,2013),因而在长日照条件下依然能结薯。此外,Endo等(2005)发现SUT4能促进赤霉素(gibberellic acid,GA)和乙烯的生物合成,GA与乙烯也能通过反馈调节而促进SUT4的表达。
3 蔗糖参与激素对马铃薯块茎形成的调控
马铃薯在块茎发生前后植株体内的激素水平会发生一系列变化,而通过研究发现,激素不仅通过自身代谢调控结薯,同时蔗糖或糖代谢相关酶也参与激素对结薯的调控。
3.1GA
GA是与马铃薯块茎形成最密切相关的激素,GA的作用始终贯穿整个生长过程,部分外界环境对块茎形成的影响也是通过GA起作用的,比如长日照与高温条件,都因能使GA类物质含量升高而抑制结薯(刘梦芸和蒙美莲,1994;全峰 等,2002)。GA在马铃薯生长代谢中可以促进茎的伸长,抑制块茎形成,内源GA过多分泌则会使马铃薯明显减产(Izabela et al.,2008),外源施加GA也有同样的作用(刘梦芸和蒙美莲,1997)。在未加入高浓度蔗糖的块茎诱导条件下,马铃薯中分解蔗糖的转化酶(invertase,INV)活性降低,促进蔗糖合成的蔗糖合成酶(sucrose synthase,SuSy)与促进淀粉合成的淀粉磷酸化酶活性上升(Visser et al.,1994;Appeldoorn et al.,1997),当加入GA后,则没有发生上述变化,并且在高浓度蔗糖条件下,GA的加入可完全阻止块茎的发生,而导致腋芽及匍匐茎的伸长(张志军 等,2003)。进一步研究发现,GA可促进马铃薯液泡酸性转化酶(vacuolar acid invertase,vacINV)基因启动子活性,同时发现马铃薯vacINV1基因启动子序列上有8个GA应答原件(Ou et al.,2013),从而推测GA可能通过促进vacINV基因的表达而分解蔗糖从而抑制结薯。
3.2细胞分裂素(cytokinin,CTK)
CTK类物质具有促进马铃薯块茎形成的作用(Palmer & Smith,1969),通常认为CTK在促进细胞分裂的同时促进细胞分化从而促进块茎膨大(王冬梅和黄学林,1996)。将马铃薯匍匐茎在MS培养基上离体培养一段时间,当匍匐茎转入块茎诱导条件后(含有较高浓度蔗糖的培养基),匍匐茎内CTK含量明显升高(宋占午,1992);当在培养基中加入CTK后,马铃薯匍匐茎内可溶性总糖含量升高(Hawker et al.,1979;宋占午,1992),而起到分解蔗糖作用的蔗糖酶活力降低(Palmer & Barker,1972;宋占午,1992),从而表明CTK对植株体内糖代谢产生了影响,可溶性总糖含量升高可能是CTK对马铃薯块茎膨大起到促进作用的原因之一。
3.3茉莉酸(jasmonic acid,JA)
JA是亚麻酸(linolenic acid)在脂氧合酶(lipoxygenase,LOX)的作用下经过一系列生化反应合成的(Yoshihara et al.,1989;吴劲松和种康,2002),LOX是该生化反应的关键起始酶,最适温度在15 ℃左右,温度过高会抑制LOX的活性,从而减少JA的合成(Yoshihara et al.,1989;Nam et al.,2008)。当培养基中加入JA生物合成抑制剂水杨基氧肟酸(salicylhydroxamic acid,SA)后,马铃薯植株体内JA含量降低的同时,结薯率也明显降低(Yoshihara et al.,1989),所以JA被认为是具有很强的诱导块茎形成的活性物质。外源加入JA可使马铃薯植株体内蔗糖含量升高,并导致渗透压增加以及细胞壁结构变化,从而诱导细胞膨大(Takahashi et al.,1995;Viola et al.,2001),表明该激素可能是通过调控蔗糖的代谢促进结薯。
3.4脱落酸(abscisic acid,ABA)
ABA对马铃薯块茎形成作用的报道结果不一,但支持ABA对块茎发生具有促进作用的学者居多。Xu等(1998)认为ABA是通过抵消GA对块茎形成的抑制作用而促进块茎的。García等(2012)在马铃薯中克隆到一个ABA应答元件结合蛋白-AREB/ABF类转录因子,命名为StABF1,StABF1基因能被高浓度蔗糖诱导表达,且表达量随块茎的膨大而升高;将拟南芥ABF4基因转入马铃薯中,ABF4通过ABA-GA信号交联途径调控马铃薯块茎的形成(García et al.,2014)。由此推断蔗糖可能通过调控ABF的表达而参与ABA-GA信号交联途径促进结薯。
4 小结
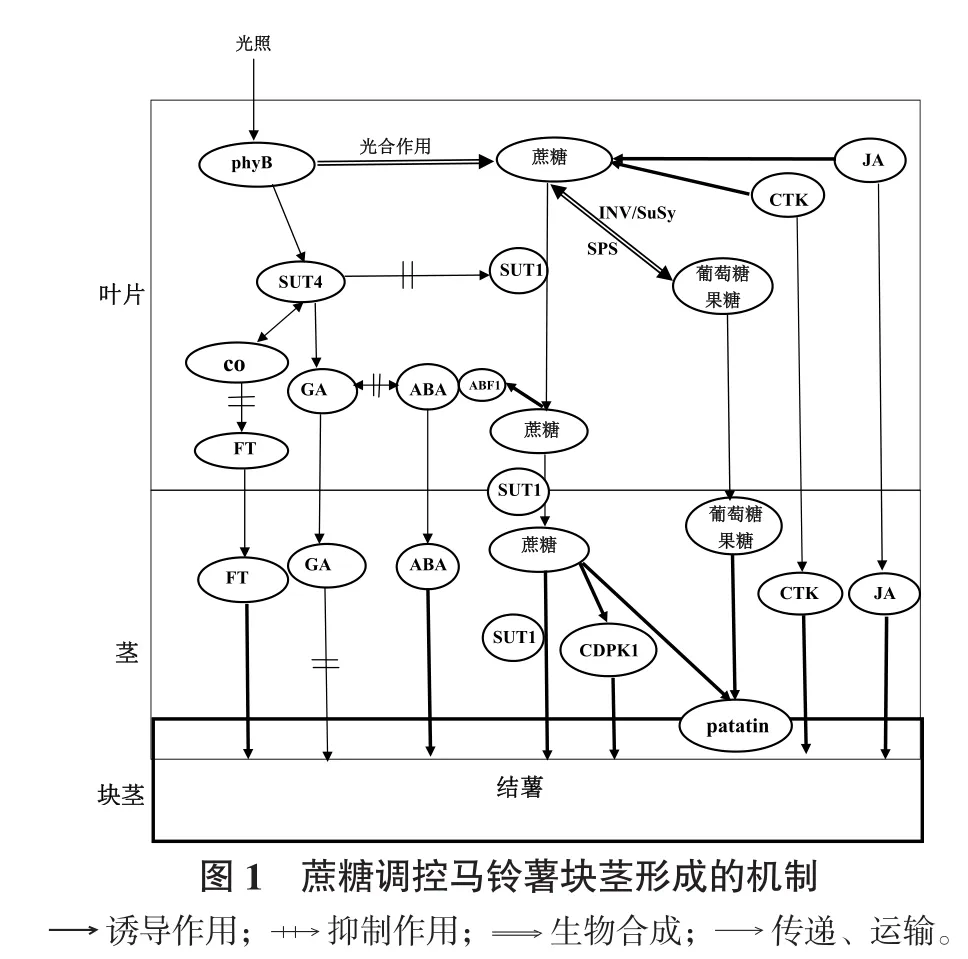
综上,高浓度蔗糖能够促进马铃薯结薯,其作用机制可能有多种途径。首先,蔗糖可特异性调控结薯相关基因如patatin class I、CDPK1等的表达而调控结薯;GA、CTK、JA等激素也能通过调节蔗糖代谢而抑制或促进块茎的形成;其次,蔗糖转运蛋白SUT1、SUT4通过主动运输蔗糖或调控结薯关键基因CO等的表达而调控结薯(图1)。但也有学者分析认为,蔗糖对马铃薯结薯的诱导作用可能是因为蔗糖更有利于马铃薯吸收和代谢(Khuri & Moorby,1995);此外,Ferreira等(2012)研究发现蔗糖在马铃薯体内降解方式的差异也会决定马铃薯块茎的产量。由此表明,高浓度蔗糖促进马铃薯结薯的机制较为复杂,必须依赖今后进一步对植物糖信号途径和蔗糖信号受体的研究才能阐明。
参考文献
胡云海,蒋先明.1989.不同糖类和6-BA马铃薯(S.Tuberosum)试管薯的影响.马铃薯杂志,3(4):203-206.
黄德宝,唐朝荣.2010.高等植物蔗糖转运的分子调控.生物技术通报,26(4):1-6.
柳俊,谢从华.2001.马铃薯块茎发育机理及其基因表达.植物学通报,18(5):531-539.
刘梦芸,蒙美莲.1994.光周期对马铃薯块茎形成的影响及对激素的调节.中国马铃薯,8(4):193-197.
刘梦芸,蒙美莲.1997.GA3、IAA、CTK和ABA对马铃薯块茎形成调控作用的研究.内蒙古农牧学院学报,18(2):16-20.罗玉,李灿辉.2012.糖类及其衍生物对马铃薯块茎形成的影响.昆明学院学报,33(6):85-89.
全峰,张爱霞,曹先维.2002.植物激素在马铃薯块茎形成发育过程中的作用.中国马铃薯,16(1):29-32.
单守明,董晓颖,王永章,刘成连,原永兵.2004.植物体中的糖信号及其转导机制.中国农学通报,20(3):12-16.
司怀军,柳俊,谢从华.2006.马铃薯class I patatin 基因在试管块茎形成中的功能.作物学报,32(9):1406-1409.
宋占午.1992.细胞分裂素对马铃薯块茎形成的影响.西北师范大学学报,28(1):55-61.
王冬梅,黄学林.1996.细胞分裂素类物质在植物组织培养中的作用机制.植物生理学报,32(5):373-377.
王迎男,秦永林,苏亚拉其其格,樊明寿.2015.外源蔗糖供应对马铃薯块茎形成的影响.马铃薯产业与现代可持续农业.哈尔滨:哈尔滨地图出版社:339-343.
吴劲松,种康.2002.茉莉酸作用的分子生物学研究.植物学通报,19(2):164-170.
谢婷婷,柳俊.2013.光周期诱导马铃薯块茎形成的分子机理研究进展.中国农业科学,46(22):4657-4664.
许真,徐蝉,郭得平.2008.光周期调节马铃薯块茎形成的分子机制.中国细胞生物学学报,30(6):731-736.
杨彩菊.2006.蔗糖诱导马铃薯块茎形成的信号分子功能研究〔硕士论文〕.昆明:云南师范大学.
张志军,贾明进,李会珍,周伟军.2003.赤霉素对马铃薯块茎形成的影响.中国马铃薯,17(5):294-297.
Appeldoorn N J G,Bruijn S M D,Koot-Gronsveld E A M,Visser R G F,Vreugdenhil D,Plas L H W.1997.Developmental changes of enzymes involved in sucrose to hexose-phosphate conversion during early tuberization of potato.Planta,202(2):220-226.
Barker L,Kühn C,Weise A,Schulz A,Gebhardt B,Hirner B,Hellmann H,Schulze W,Ward J M,Frommera W B.2000.SUT2,a putative sucrose sensor in sieve elements.Plant Cell,12(7):1153-1164.
Bjorn K,Abelenda J A,Gomez M,Marian O,Boer J.2013.Naturally occurring allele diversity allows potato cultivation in northern latitudes.Nature,495(7440):246-252.
Bou-Torrent J,Martínez-García J F,García-Martínez J L,Prat S.2011.Gibberellin A1 metabolism contributes to the control of photoperiod-mediated tuberization in potato.PLoS One,6(9):1767-1769.
Chen H,Rosin F M,Prat S,Hannapel D J.2003.Inter-acting transcription factors from the three-amino acid loop extension super class regulate tuber formation.Plant Physiology,132:1391-1404.
Chincinska I,Gier K,Krügel U,Liesche J,He H,Grimm B,Harren J M,Cristescu S M,Kühn C.2013.Photoperiodic regulation of the sucrose transporter StSUT4 affects the expression of circadianregulated genes and ethylene production.Frontiers in Plant Science,4(2):55-60.
Endo M,Nakamura S T,Mochizuki N,Nagatani A.2005.Phytochrome B in the mesophyll delays flowering by suppressing FLOWERING LOCUS T expression in Arabidopsis vascular bundles.Plant Cell,17(7):1941-1952.
Ferreira S J,Sonnewald U .2012.The mode of sucrose degradation in potato tubers determines the fate of assimilate utilization. Frontiers in Plant Science, 3(4):1-18.
García M N M,Giammaria V,Grandellis C,Téllez-Iñón M T,Ulloa R M,Capiati D A.2012. Characterization of StABF1,a stressresponsive bZIP transcription factor from Solanum tuberosum L. that is phosphorylated by StCDPK2 in vitro.Planta,235(4):761-778.
García M N M,Stritzler M,Caoiati D A.2014.Heterologous expression of Arabidopsis ABF4 gene in potato enhances tuberization through ABA-GA crosstalk regulation.Planta,239(3):615-631.
González-Schain N D,Díaz-Mendoza M,Zurczak M,Suárez-López P.2012.Potato CONSTANS is involved in photoperiodic tuberization in a graft-transmissible manner.Plant Journal,70(4):678-690.
Gonzcllez-Schain N D,Suarez-Lopez P.2008.CONSTANS delays flowering and affects tuber yield in potato.Biologia Plantarum,52 (2):251-258.
Hawker J S,Marschner H,Krauss A.1979.Starch synthesis in developing potato tubers.Physiologia Plantarum,46(1):25-30.Izabela A C,Liesche J,Krügel U,Michalska J,Geigenberger P,Grimm B,Kühn C,Chincinska A.2008.Sucrose transporter StSUT4 from potato affects flowering,tuberization,and shade avoidance response.Plant Physiology,146(2):515-528.
Jackson S,Heyer A,Dietze J,Prat S.1996.Phytochrome B mediates the photoperiodic control of tuber formation in potato.The Plant Journal,9(2):159-166.
Jang J C,Leon P,Zhou L ,Sheen J.1997.Hexokinase as a sugar sensor inhigher plants.Plant Cell,9(1):5-19.
Jefferson R,Goldsbrough A,Bevan M.1990.Transcriptional regulation of a patatin-1 gene in potato.Plant Molecular Biology,14(6):995-1006.
Jena P K,Reddy A S,Poovaiah B W.1989.Molecular cloning and sequencing of a cDNA for plant calmodulin: signal-induced changes in the expression of calmodulin.Proceedings of the National Academy of Sciences of the United States of America,86(10):3644-3648.
Khuri S,Moorby J.1995.Investigations into the role of sucrose in potato cv.Estima microtuber production in vitro.Annals of Botany,75 (3):295-303.
Kloosterman B,Abelenda J A,Gomez M M,Oortwijn M,de Boer J M,Kowitwanich K,Horvath B M,van Eck H J,Smaczniak C,Prat S,Visser R G,Bachem C W.2013.Naturally occurring allele diversity allows potato cultivation in northern latitudes. Nature,495 (7440):246-250.
Kühn C,Hajirezaei M R,Fernie A R,Roessner-Tunali U,Czechowski T,Hirner B,Frommer W B.2003.The sucrose transporter StSUT1 localizes to sieve elements in potato tuber phloem and influences tuber physiology and development.Plant Physiology,131(1):102-113.
Macintosh G C,Ulloa R M,Raíces M,Téllez-Iñón M T.1996. Changes in calcium-dependent protein kinase activity during in vitro tuberization in potato. Plant Physiology,112(4):1541-1550.
Martin A,Adam H,Díaz-Mendoza M,Zurczak M,González-Schain N D,Suárez-López P.2009.Graft-transmissible induction of potato tuberization by the microRNA miR172.Development,136:2873-2881.
Martínez-García J F,Virgo's-Soler A,Prat S.2002.Control of photoperiod-regulated tuberization in potato by the Arabidopsis flowering-time gene CONSTANS.Proceedings of the National Academy of Sciences,99(23):15211-15216.
Nam K H,Kong F,Matsuura H,Takahashi K,Nabeta K,Yoshihara T.2008.Temperature regulates tuber-inducing lipoxygenasederived metabolites in potato (Solanum tuberosum).Journal of Plant Physiology,165(2):233-238.
Navarro C,Abelenda J A,Cruz-Oró E,Cuéllar C A,Tamaki S,Silva J,Shimamoto K,Prat S.2011.Control of flowering and storage organ formation in potato by FLOWERING LOCUST.Nature,478:119-122.
Ou Y,Song B,Liu X,Xie C,Li M,Lin Y.2013.Promoter regions of potato vacuolar invertase gene in response to sugars and hormones.Plant Physiology and Biochemistry,69(8):9-16.
Palmer C E,Smith O E.1969.Cytokinins and tuber initiation in the potato Solanum tuberosum L.Nature,221(5177):279-280
Palmer C E,Barker W G.1972.Changes in enzyme activity duringelongation and tuberization of stolons of Solanum tuberosum L. cultured in vitro.Plant & Cell Physiology,13(4):681-688.
Prat S,Frommer W B,Hofgen R.1990.Gene expression during tuber development in potato plants.Febs Letters,268(2):234-338.Racusen D,Foote M.1980.A major soluble glycoprotein of potato tubers.Journal of Food Biochemistry,4(1):43-52.
Raíces M,Chico J M,Téllez-Iñón M T,Ulloa R M.2001.Molecular characterization of StCDPK1,a calcium-dependent protein kinase from Solanum tuberosum that is induced at the onset of tuber development.Plant Molecular Biology,46(5):591-601.
Raíces M,Ulloa R M,MacIntosh G C,Crespi M,Téllez-Iñón M T.2003.StCDPK1 is expressed in potato stolon tips and is induced by high sucrose concentration.Journal of Experimental Botany,54 (392):2589-2591.
Riesmeier J W,Willmitzer L,Frommer W B.1994.Evidence for an essential role of the sucrose transporter in phloem loading and assimilate partitioning.The EMBO Journal,13(1):1-7.
Reinders A,Schulze W,Kühn C,Barke L,Schulz A,Ward J M,Frommer W B.2002.Protein-protein interactions betweensucrose transporters of different affinities colocalized in thesame enucleate sieve element.Plant Cell,14(7):1567-1577.
Rodríguez-Falcón M,Bou J,Prat S.2006.Seasonal control of tuberization in potato:conserved elements with the flowering response.Annual Review of Plant Biology,57:151-180.
Sarkar D.2008.The signal transduction pathways controlling in planta tuberization in potato: an emerging synthesis.Plant Cell Report, 27(1):1-8.
Sheen J,Zhou L,Jang J C.1999.Sugars as signaling molecules.Current Opinion in Plant Biology,2(5):410-418.
Suetsugu N,Wada M.2013.Evolution of three LOV blue light receptor families in green plants and photosynthetic stramenopiles:Phototropin,ZTL/FKF1/LKP2 and aureochrome.Plant & Cell Physiology,54(1):8-23.
Takahashi K,Fujino K,Kikuta Y,Koda Y.1995.Involvement of the accumulation of sucrose and the synthesis of cell wall polysaccharides in the expansion of potato cells in response to jasmonic acid.Plant Science,111(95):11-18.
· 信息 ·
Viola R,Roberts A G,Haupt S,Gazzani S,Hancock R D,Marmiroli N,Machray G C,Oparka K J.2001.Tuberization in potato involves a switch from apoplastic to symplastic phloem unloading.The Plant Cell,13(2):385-398.
Visser R G F,Vreugdenhil D,Hendriks T,Jacobsen E.1994.Gene expression and carbohydrate content during stolon to tuber transition in potatoes (Solanum tuberosum).Physiologia Plantarum,90(2):285-292.
Xu X,van Lammeren A A,Vermeer E,Vreugdenhil D.1998.The role of gibberellin,abscisic acid,and sucrose in the regulation of potato tuber formation in vitro.Plant Physiology,117:575-584.Yoshihara T,Omer E A,Koshino H,Sakamura S,Kikuta Y,Koda Y.1989.Structure of a tuber-inducing stimulus from potato leaves (Solanum tuberosum L.).Agricultural and Biological Chemistry,53(10):2835-2837.
A Review of Studies on Mechanism of Regulating Potato Tuberization by Sucrose
GONG Hui-ling,SUN Meng-yao,FENG Zai-ping,YUAN Hui-jun
(College of Life Science and Engineering,Lanzhou University of Technology,Lanzhou 730050,Gansu,China)
Abstract:High concentration of sucrose can significantly promot potato tubeization.Sucrose can not only maintain the growth of potato plant,but also specifically regulate the expression of tuberization-related genes.Moreover,sucrose is also involved in the process of regulating tuberization by hormones. This paper reviews the research progress made in studying mechanism of regulating potato tuberization by sucrose.
Key words:Potato;Tuberization;Sucrose;Review
基金项目:甘肃省自然科学基金项目(1308RJZA209),国家自然科学基金项目(31360296)
收稿日期:2016-02-01;接受日期:2016-02-26

