不同基因型黄瓜性别与乙烯释放速率的关系
崔清志 陈 宸 田 云 刘晓虹 陈惠明
(1中南大学隆平分院,湖南长沙 410125;2湖南省蔬菜研究所,湖南长沙 410125;3湖南农业大学生物科学技术学院,湖南长沙 410128)
崔清志,男,硕士,专业方向:蔬菜学,E-mail:liaodaqingzhi@126.com*通讯作者(Corresponding author):陈惠明,研究员,专业方向:黄瓜性别研究与黄瓜育种,E-mail:huiminghm@163.com
不同基因型黄瓜性别与乙烯释放速率的关系
崔清志1,2陈 宸3田 云3刘晓虹2陈惠明2*
(1中南大学隆平分院,湖南长沙 410125;2湖南省蔬菜研究所,湖南长沙 410125;3湖南农业大学生物科学技术学院,湖南长沙 410128)
崔清志,男,硕士,专业方向:蔬菜学,E-mail:liaodaqingzhi@126.com*通讯作者(Corresponding author):陈惠明,研究员,专业方向:黄瓜性别研究与黄瓜育种,E-mail:huiminghm@163.com
摘 要:采用气相色谱法测定全雄株(ffMMaa)、雌雄同株(ffMMAA)、全雌株(FFMMaa、FFMMAA)和两性花株(FFmmAA)不同基因型近等基因系材料间的乙烯释放速率,探讨乙烯与黄瓜性型的关系。结果表明,不同近等基因系乙烯释放速率之间存在显著性差异。全雄株78♂(ffMMaa)的乙烯释放速率较低;雌雄同株406(ffMMAA)四叶一心期的乙烯释放速率大于两叶一心期;含6.33个F基因拷贝数的雌性系10098♀(FFMMaa)与F基因拷贝数为2.15的雌性系WI1983G(FFMMAA)相比,乙烯释放速率较低;雌性系WI1983G(FFMMAA)的乙烯释放速率极显著高于两性花株WI1983H(FFmmAA),两性花株WI1983H 又极显著高于雌雄同株WI1983GM(ffMMAA);说明黄瓜性别表型与内源乙烯密切相关。从试验结果推断:雄株(ffMMaa)中乙烯释放速率低可能与A基因失活相关,雌性系(FFMMaa)乙烯释放速率可能受A/a基因的调控,两性花株(FFmmAA)中虽然M基因失活但内源乙烯释放速率并未降低很多,可能F基因产生的内源乙烯没有直接作用到两性花的雄蕊上。
关键词:黄瓜;近等基因系;性别;乙烯
黄瓜不仅是具有重要经济价值的园艺作物,而且是研究性别决定及维管束生物学的模式植物(Malepszy & Niermirowicz-Szczytt,1991;Lough & Lucas,2006)。黄瓜的性别主要由3个基因(全雌性F、两性花M和全雄系A)、其他修饰基因(雌性增强基因In-F、三性花基因Tr、隐性雌性基因gy、两性花基因m-2)与环境条件、激素等因素相互作用共同调控(Galun,1962;Kubicki,1969a,1969b,1969c,1969d)。F、M、A3种主要基因共同作用形成不同的性别类型:全雌(F_M_)、全雄(ffM_ aa)、雌雄同株(ffM_A_)、两性花株(FFmmA_)和雄花两性花株(ffmmA_)(Perl-Treves,1999)。此外,Chen等(2011)新发现了2个与F、M基因独立遗传的强雌主效基因Mod-F1和mod-F2,植株末端(11~40节位)表现为连续雌花节。
乙烯是黄瓜的性激素(Yin & Quinn,1995),近年来随着研究的深入,乙烯生物合成相关基因与黄瓜性别控制基因的关系逐渐清晰,乙烯通过抑制雄蕊发育从而促进雌花发育(Bai et al.,2004)。目前决定黄瓜性别类型的雌性基因F、两性花基因M均已被克隆,两者均编码乙烯生物合成的关键酶ACS(Mibus & Tatlioglu,2004;Knopf & Trebitsh,2006;Boualem et al.,2009;Li et al.,2009)。但是由于材料的限制,特别是雄株的消失,不能较系统地分析乙烯与性型的关系。湖南省蔬菜研究所黄瓜课题组研究黄瓜性别表达逾20年,获得了多份基因型清楚的雌性系、雌雄同株、两性花株、全雄株近等基因系材料,通过气相色谱法测定了几对近等基因系间不同性型乙烯释放速率的差异,分析了不同基因型与乙烯释放量的关系,以期为探索黄瓜性别决定模型奠定基础。
1 材料与方法
1.1试验材料
供试材料为多年来获得的多对不同性型的近等基因系,均由湖南省蔬菜研究所黄瓜课题组提供。黄瓜亲本均为自交纯合的品系(表 1)。

表1 供试的黄瓜材料及基因型
1.2试验方法
试验于2014 年4~10月在湖南省蔬菜研究所实验大楼和网室大棚内进行。
1.2.1植物材料准备 不同性型的黄瓜种子用50℃水浸泡30 min后放在湿润的双层滤纸上,置于25 ℃条件下催芽24 h,取发芽一致的种子播在穴盘中,放置在人工气候室内28 ℃14 h光照,18 ℃10 h黑暗培养;待植株长到两叶一心、四叶一心时取样(Yamasaki et al.,2001)。茎尖取样:黄瓜性别决定比较早,花芽分化在苗期就已经开始,因此取样时要把第1片展开的真叶及肉眼能看到的雌雄花花芽剥离,取幼嫩的茎尖。
1.2.2样品材料的培养 不同性型的黄瓜材料称取0.2~0.4 g茎尖(约4个单株的茎尖),然后将茎尖迅速置于底部放有用蒸馏水润湿的脱脂棉的瓶中,加盖并用封口膜封口,每份材料设3个生物学重复;取完所有的样品后,将样品置于黑暗的恒温培养箱中,25 ℃、黑暗培养12 h,之后取2 mL瓶内气体,乙烯测定在中国科学院亚热带农业生态研究所进行。
1.2.3气相色谱条件 参考邢虎成等(2008)的方法,采用相同的气相色谱条件测定不同性型黄瓜样品乙烯浓度。 Agilent 7890A型气相色谱仪;色谱柱:HP-5〔5%(毛细管柱)Phenyl Methyl Siloxan;Capillary:30.0 m× 320 μm×0.25 μm〕,FID检测器,柱温50 ℃;隔垫吹扫流速:3 mL·min-1,辅助加热区温度:375 ℃,氢离子火焰检测器(FID),检测器温度250 ℃;载气 N2流速 18 mL·min-1;燃气H2流速50 mL·min-1;空气流速500 mL·min-1;运行时间表:0.01 min阀1打开,9 min阀1关闭;样气稀释10倍,即注入顶空瓶18 mL N2,自动上样,气相色谱仪上进行测定,气样进样流速为1.5 mL·min-1,重复测定 3次。
1.2.4标准曲线的绘制 从纯度为99.999%的乙烯标样中抽取10 mL,注射入500 mL的气袋中,加90 mL N2进行稀释,稀释后浓度为10%,用注射器抽取10 mL继续稀释标样;标样浓度梯度依次为10%、1%、0.1%、0.01%、0.001%、0.000 1%、0.000 01%,用气相色谱法进行测定,得到峰面积与样品浓度标准曲线。
1.2.5乙烯释放速率的差异显著性分析 乙烯浓度测定后,根据公式计算乙烯释放速率,并利用excel软件对乙烯释放速率进行差异显著性分析。
乙烯释放速率(mL·g-1·h-1)=〔乙烯浓度(mL· L-1)×稀释倍数×容器体积(L)〕/〔茎尖鲜质量(g)×密封时间(h)〕
1.2.6性状调查 在黄瓜整个生育期调查各群体每个单株从第1节到植株末端各节位的花芽分化情况。统计各群体每个单株的开花节位数和雌花节位数,计算雌花率。
雌花率=雌花节位数/开花节位数×100%
2 结果与分析
2.1基因型为ffMMaa的雄株与近等基因系雌雄同株(ffMMAA)乙烯释放速率的分析
由图1可知,雄株78♂(ffMMaa)乙烯释放速率较低。在两叶一心期雄株78♂(ffMMaa)与雌雄同株406(ffMMAA)的乙烯释放速率无极显著差异,但随着植株的生长,雌雄同株406的乙烯释放速率加大,在四叶一心期高于雄株78♂0.92倍,达极显著水平,而雄株78♂的乙烯释放速率基本没有变。
据报道,两叶一心期性别已经分化到6节左右,四叶一心期性别决定分化到12节左右(任吉君和王艳,1994),从表2中可以看出,雄株78♂的1~12节全为雄花,而且整个生育期植株全部开雄花。雌雄同株406的1~5节开雄花,当第6节出现第1朵雌花后,406的乙烯释放速率极显著高于没有雌花节位的78♂雄株,表明乙烯释放速率与植株的雌花节位分化基本一致。雄株(ffMMaa)因A基因不表达,乙烯释放速率比基因型为ffMMAA的雌雄同株低。
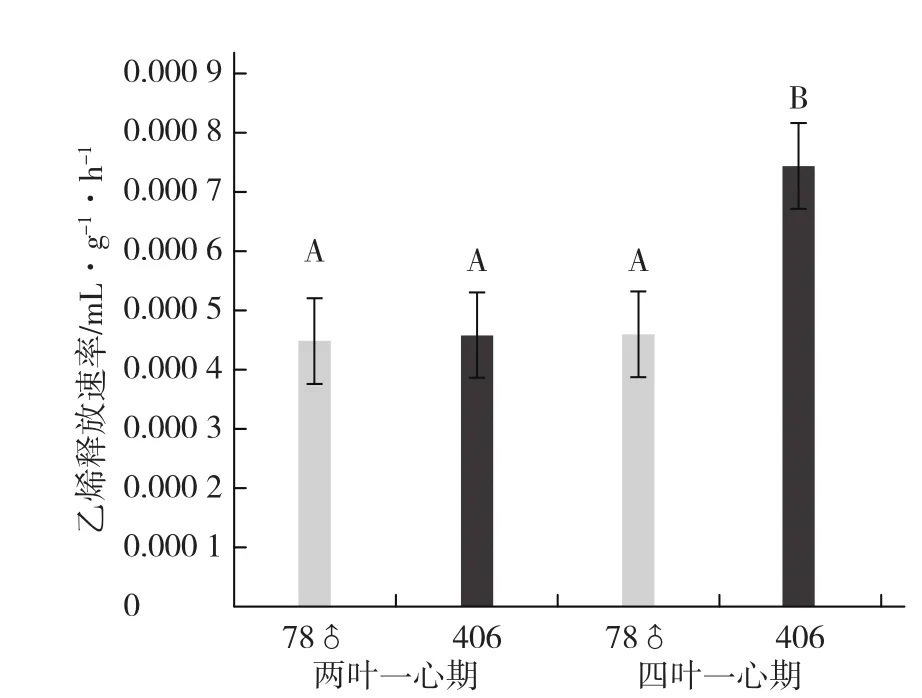
图1 不同材料不同时期乙烯释放速率图柱上不同大写字母表示差异极显著(α=0.01)。

表2 雄株78♂与雌雄同株406不同时期花性比较
2.2基因型为ffMMaa的雄株与近等基因系雌性株(FFMMaa)乙烯释放速率的分析
由图2可知,植株四叶一心期基因型为FFMMaa的雌性系10098♀的乙烯释放速率显著高于基因型为ffMMaa的近等基因系雄株10098♂,说明F/f基因的差异可导致乙烯释放速率不同,证实了由于雌性系中特有的F基因多了 1个拷贝 的ACC 合酶基因,造成了植株茎尖的乙烯释放量大大增加(Trebitsh et al.,1997)。
四叶一心期基因型为ffMMAA的雌雄同株406的乙烯释放速率比雄株78♂(ffMMaa)高0.92倍(图1),前12节雌花率为30%(表2),而基因型为FFMMaa的雌性系10098♀四叶一心期的乙烯释放速率仅比雄株10098♂(ffMMaa)高0.38倍,前12节雌花率为70%(表3)。雌性系10098♀(FFMMaa)与雌雄同株406(ffMMAA)遗传背景不一致,雌性系10098♀能在乙烯释放速率较低时完成雌性系的分化,由此推断在雌性系中,每一节位性别决定时对乙烯比较敏感,较低浓度的乙烯即可促进雌花发育。Duan等(2008)研究了在拟南芥雄蕊中特异表达的CSACO2基因,进一步证实了乙烯促雌是由于抑制了雌花中雄蕊的发育,并提出各器官中雄蕊是感受乙烯最敏感的部位。

图2 不同材料四叶一心期乙烯释放速率图柱上不同小写字母表示差异显著(α=0.05)。
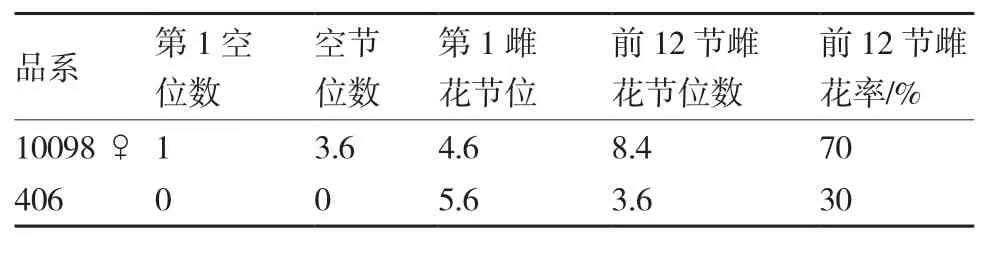
表3 雌性系10098♀与雌雄同株406前12节雌花比较
2.3不同基因型雌性系(FFMMAA、FFMMaa)间乙烯释放速率的比较
从图3可以看出,基因型为FFMMAA的雌性系WI1983G的乙烯释放速率极显著高于近等基因系雌雄同株WI1983GM(ffMMAA),是其乙烯释放速率的3倍左右,与 Perl-Treves(1999)阐述的雌性系茎尖乙烯释放速率比雌雄性系高2~3倍的结论一致。但是含有6.33个F基因拷贝数的雌性系10098♀(FFMMaa)的乙烯释放速率略高于基因型为ffMMaa的雄株10098♂,仅高0.38倍。已有试验证实(Rudich et al.,1978),雌雄同株的乙烯释放速率大于雄株,因此比较两个雌性系与其近等基因系的乙烯释放速率可以看出,雌性系10098♀相对近等基因系的乙烯释放速率较低。
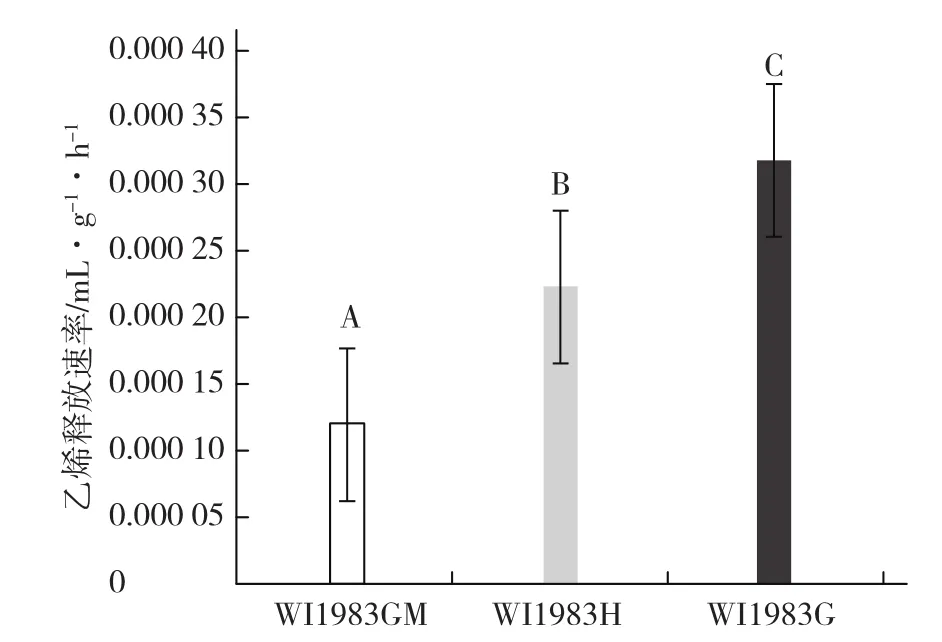
图3 不同材料四叶一心期乙烯释放速率图柱上不同大写字母表示差异极显著(α=0.01)。
田间性状调查中发现,同时期种植的不同性型材料,基因型为FFMMaa的雌性系10098♀与基因型为FFMMAA 的雌性系WI1983G相比,第1雌花节位较高(表4),10098♀的前3~4节为空节位,没有雌花开放。 Shiber等(2008)通过RNA干扰技术对17个不同的雌性系的CsACS1G转录水平进行抑制后发现,雌性系植株第1雌花节位上移,说明F基因转录被干扰会出现雌花节位的上移。F基因拷贝数为6.33的10098♀的乙烯释放速率比F基因拷贝数为2.15的WI1983G低,可能是由于10098♀(FFMMaa)的A基因不表达,F基因需要启动其他途径才能完成显性上位作用,之后,才能进一步完成促雌作用。说明F基因的表达可能受A基因调控。
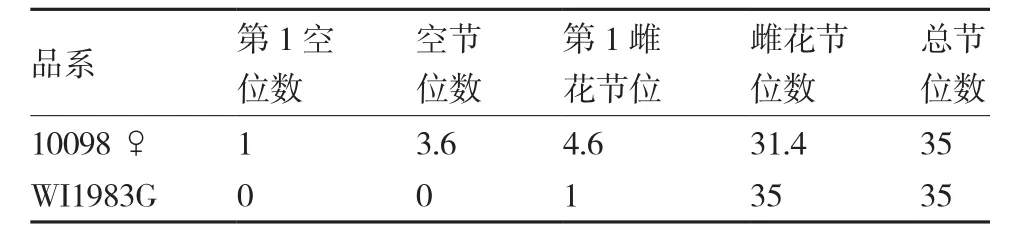
表4 雌性系10098♀与WI1983G的雌花节位比较
2.4不同基因型FFMMAA、FFmmAA、ffMMAA近等基因系雌性系、两性花株、雌雄同株间乙烯释放速率的分析
F、M基因控制乙烯合成的关键限速酶ACS。由图3可知,雌性系WI1983G(FFMMAA)的乙烯释放速率极显著高于CS-ACS2基因失活的两性花株WI1983H(FFmmAA),高1.4倍,验证了乙烯释放速率受乙烯合成关键限速酶M基因的调控。两性花株WI1983H的乙烯释放速率又极显著高于雌雄同株WI1983GM(ffMMAA),高1.8倍,说明F基因失活比M基因失活对乙烯释放速率的影响更大。
田间调查发现,雌雄同株WI1983GM有10%的雌花率,说明在乙烯释放速率较低的WI1983GM中,有一定节位花芽由于乙烯抑雄作用而产生雌花;乙烯释放速率最高的雌性系WI1983G每一节都发生了乙烯抑雄作用,雌花率为100%;而乙烯释放速率居中的两性花株WI1983H,在整个生育期内都只开两性花,说明两性花株的雄蕊原基没有受到乙烯的抑制作用,可能是因为在基因型为FFmmAA的两性花株中,F基因表达产生的乙烯并没有直接作用于两性花中的雄蕊原基。
3 结论与讨论
目前,控制黄瓜两性花的M基因和控制黄瓜全雌的F基因均已被克隆,两者均编码乙烯生物合成的关键酶ACC合酶。本试验中近等基因系雌性系WI1983G(FFMMAA)的乙烯释放速率极显著高于两性花株WI1983H(FFmmAA)和雌雄同株WI1983GM(ffMMAA),证实了F、M基因的不同可导致乙烯释放速率的不同。在雌性系中,由于F基因合成的乙烯进一步促进了M基因的表达,2个乙烯合成关键基因共同表达释放的乙烯量要大于在两性花中只有F一个基因表达释放的乙烯量,更大于没有F基因反馈促进M基因表达的雌雄同株(Li et al.,2012)。
分析图1中雌雄同株406(ffMMAA)与雄株78♂(ffMMaa)发现,两材料间仅由于A/a基因的不同导致了乙烯释放速率不同,即f、a基因同时存在时乙烯释放速率非常低,不能促进雌花发育,在f、A基因同时存在时可以合成一定量的乙烯,促进雌花发育,形成一定比率的雌花。根据乙烯抑制雄花产生的理论,雌雄同株应有乙烯合成,从而抑制了雄蕊的发育,产生雌花;而雄株在基因A失活时,没有足够的乙烯抑制雄蕊的发育,只产生雄花。如果此假设成立,那么a基因使雄性增强,可能是由于乙烯合成途径受阻,不能合成足够的乙烯抑制雄花的发育,导致雌花率下降。也解释了在基因型为FFMMaa的雌性系10098♀中,由于乙烯合成途径的受阻,使其第1雌花节位上升,但由于植物体中存在多种乙烯合成的途径,虽然A基因失活,F、M基因仍可通过其他途径合成乙烯,抑制雄蕊发育使其开雌花。
大量试验证实,对雌雄同株喷施外源乙烯会提高植株的雌花率,对两性花株喷施外源乙烯也会有雌花开放(Rudich et al.,1969)。图3中两性花株WI1983H(FFmmAA)的乙烯释放速率极显著高于10%雌花率的雌雄同株WI1983GM(ffMMAA),说明两性花株中M基因失活,F基因产生的乙烯可能没有作用于雄蕊原基中。也许F/f基因释放的乙烯只是作为一种信号促进M基因的表达,不会作用于雄蕊中。Saito(2007)通过原位杂交雌性系花芽,首先在花芽分化的两性花期检测到了CS-ACS2在雌蕊原基表达,且随着花的发育,CS-ACS2的mRNA继续在雌花原基中累积;但同时检测雌雄同株CS-ACS2的累积随节位的不同而不同。说明M基因在雌花原基表达过程中产生的乙烯直接作用于雄蕊原基,从而影响花芽的分化。
因此可以猜测,在基因型为FFMMAA的雌性系中,由于F基因表达产生大量乙烯,产生的乙烯不断促进M基因的表达,从而产生更多的乙烯,乙烯不断抑制雄蕊发育,使每一节都开雌花。在基因型为FFMMaa的雌性系中,A基因与乙烯合成相关,当A基因不表达时,F基因显性上位作用通过其他途径合成乙烯,进而促进M基因的表达,形成雌性系。基因型为FFmmAA的两性花株,由于M基因的失活,F基因不能促进M基因的表达,且产生的乙烯不能作用于两性花原基,因此形成两性花株。在基因型为ffMMaa的雄株中,当A基因失活时,f基因不能合成乙烯促进M基因的表达,没有乙烯抑制雄蕊的发育,从而产生雄株。当A基因正常表达时,f基因(即CS-ACS1基因)可以合成一定量的乙烯,但是合成乙烯的量不是很多,作为信号来说不是特别强烈。在不同性别决定时期,f基因可能受环境的影响,f基因表达量升高时产生的乙烯量会促进M基因的表达,形成雌花,当f基因表达量低时不能促进M基因的表达则形成雄花,所以造成了雌、雄花相间,形成雌雄同株。
参考文献
任吉君,王艳.1994.黄瓜性别决定解剖学研究.北方园艺,(4):46-47.
邢虎成,佘玮,罗中钦,秦占军,揭雨成.2008.苎麻性别分化与乙烯的关系研究.中国农业科学,41(5):1423-1428.
Bai S L,Peng Y B,Cui J X,Gu H T,Xu L Y,Li Y Q,Xu Z H,Bai S N.2004.Developmental analyses reveal early arrests of the spore-bearing parts of reproductive organs in unisexual flowers of cucumber(Cucumis sativus L.).Planta,220:230-240.
Boualem A,Troadec C,Kovalski I,Sari M A,Perl-Treves R, Bendahmane A.2009.A conserved ethylene biosynthesis enzyme leads to andromonoecy in two cucumis species.PLoS One, 4(7):e6144.
Chen H M,Tian Y,Lu X Y,Liu X H.2011.The inheritance of two novel subgynoecious genes in cucumber(Cucumis sativus L.).Scientia Horticulturae,127(3):464-467.
Duan Q H,Wang D H,Xu Z H,Bai S N.2008.Stamen development in Arabidopsis is arrested by organ-specific overexpression of a cucumber ethylene synthesis gene CsACO2.Planta,228(4):537-543.
Galun E.1962.Study of the inheritance of sex expression in the cucumber.The interaction of major genes with modifying genetic and non-genetic factors.Genetica,32(1):134-163.
Knopf R R,Trebitsh T.2006.The female-specific Cs-ACS1G gene of cucumber.A case of gene duplication and recombination between the non-sex-specific 1-aminocyclopro -pane-1-carboxylate synthase gene and a branched-chain amino acid transaminase gene.Plant and Cell Physiology,47(9):1217-1228.
Kubicki B.1969a.Investigations of sex determination in cucumber (Cucumis sativus L.).IV.Multiple alleles of locus Acr.Genetica Polonica,(10):23-68.
Kubicki B.1969b.Investigations of sex determination in cucumber (Cucumis sativus L.).V.Genes controlling intensity of femaleness.Genetica Polonica,(10):69-86.
Kubicki B.1969c.Investigations on sex determination in cucumbers (Cucumis sativus L.).VI.Androecism.Genetica Polonica,(10):87-99.
Kubicki B.1969d.Investigations of sex determination in cucumber (Cucumis sativus L.).VII.Trimonoecism.Genetica Polonica,(10):123-143.
Li Z,Huang S W,Liu S Q,Pan J S,Zhang Z H,Tao Q Y,Shi Q X,Cai R.2009.Molecular isolation of the M gene suggests that a conserved-residue conversion induces the formation of bi-sexual flowers in cucumber plants.Genetics,182(4):1381-1385.
Li Z,Wang S,Tao Q Y,Pan J S,Si L T,Gong Z H,Cai R.2012.A putative positive feedback regulation mechanism in CsACS2 expression suggests a modified model for sex determination in cucumber(Cucumis sativus L.).Journal of Experimental Botany,63(12):4475-4484.
Lough T J,Lucas W J.2006.Integrative plant biology:role of phloem long-distance macromolecular trafficking.Annu Rev Plant Biol,(57):203-232.
Malepszy S,Niermirowicz-Szczytt K.1991.Sex determination in cucumber(Cucumis sativus L.)as a model system for molecular biology.Plant Sci,(80):39-40.
Mibus H,Tatlioglu T.2004.Molecular characterization and isolation of the F/f gene for femaleness in cucumber(Cucumis sativus L.).Theoretical and Applied Genetics,109(8):1669-1676.
Perl-Treves R.1999.Male to female conversion along the cucumbershoot:approaches to studying sex genes and floral development in Cucumis sativus//Ainsworth C.Sex Determination in Plants.Oxford,UK:Bios Scientific Publishers:189-216.
Rudich J,Halevy A H,Kedar N.1969.Increase in femaleness of three cucurbits by treatment with ethrel,an ethylene releasing compound.Planta,86(1):69-76.
Rudich J,Baker L R,Sell H M.1978.Ethylene evolution during germination of different sex phenotypes of cucumber.Scientia Horticulturae,9(1):7-14.
Saito S.2007.Correlation between development of female flower buds and expression of the CS-ACS2 gene in cucumber plants.Journal of Experimental Botany,58(11):2897-2907.
Shiber A,Gaur R K,Rimon-Knopf R,Zelcer A,Trebitsh T,Pitrat M.2008.The origin and mode of function of the Female locus in cucumber//Pitral M.Proceedings of the IXth EUCARPIA meeting on genetics and breeding of Cucurbitaceae.INRA,Avignon(France):263-268.
· 信息 ·
Trebitsh T,Staub J E,O’Neill S D.1997.Identification of a 1 -Aminocyclopropane-1 -Carboxylic acid synthase gene linked to the female(F)locus that enhances female sex expression in cucumber .Plant Physiol,113(3):987-995.
Yamasaki S,Fu N,Matsuura S,Mizusawa H,Takahashi H.2001.The M locus and ethylene -controlled sex determination in andromonoecious cucumber plants.Plant Cell Physiology,42(6):608-619.
Yin T,Quinn J A.1995.Tests of a mechanistic model of one hormone regulating both sexes in Cucumis sativus(Cucurbitaceae).American Journal of Botany,82(12):1537-1546.
Relationship between Cucumber Sex of Different Genotypes and Ethylene Release Rate
CUI Qing-zhi1,2,CHEN Ceng3,TIAN Yun3,LIU Xiao-hong2,CHEN Hui-min2*
(1Longping Branch of Central South University,Changsha 410125,Hunan,China;2Vegetable Research Institute of Hunan Province,Changsha 410125,Hunan,China;3College of Bioscience and Biotechnology,Hunan Agricultural University,Changsha 410128,Hunan,China)
Abstract:This paper measured the ethylene release rates in different cucumber genotypes including ffMMaa,ffMMAA,FFMMaa,FFMMAA,and FFmmAA by gas chromatography,to study the relationship between ethylene and cucumber sex genotypes. The results showed that there were significant differences between the ethylene release rates in the near-isogenic lines. The ethylene release rate of ffMMaa in androecious 78♀was the lower. That of ffMMAA in monoecious 406 at the 4-leave stage was higher than at the 2-leave stage. The ethylene release rate of gynoecious 10098♀ with FFMMaa genotype,which had 6.33 F gene copies was lower than that of the gynoecious WI1983G with FFMMAA genotype,which had 2.15 F gene copies. The ethylene release rate of gynoecious WI1983G(FFMMAA) was extremely significantly higher than nearly isogenic line hermaphrodite WI1983H (FFmmAA),while that of WI1983H was extremely significantly higher than that of monoecious WI1983GM (ffMMAA). These facts indicated that cucumber sex genotype was closely associated with endogenous ethylene. The low ethylene release rate in androecious (ffMMaa) might be associated with A gene inactivation. The ethylene release rate of gynoecious (FFMMaa)could be regulated by A/a gene. Although M gene in hermaphrodite (FFmmAA) was inactive,endogenous ethylene release rate did not reduce much,the endogenous ethylene synthesized by F gene might have not directly affected the stamens inhibition in bisexual flower.
Key words:Cucumber;Near-isogenic lines;Sex ;Ethylene
基金项目:国家自然科学基金项目(31471871)
收稿日期:2015-03-10;接受日期:2015-11-16

