枫香人工林凋落物量及其N,P化学计量季节动态特征
陈 婵,王光军,朱 凡,赵 月,梁小翠
(1.中南林业科技大学生命科学与技术学院,中国 长沙 410004;2.南方林业生态应用技术国家工程实验室,中国 长沙 410004)
枫香人工林凋落物量及其N,P化学计量季节动态特征
陈婵1,2,王光军1,2*,朱凡1,2,赵月1,2,梁小翠1,2
(1.中南林业科技大学生命科学与技术学院,中国 长沙410004;2.南方林业生态应用技术国家工程实验室,中国 长沙410004)
摘要为了探索凋落物量及其N,P化学计量随着季节变化所呈现的规律性和相关关系,以湖南枫香(Liquidamba formosana Hance)人工林两年的凋落物为研究对象,开展凋落物量、各组分产量及其N,P质量分数和质量比生态化学计量特征的研究.结果表明:2012和2013年凋落物总量无显著差异性,分别为5 085.9±657.6 kg·hm-2和4 935.7±609.7 kg·hm-2.各组分凋落量从大到小排序为:叶、枝、花果、碎屑.叶的N,P质量分数之间,叶的w(P)与m(N)∶m(P)之间,枝的w(P)与m(N)∶m(P)之间以及碎屑的w(P)与m(N)∶m(P)之间均存在一定的相关性(P<0.01).枫香人工林凋落物及各组分产量及N,P质量分数和生态化学计量均存在显著的季节动态,表明季节变化对其均产生了一定的影响.而枫香林凋落物的N,P质量比值逐渐增加,表明P元素对该生态系统起到了限制作用.
关键词枫香;凋落物;氮磷质量比;生态化学计量特征;季节动态
凋落物层是森林生态系统能量转换和物质循环的重要场所,凋落物分解后形成森林表层土壤的腐殖质和有机质[1].因此,森林凋落物在维持土壤肥力、维持森林生态系统稳定性以及确保森林生态系统物质循环和能量循环正常运转方面具有重要的作用[2-3].凋落物的N,P质量比制约着凋落物的养分循环和分解,其变化特征可以反映N,P养分的限制作用[4-6].由于人工林的多样性低,生态稳定性差,对土壤肥力的消耗远远大于天然林,因此,近年来国内外越来越关注对人工林凋落物生物量、组成、营养元素含量及分解速率等方面的研究.郑路等[7]研究了从热带到亚热带和温带林凋落物现存量及养分特征.杨会侠等[8]和葛晓改等[9]对马尾松人工林年凋落物量与养分归还动态的研究发现,凋落物对维持马尾松人工林林地养分具有重要作用.刘洋等[10]的研究证明巨桉人工林年凋落量较大,但养分年归还量相对较低.邹碧等[11]对比了南亚热带4种人工林凋落物生物量的动态特征及其影响因素.刘文飞[12]对桉树人工林凋落物的研究表明,不同林龄的年凋落物总量呈现先增加后出现缓慢下降的趋势.万春红等[13]在研究中探讨了森林群落物种组成与凋落物组成的关系.刘文丹等[14]研究发现不同生活型植物凋落物各组分的分解具有一致性.郭婧等[15]通过对中亚热带4种森林凋落物的对比,结果证明了次生林凋落物分解速率快,有利于养分归还.周佳佳等[16]通过凋落量及养分含量的研究发现,输入植物生长必需的营养元素对氮沉降起到缓解的作用.熊莉等[17]研究结果表明,凋落物对土壤呼吸速率的年均贡献率存在明显季节动态.Chapin等[18]研究发现土壤的养分状况会对凋落物的数量和质量造成直接影响.王晓峰等[19]发现杉木凋落物的添加显著增加了土壤总微生物生物量碳.
枫香(LiquidambaformosanaHance)是我国亚热带常见的乡土树种和针阔混交林造林的首选树种,同时因其具有较强的耐火性和对SO2和Cl2有毒气体有较强的抗性,可用于矿区植被恢复和土壤治理,在林业生产和科研上具有十分重要的研究价值.目前关于凋落物生物量动态及分解速率的研究很多,但对枫香人工林凋落物各组分的N,P生态化学计量及其季节动态的研究较少被报道.本研究通过分析枫香人工纯林两年凋落物各组分生物量和N,P质量分数及N,P质量比间的关系和生态化学计量特征,探索凋落物量及N,P化学计量随着季节变化所呈现的规律性和相关关系,为研究N,P质量比季节动态在人工林凋落物-土壤相互作用的养分调控过程中的影响提供理论依据,为枫香人工林的生产经营和生态管理提供理论支持.
1材料与方法
1.1实验地概况
试验地位于距长沙市中心区约8公里的湖南省天际岭国家森林公园(113°01′~113°02′E,28°06′~28°07′N),核心区面积约140 hm2,海拔62~102 m,地势较为平缓.年平均气温17.2 ℃.极端最低温度-11.3 ℃;极端最高气温40.6 ℃.林内夏季气温比市区要低4~5 ℃,具有森林气候.试验地属中亚热带湿润季风气候,年均降雨量约为1 400 mm,年均相对湿度达到80%,无霜期为270~300 d,年日照时数1 717.34 h.土壤主要类型为典型第四纪网纹层母质发育的酸性红壤,pH值在3.5~4.5之间,砾石含量属于中等水平,经三十多年的土壤改造和造林绿化,土壤状况得到了较大的改善.
1.2实验地植被特征
选择1986年造林的人工枫香林作为试验林地,基本状况见表1.试验地森林资源非常丰富,森林覆盖率高达90%,以枫香人工纯林为主,伴生有极少量的杉木(Cunninghamialanceolata)、湿地松(Pinuselliottii)、苦槠(Castanopsissclerophylla)、桤木(Alnuscremastogyne)和马尾松(Pinusmassoniana)等10多种苗木,林下植被有大青(Clerodendroncyrtophyllum)、油茶(Camelliaoleifera)、白栎(Quercusfabri)、青桐(Firmianasimplex);草本植物有肾蕨(Nephrolepisauriculata)、淡竹叶(Lophantherumgracile)、鸡矢藤(Paederiascandens)、一枝黄花(Solidagocanadensis)、酢浆草(Oxaliscomiculata)芒萁(Dicranopterisampla)、狗脊蕨(Woodwardiaprolifera)、铁线蕨(Adiantumcapillus-veneris)、蛇葡萄(Ampelopsissinica)、井栏边草(Pterismultifida)、山麦冬(RadixLiriopes)等.

表1 枫香人工林的基本情况
1.3试验设计
2012年1月~2013年12月,在长沙天际岭林场枫香人工林范围内,选择坡向相同,地势较平缓、立地条件一致,郁闭度相近的区域,分别选取面积30 m×30 m的3块林地作为固定样地,使整个林分基本状况都能体现.调查固定样地中的坡向、坡度、海拔,土壤厚度以及理化性质.于每块固定样地内以S型均匀设置1 m×1 m的6块正方形凋落物收集网,每个收集网间隔10 m,总共18块,用1 m高木棍支起收集网四角.每月月底收集收集器上的凋落物以及样方内的土壤装入布袋,带回实验室进行实验分析.收集的凋落物按叶、枝、花果及其他碎屑物(包括昆虫残体、粪便及鸟类粪便等) 等组分区分,分别称质量后在85 ℃下烘至恒质量,然后计算月凋落量,样品经粉碎后再分析养分质量分数.
1.4样品处理和养分含量测定
凋落物各组分以及土壤样品粉碎烘干后,两年样品按年平均、月平均进行分析.样品中的全N质量分数用半微量凯氏法测定,全P质量分数用钒钼黄比色法测定.
1.5数据处理及分析方法
用Excel 2010处理基本数据,用Sigmaplot 12.5绘制出凋落物生物量,N,P质量分数及m(N)∶m(P)的季节动态特征图,用SPSS 18.0进行数据处理和统计分析,检验和分析样品N,P质量分数及m(N)∶m(P)之间的相关性.
2结果与分析
2.1凋落物量及其组成的动态特征

图1 枫香凋落物各组分生物量两年年均季节动态Fig.1 Seasonal dynamic of average annual of the two years in each component of litter fall in Liquidamba formosana plantation
枫香人工林2012—2013年的凋落物总量之间差异性不显著,分别为5 085.9±657.6 kg·hm-2和4 935.7±609.7 kg·hm-2.两年年均凋落物量中12月凋落物生产量最大,为1 056.1±187.1 kg·hm-2,占全年凋落物总量的21.1%,4月最小,为190.2±23.6 kg·hm-2,占全年凋落物总量的3.8%.
凋落物两年年均季节动态如图1所示,从两年凋落物量的平均值来看,各个组分的生物量均存在显著的季节动态特征,其中叶、枝之间呈现极显著相关(P<0.01),其余组分相关性不显著.叶的凋落物量在12月最大,2月最小,年均总量为2 872.23±57.64 kg·hm-2,占凋落物总量的57.32%;枝在12月凋落物量最大,4月最小,年均总量为1 646.67±17.35 kg·hm-2,占凋落物总量的32.86%;花果的凋落物生物量在10月最大,4月最小,年均总量为302.76±6.82 kg·hm-2,占凋落物总量的6.04%;碎屑8月的凋落物量最大,3月最小,年均总量为189.15±1.12 kg·hm-2,占凋落物总量的3.77%.
2.2凋落物各组分N,P质量分数及m(N)∶m(P)的动态特征
将枫香人工林两年的凋落物各组分测定出的N,P质量分数分别按月取平均值,由图2可知,凋落物各组分N,P质量分数呈现出不同的季节动态特征,其N,P质量分数之间差异性极其显著.叶w(N)两年月平均值为13.08±0.86 mg/g,最大值出现在6月份,最小值出现在1月份,大致趋势为先明显升高后递减.枝w(N)两年月平均值为5.49±0.41 mg/g,最大值出现在7月份,最小值出现在4月份,变化趋势为先升后降又逐渐增高.花果w(N)两年月平均值为12.81±0.42 mg/g,最大值出现在6月份,最小值出现在11月份,动态特征为先升后降.碎屑w(N)两年月平均值为13.99±0.66 mg/g,最大值出现在8月份,最小值出现在7月份,变化趋势波动较大.
叶w(P)两年月平均值为0.40±0.02 mg/g,最大值出现在5月份,最小值出现在2月份,变化趋势为先降后升最后趋于平稳.枝w(P)两年月平均值为0.21±0.03 mg/g,最大值出现在10月份,最小值出现在4月份,动态特征前期较平稳,而后期波动较大.花果w(P)两年月平均值为0.39±0.02 mg/g,最大值出现在7月份,最小值出现在11月份,趋势为先升后降.碎屑w(P)两年月平均值为0.86±0.05 mg/g,最大值出现在10月份,最小值出现在9月份,季节动态波动较大.

图2 凋落物各组分中N,P含量季节动态特征Fig.2 Seasonal dynamic of N and P content in each component of litter fall of Liquidamba formosana plantation

图3 凋落物各组分中m(N)∶m(P)季节动态特征 Fig.3 Seasonal dynamic of N and P ratio in each component of litter fall of Liquidamba formosana plantation
试验地2012—2013年凋落物总m(N)∶m(P)依次为23.48±0.68,23.99±0.84,呈现出逐年增加的趋势.凋落物各组分的m(N)∶m(P)也明显表现出季节动态特征(图3).叶m(N)∶m(P)两年月平均值为33.82±2.42,最大值出现在2月份,最小值出现在11月份,季节动态大致为先升后降.枝m(N)∶m(P)两年月平均值为39.93±7.02,最大值出现在12月份,最小值出现在10月份,变化趋势为前期先升高后显著下降,后期波动较大.花果m(N)∶m(P)两年月平均值为33.69±1.09,最大值出现在5月份,最小值出现在7月份,季节动态呈现出先升后降,然后升高,最后降低的趋势.碎屑m(N)∶m(P)两年月平均值为17.78±1.44,最大值出现在3月份,最小值出现在5月份,季节变化波动仍然较大.
2.3凋落物各组分N,P质量分数与m(N)∶m(P)的相关性
从表2中可以看出,叶的 N,P元素质量分数呈显著正相关关系(P<0.05),相关关系为:y=0.016 7x+0.248;枝、花果、碎屑N和P的相关性不显著.各组分的w(N)与m(N)∶m(P)之间均无相关性;其中叶的w(P)与m(N)∶m(P)之间存在显著负相关关系(P<0.05),相关方程为:y=-67.011x+60.847;枝的P含量与m(N)∶m(P)之间呈现极显著指数相关(P<0.01) ,相关方程为:y=78.731e-4.406x;花果的w(P)与m(N)∶m(P)之间不显著相关;碎屑的w(P)与m(N)∶m(P)之间存在极显著负相关性(P<0.01) ,相关关系为:y=-19.969x+34.909.各组分w(P)与m(N)∶m(P)之间的相关关系如图4.

表2 凋落物各组分N,P质量分数间及与m(N)∶m(P)之间的相关关系
注:*.在0.05水平(双侧)上显著相关;**.在0.01水平(双侧)上显著相关.
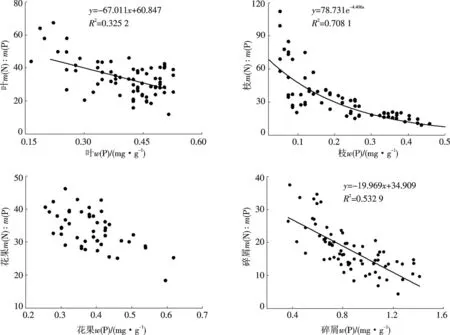
图4 凋落物各组分w(P)与m(N)∶m(P)之间的相关关系Fig.4 Relationships between P content and ratio of N and P in each component of litter fall of Liquidamba formosana plantation
3讨论
3.1枫香林凋落物量及各组分的特征
本研究中发现,各组分占凋落物总量的比例从大到小为:叶、枝、花果、碎屑,与国内外对大多数森林凋落物的组分研究结果一致.万春红等[3]对海南岛森林类型凋落物的不同组分的研究表明,凋落叶的比例均最高,为56.79%~72.26%. Kuperman[20]和王春阳等[21]研究表明,不同气候区凋落物组成中叶为51.0%~86.0%.本研究中,枫香林凋落叶占57.32%,均在以上比例范围之内,表明枫香林凋落物中落叶的比例占据了绝对优势,与国内外研究结果一致.叶与枝凋落量之间呈现极显著的正相关关系,与温远光等[22]对亚热带森林凋落物产量及动态的研究结果相同,表明枫香叶片凋落时,枝也会随着一起脱落.碎屑凋落量最少,表明枫香林中的鸟类、昆虫等动物比较稀少.
相比于邹碧等[11]对南亚热带4种人工林凋落物量和葛晓改[9]等对马尾松人工林凋落物量的研究,本研究中枫香人工林的凋落物量明显较低,其原因是受到树种本身生物学特性所影响,枫香属落叶乔木,其落叶期主要处于10~12月,同时凋落物总量的动态特征与叶凋落物量的变化趋势相似,表明凋落叶在一定程度上对凋落物总生物量起主导作用,因此叶的凋落期较短导致了枫香林凋落物总量处于较低水平.翁轰[23]等对鼎湖山森林凋落物量及营养元素含量的研究表明森林凋落物量的月动态模式有单峰型、双峰型和不规则型3种,本研究中枫香人工林总凋落物量表现出明显的月动态,呈单峰型,峰值出现在12月份,这一现象与其主要组分凋落叶和枝的生物量峰值也出现在12月份有关.
3.2枫香林各组分N,P质量分数及N,P生态化学计量特征和相关性
凋落物中的各种养分元素决定了土壤肥力,而不同组分的养分含量存在较大差异,本研究中N,P元素在各组分中质量分数从大到小排序均为碎屑、叶、花果、枝.造成的原因是木凋落物中N,P元素发生了迁移,转移到其他组分中,从而含量明显低于叶、花果和碎屑,同时林木组织中枝的N,P质量分数本来就低于其他组分.碎屑的w(N)最高,其原因是由于凋落物层中微生物生物量较高,或者是受到鸟,昆虫等动物活动的干扰.而叶的w(N)高于枝,造成的原因是叶是植物进行光合作用的主要场所,植物体合成叶绿素的主要元素是N.
研究发现,森林生态系统在长期缺乏灾难性干扰的情况下,其生长后期腐殖质和新鲜凋落物中m(N)∶m(P)表现出增加的趋势,表明森林生态系统随着时间推移P元素对其的限制作用越来越明显[24].在本研究中,枫香人工林从栽种至今,凋落物的m(N)∶m(P)逐渐增加,同时叶、枝、碎屑的w(P)与m(N)∶m(P)之间均存在一定的负相关关系,表明P成为了枫香林生态系统中的限制因子,因此,在枫香人工林的后期可以通过控制w(P)来提高枫香的生产力及土壤肥力.
凋落物叶的N,P质量分数最大值均出现在生长季节,最小值在冬季,与杨会侠等[8]凋落物叶N,P均表现为生长季节浓度高,秋、冬季节低的研究结果一致,而m(N)∶m(P)最大值出现在冬季,原因是由于冬季P元素含量低,凋落物受到P限制的影响,m(N)∶m(P)与w(P)成反比.枝、花果和碎屑的w(N)也均在夏季表现出最高浓度,枝和碎屑的w(P)主要在秋季具有最高值,花果的最高w(P)则出现在夏季,原因是花果的生长季节主要在夏季,对N,P的吸收较少,因此凋落花和凋落果在夏季的N,P质量分数较高.枝、花果的m(N)∶m(P)均随着w(P)的变化而呈现相反的趋势,与凋落叶的规律一致.叶、碎屑的N,P质量分数及m(N)∶m(P)季节差异均达到1倍以上,枝的季节差异可达2倍以上,花果的季节差异不明显.
3.3季节变化对凋落物各组分生物量及其N,P生态化学计量的影响
凋落物量及其各组分生物量和N,P生态化学计量均呈现出显著的季节动态,表明季节变化对其均产生了一定的影响.凋落物量以及叶、枝和花果凋落量均在秋冬两季达到峰值,这一现象与花期在3~4月,落果期在10~11月,落叶期在10~12月有关,同时也与当地季节气候有关[25],秋冬季研究区域降雨降雪有所增加,温度骤降,枫香通过落叶可以缩小蒸腾作用和散热面积,减少体内的水分散失,以适应低温.凋落物中叶和花果的w(N)在春季达到峰值,其原因是枫香在春季长出幼叶和开花,而幼叶和花在生长初期对N的需求量增大,致使春季的落叶和落花所含N有所增加;叶和花果的w(P)在春夏两季达到峰值,其原因是叶和果在春夏时期的生长对于P元素的需求更大.枝和碎屑的N,P质量分数季节动态波动较大,由此可知季节变化并不是其主要影响因素.
凋落物对维持土壤养分库、影响林分初级生产力、调节生态系统养分循环与能量流动具有重要意义[26],是森林生态系统的重要组成成分[27]以及物质流动和能量转换过程的重要环节[28].本研究中只对枫香人工林的凋落物量及其各组分N,P生态化学计量特征进行了季节上的分析研究,但是控制凋落物量和养分元素的限制因素有很多,例如水分、温度以及其余营养元素等,影响各组分N,P生态化学计量特征的因素也很复杂并且具有综合性.因此需要进一步研究人工林凋落物量N,P质量分数的其他影响因素以及m(N)∶m(P)在凋落物-土壤相互作用的养分调控过程中对凋落物分解速率的影响,从而为人工林的有效经营和生态管理提供更多的理论支持.
参考文献:
[1]常雅军, 陈琦, 曹靖,等. 甘肃小陇山不同针叶林凋落物量、养分储量及持水特性[J]. 生态学报, 2011,31(9):2392-2400.
[2]LIKENS G E, BORMANN F H, PIERCE R S,etal. Biogeochemistry of a forested ecosystem[M]. New York: Springer-Verlag, 1977.
[3]万春红, 陶楚, 杨小波, 等. 海南岛不同森林类型凋落物产量及其影响因素[J]. 热带生物学报, 2014,5(2):153-161.
[4]TESSIER J T, RAYNAL D J. Use of nitrogen to phosphorus ratios in plant tissue as an indicator of nutrient limitation and nitrogen saturation[J]. J Appl Ecol, 2003,40(3):523-534.
[5]GÜSEWELL S. N∶P ratios in terrestrial plants: Variation and functional significance[J]. New Phytol, 2004,164(2):243-266.
[6]VASCONCELOS H L, LUIZO F J. Litter production and litter nutrient concentrations in a fragmented amazonian landscape[J]. Ecol Appl, 2004,14(3):884-892.
[7]郑路, 卢立华. 我国森林地表凋落物现存量及养分特征[J].西北林学院学报, 2012,27(1):63-69.
[8]杨会侠, 汪思龙, 范冰, 等. 不同林龄马尾松人工林年凋落物量与养分归还动态[J]. 生态学杂志, 2010,29(12):2334-2340.
[9]葛晓改, 周本智, 肖文发. 马尾松人工林凋落物产量、养分含量及养分归还量特性[J]. 长江流域资源与环境, 2014,23(7):996-1003.
[10]刘洋, 张健, 冯茂松. 巨桉人工林凋落物数量、养分归还量及分解动态[J]. 林业科学, 2006,42(7):1-10.
[11]邹碧, 李志安, 丁永祯, 等. 南亚热带4种人工林凋落物动态特征[J]. 生态学报, 2006,26(3):715-721.
[12]刘文飞, 樊后保, 高春芬, 等. 连续年龄序列桉树人工林凋落物量及养分通量[J]. 生态学杂志, 2009,28(10):1928-1934.
[13]万春红, 陶楚, 杨小波, 等. 森林群落物种组成对凋落物组成的影响[J]. 生态学报, 2015,35(22):1-9.
[14]刘文丹, 陶建平, 张腾达, 等. 中亚热带木本植物各器官凋落物分解特性[J]. 生态学报, 2014,34(17):4850-4858.
[15]郭婧, 林华, 方晰, 等. 中亚热带4种森林凋落物量、组成、动态及其周转期[J]. 生态学报, 2015,35(14):1-14.
[16]周佳佳, 崔珺, 杨佳, 等. 常绿阔叶林凋落物量及养分对氮沉降的响应[J]. 东北林业大学学报, 2013,41(12):47-51.
[17]熊莉, 徐振锋, 杨万勤, 等. 川西亚高山粗枝云杉人工林地上凋落物对土壤呼吸的贡献[J]. 生态学报, 2015,35(14):1-12.
[18]CHAPIN F S Ⅲ, MATSON P A, MOONEY H A. Principles of terrestrial ecosystem ecology[M]. New York:Springer-Verlag, 2002.
[19]王晓峰, 汪思龙, 张伟东. 杉木凋落物对土壤有机碳分解及微生物生物量碳的影响[J]. 应用生态学报, 2013,24(9):2393-2398.
[20]KUPERMAN R G. Litter decomposition and nutrient dynamics in oak-hickory forests along a historic gradient of nitrogen and sulfur deposition[J]. Soil Biol Biochem, 1999,31(2):237-244.
[21]王春阳, 周建斌, 董燕婕, 等. 黄土区六种植物凋落物与不同形态氮素对土壤微生物量碳氮含量的影响[J]. 生态学报, 2010,30(24):7092-7100.
[22]温远光, 韦炳二, 黎洁娟. 亚热带森林凋落物产量及动态的研究[J]. 林业科学, 1989,25(6):542-548.
[23]翁轰, 李志安, 屠梦照, 等. 鼎湖山森林凋落物量及营养元素含量研究[J]. 植物生态学与地植物学报, 1993,17(4):299-304.
[24]WARDLE D A, BARDGETT R D, KLIRONOMOS J N,etal. Ecological linkages between aboveground and belowground biota[J]. Science, 2004,304(5677):1629-1633.
[25]齐泽民, 王开运. 川西亚高山林线交错带植被凋落物量及养分归还动态[J]. 生态学杂志, 2010,29(3):434-438.
[26]潘复静, 张伟, 王克林, 等. 典型喀斯特峰丛洼地植被群落凋落物C∶N∶P生态化学计量特征[J]. 生态学报, 2011,31(2):335-343.
[27]LIAO J H, WANG H H, TSAI C C,etal. Litter production, decomposition and nutrient return of uplifted coral reef tropical forest[J]. Forest Ecol Manag, 2006,235(1-3):174-185.
[28]WARING R H, SCHLESINGER W H. Forest ecosystems: concepts and management[M]. New York: Academic Press, 1985.
(编辑WJ)
Seasonal Dynamic of Litter Production and Its N and P Ecological Stoichiometry inLiquidambaFormosanaPlantation in Hunan, China
CHENChan1,2,WANGGuang-Jun1,2*,ZHUFan1,2,ZHAOYue1,2,LIANGXiao-Cui1,2
(1. College of Life Science and Technology, Central South University of Forestry and Technology, Changsha 410004, China;2. National Engineering Lab for Applied Technology of Forestry and Ecology in South China, Changsha 410004 China)
AbstractIn order to explore the regularity and correlation of litter production and its N and P ecological stoichiometry with seasonal changes, we took the object of Liquidamba formosana Hance plantation in Hunan as an example to investigate the production of litter and its components, and ecological stoichiometry characteristics of nitrogen(N), phosphorus(P) and the N and P ratio in each component. The results showed that there was no significant defference of litter biomass in the year of 2012 and 2013, which were found to be 5 085.9±657.6 kg·hm-2and 4 935.7±609.7 kg·hm-2, respectively. The order of components production is the following: leaf>branch>flower>fragment. Reasonable correlations were discovered between N and P elements in leaf, between P and the N and P ratio in leaf, between the P content with the N and P ratio in branch, and between P and N and P element ratio in fragment. There exists significant seasonal dynamics of litter and components production, N and P content and ecological stoichiometry in each component of Liquidamba formosana plantations. Seasonal changes should have had an impact on these features. The N and P ratio in litter components was gradually increasing, suggesting that the P element is the limiting factor to this ecosystem.
Key wordsLiquidamba formosana; litter fall; N and P ratio; ecological stoichiometry; seasonal dynamic
中图分类号Q14
文献标识码A
文章编号1000-2537(2016)02-0016-07
*通讯作者,E-mail:wanggj652@163.com
基金项目:国家林业局“948”先进技术引进项目(2014-4-62);2013湖南省自然科学基金创新研究团体项目(湘基金委字[2013]7号)
收稿日期:2015-04-02
DOI:10.7612/j.issn.1000-2537.2016.02.003

