低氧环境对大鼠骨髓间充质干细胞交感神经重构相关因子表达的影响
周智涓,伍 卫,黄穗花,刘 茂,陈 剑
中山大学附属第五医院(广东珠海 519000)
低氧环境对大鼠骨髓间充质干细胞交感神经重构相关因子表达的影响
周智涓,伍卫,黄穗花,刘茂,陈剑
中山大学附属第五医院(广东珠海 519000)
摘要:目的观察低氧环境对大鼠骨髓间充质干细胞(BMSCs)三种交感神经重构相关因子内皮素-1(ET-1)、促红细胞生成素(EPO)和粒细胞集落刺激因子(G-CSF)表达的影响。方法体外分离培养大鼠BMSCs至第三代,应用Western Blot技术检测BMSCs各代细胞中ET-1、EPO和G-CSF蛋白表达水平。BMSCs培养至第三代后,更换无血清无糖培养基,将细胞培养皿置入缺氧培养箱分别培养2 h、6 h、12 h及24 h,分别检测上述四组细胞ET-1、EPO、G-CSF蛋白表达水平。结果大鼠BMSCs在常氧状态下具有分泌神经重构相关因子ET-1、EPO、G-CSF的功能。低氧环境可诱导大鼠BMSCs细胞ET-1、EPO、G-CSF蛋白表达水平上调,ET-1、EPO表达水平随缺氧时间延长而进行性升高,差异有统计学意义(P<0.05)。结论低氧环境能显著上调大鼠BMSCs交感神经重构相关因子的表达水平,促进心肌交感神经重构,可能与BMSCs移植治疗后心律失常副反应的发生密切相关。
关键词:骨髓间充质干细胞;交感神经重构;促红细胞生成素;内皮素-1;粒细胞集落刺激因子
骨髓间充质干细胞(bone marrow-derived mesenchymal stem cells,BMSCs)是成体干细胞的一种,具有自我更新、自我维持以及多向分化的潜能,被认为是当前干细胞移植研究领域极具前景的种子细胞之一[1]。BMSCs可分化为血管内皮细胞和血管平滑肌细胞,自分泌或促进心肌细胞分泌促血管生长的细胞因子,从而直接和间接诱导新生血管形成,促进侧支循环建立,挽救缺血心肌[2-3]。
然而,BMSCs移植治疗心肌梗死的安全性尚不确切。BMSCs移植治疗具有致心律失常的副反应,目前观点认为其心律失常的发生可能与心肌交感神经结构和功能重构密切相关[4-5]。近年体外研究还发现,内皮素-1(endothelin-1,ET-1)、促红细胞生成素(erythropoietin,EPO)和粒细胞集落刺激因子(granulocyte colony-stimulated factor,G-CSF)具有促进心肌梗死区神经生长因子(nerve growth factor,NGF)的表达、提高交感神经张力以及营养神经的作用,从而促进心肌交感神经重构的发生和发展[6-8]。那么,BMSCs移植治疗的致心律失常作用是否与其分泌上述神经重构相关因子(ET-1、EPO、G-CSF)有关,以及低氧诱导环境下能否上调BMSCs细胞上述因子的表达水平呢?目前尚无相关文献报道。本实验通过体外分离培养大鼠BMSCs,观察常氧条件下大鼠BMSCs能否分泌神经重构相关因子ET-1、EPO、G-CSF及其分泌特点;利用低氧诱导模拟心肌梗死缺氧环境,进一步观察低氧环境对大鼠BMSCs交感神经重构相关因子表达的影响,从而为探索BMSCs移植治疗致心律失常的原因提高实验依据。
1材料与方法
1.1实验动物清洁级雄性Sprague-Dawley(SD)大鼠,体质量80 g~120 g,3周~4周龄,共6只,由中山大学实验动物中心提供(实验动物质量合格证号:SCXK粤2012-0029)。实验过程中对动物的处置符合动物伦理学标准。
1.2主要试剂和仪器胎牛血清(美国Hyclone公司);DMEM-F12培养基(美国Hyclone公司);甘油醛-3-磷酸脱氢酶兔抗鼠多克隆抗体(Anti-GAPDH antibody,美国Abcam公司);兔抗鼠内皮素-1单克隆抗体(Anti-ET-1 antibody,美国Abcam公司);重组促红细胞生成素多克隆抗体(Anti-EPO antibody,美国CST公司);兔抗鼠粒细胞集落刺激因子单克隆抗体(Anti-G-CSF antibody,美国PeproTech 公司);超净工作台(美国Thermo Forma公司);缺氧细胞培养箱(美国Thermo Forma公司);荧光倒置显微镜(德国Leica公司);超低温冰箱(美国Thermo公司)等。
1.3BMSCs分离、培养及鉴定取3周~4周龄SD大鼠,无菌条件下分离中双侧股骨及胫骨,采取全骨髓贴壁分离和消化控制相结合分离纯化BMSCs。显微镜下观察原代(P0)BMSCs生长情况及形态变化,细胞增殖至培养皿80%~90%时,处于对数生长期,用0.25%胰蛋白酶-EDTA消化,离心机离心、重悬,传代培养。首次传代为P1,其后依次为P2、P3等,每天观察细胞生长情况。采用流式细胞仪检测P3期BMSCs细胞表面抗原CD44H、CD45、CD29、CD11b/c和CD90.1的表达情况。
1.4实验分组为分析常氧环境BMSCs细胞分泌神经重构相关因子ET-1、EPO、G-CSF特点,按照细胞培养周期将细胞分为3组:P1期(第一代BMSCs细胞)、P2期(第二代BMSCs细胞)、P3期(第三代BMSCs细胞)。分别检测三代细胞ET-1、EPO、G-CSF蛋白表达水平。为分析低氧环境对大鼠BMSCs细胞分泌神经重构相关因子的影响,取第三代BMSCs细胞进行试验。BMSCs培养至第三代(P3期)后,更换无血清无糖培养基,将细胞培养皿置入94%N2、5%CO2、1%O2缺氧培养箱分别培养2 h、6 h、12 h及24 h,分别检测上述4组细胞ET-1、EPO、G-CSF蛋白表达水平。
1.5蛋白印迹每瓶细胞加入裂解液后,用枪吹打数下,置于冰上并用水平摇床摇晃使裂解液和细胞充分接触。充分裂解后,于4 ℃,12 000 r/min离心10 min,取上清。提取总蛋白后,立即测定蛋白浓度。采用BCA法进行蛋白定量试剂盒进行定量。按说明书稀释标准品以及配制BCA工作液。将提取的总蛋白加入5×SDS蛋白缓冲液,100 ℃煮沸5 min,置于超低温冰箱保存备用。将蛋白用Bradford法定量后,选择不同浓度的聚丙烯酰胺凝胶(G-CSF15%,ET-1 12%,EPO12%),经SDS-PAGE电泳后将蛋白转至PVDF膜上。5%脱脂牛奶封闭后,加入相应的一抗,室温下孵育1 h~2 h或者4 ℃过夜。用TBST每次5 min洗3次后,用相应的稀释好的二抗,室温下孵育1 h~2 h后,用TBST冲洗3次,每次10 min,然后进行化学发光显影。用Gel-Proanalyzer4.0分析目标条带的光密度值。本实验采用GAPDH作为内参照,比较不同处理后上述蛋白表达的差异。
2结果
2.1BMSCs细胞鉴定显微镜下形态学观察可见BMSCs为长梭形或纤维状细胞,形态均一,排列密集,呈放射状或漩涡状生长(图1A)。利用流式细胞仪检测干细胞表面标志物,结果提示细胞CD29、CD90.1表达呈阳性,CD34、CD45和CD11b/c呈阴性,符合BMSCs细胞表面标志物特点(图1B)。

图1 BMSCs细胞形态学及流式细胞仪鉴定
2.2常氧环境BMSCs细胞ET-1、EPO和G-CSF蛋白表达应用Western Blot技术检测BMSCs细胞 P1、P2及P3三个培养周期中ET-1、EPO和G-CSF蛋白表达水平。结果发现,常氧环境中BMSCs细胞P1、P2、P3三个培养周期均可检测到ET-1、EPO和G-CSF蛋白表达,提示BMSCs细胞能够自分泌上述三种蛋白。P3期BMSCs细胞ET-1蛋白表达较P1、P2期显著增高,差异有统计学意义(P<0.05)。P2期与P1期BMSCs细胞比较,ET-1蛋白表达差异无统计学意义(P>0.05)。详见图2。P2期BMSCs细胞EPO蛋白表达水平较P1、P3期增高(P<0.05),而P3期与P1期BMSCs细胞比较发现前者EPO蛋白表达水平明显升高,差异有统计学意义(P<0.05)。详见图3。P2和P3期BMSCs细胞G-CSF蛋白水平较P1期增高(P<0.05),而P2和P3 期之间G-CSF蛋白表达水平差异无统计学意义(P>0.05)。详见图4。

注:与BMSCs P1、P2期比较,* P<0.05。
图2常氧环境BMSCs细胞ET-1蛋白表达
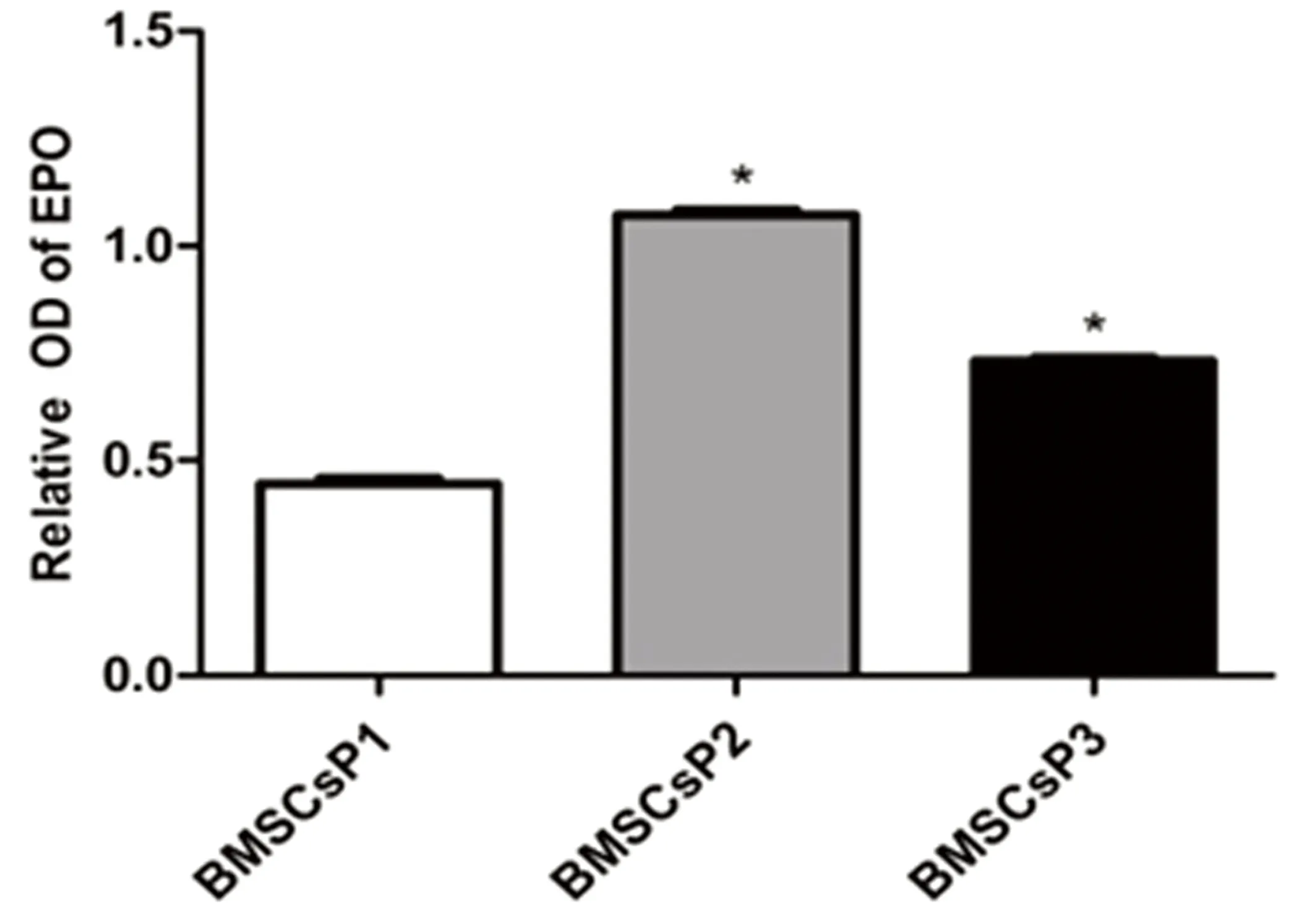
注:与BMSCs P1期比较,*P<0.05。
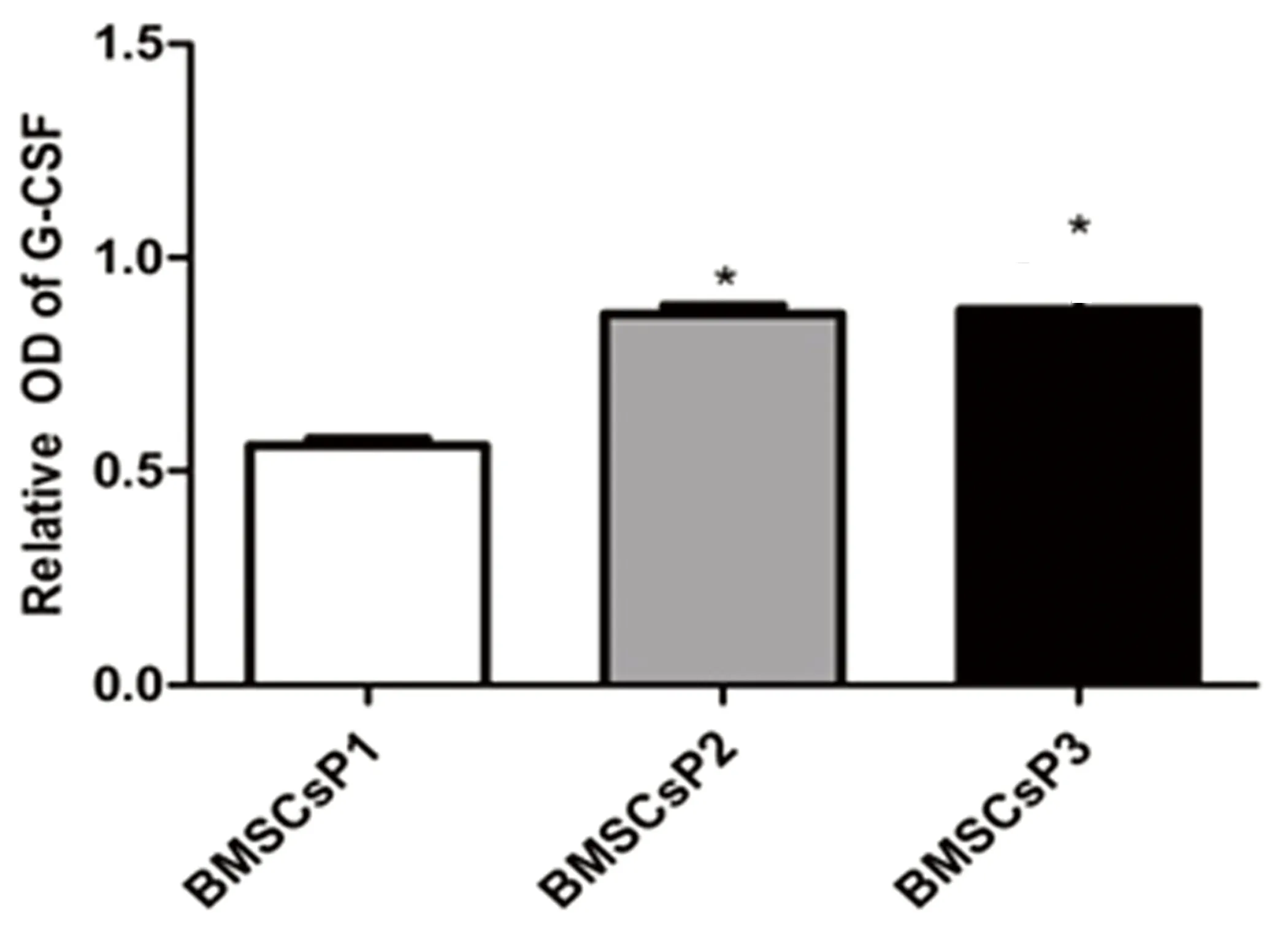
注:与BMSCs P1期比较,*P<0.05。
2.3低氧环境BMSCs细胞ET-1蛋白表达低氧诱导环境下BMSCs细胞ET-1蛋白表达量较常氧对照组显著增加(P<0.05),且随缺氧时间延长而逐渐增高,在缺氧24 h达到高峰(P<0.05),提示低氧环境可诱导BMSCs细胞ET-1蛋白表达水平上调。详见图5。
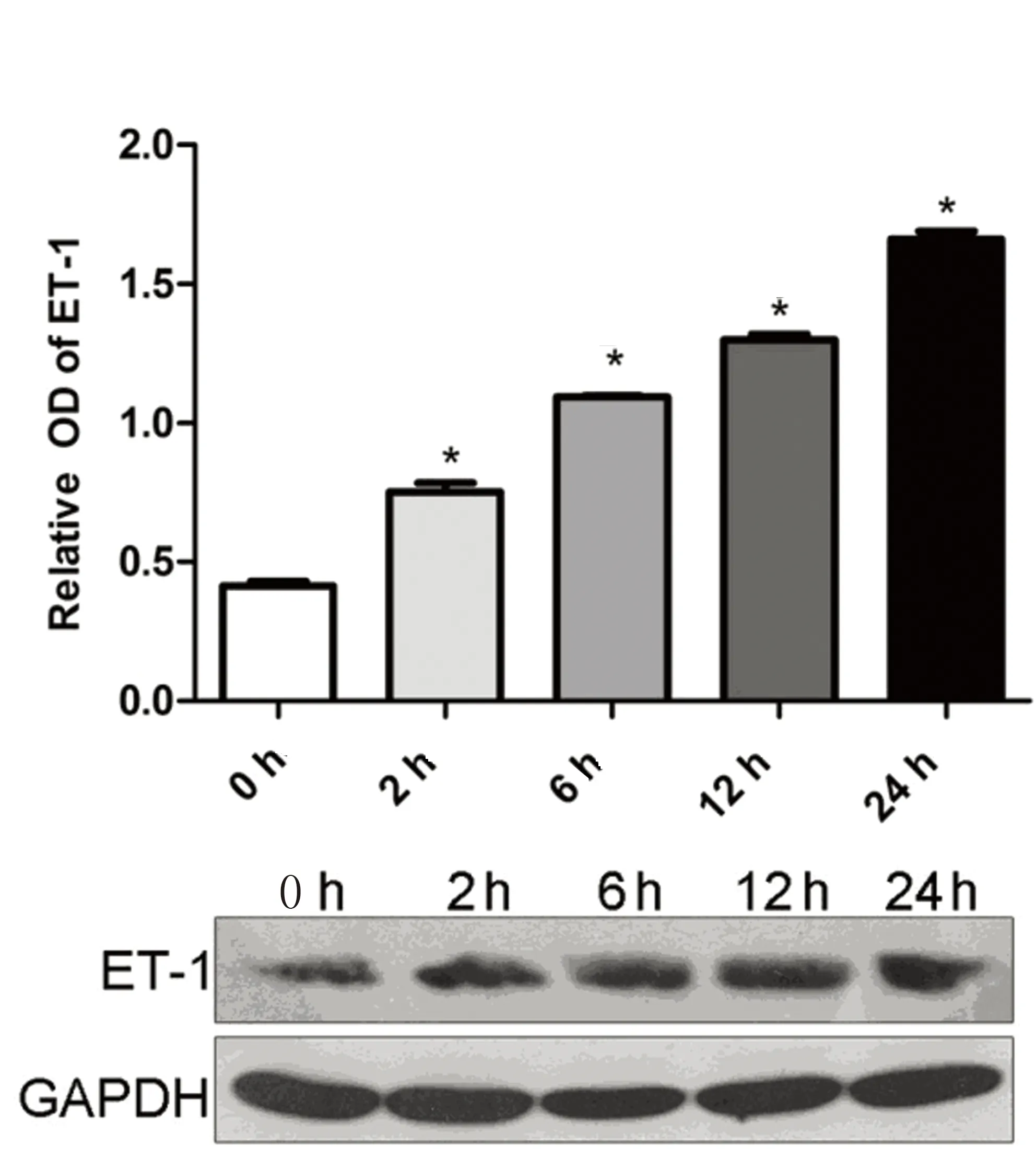
注:与对照组比较,*P<0.05。
2.4低氧环境BMSCs细胞EPO蛋白表达低氧诱导环境下BMSCs细胞EPO蛋白分泌量较常氧对照组明显升高(P<0.05),并随缺氧时间延长而进行性升高,在缺氧24 h达到高峰(P<0.05),提示低氧环境可诱导BMSCs细胞EPO蛋白表达水平上调。详见图6。
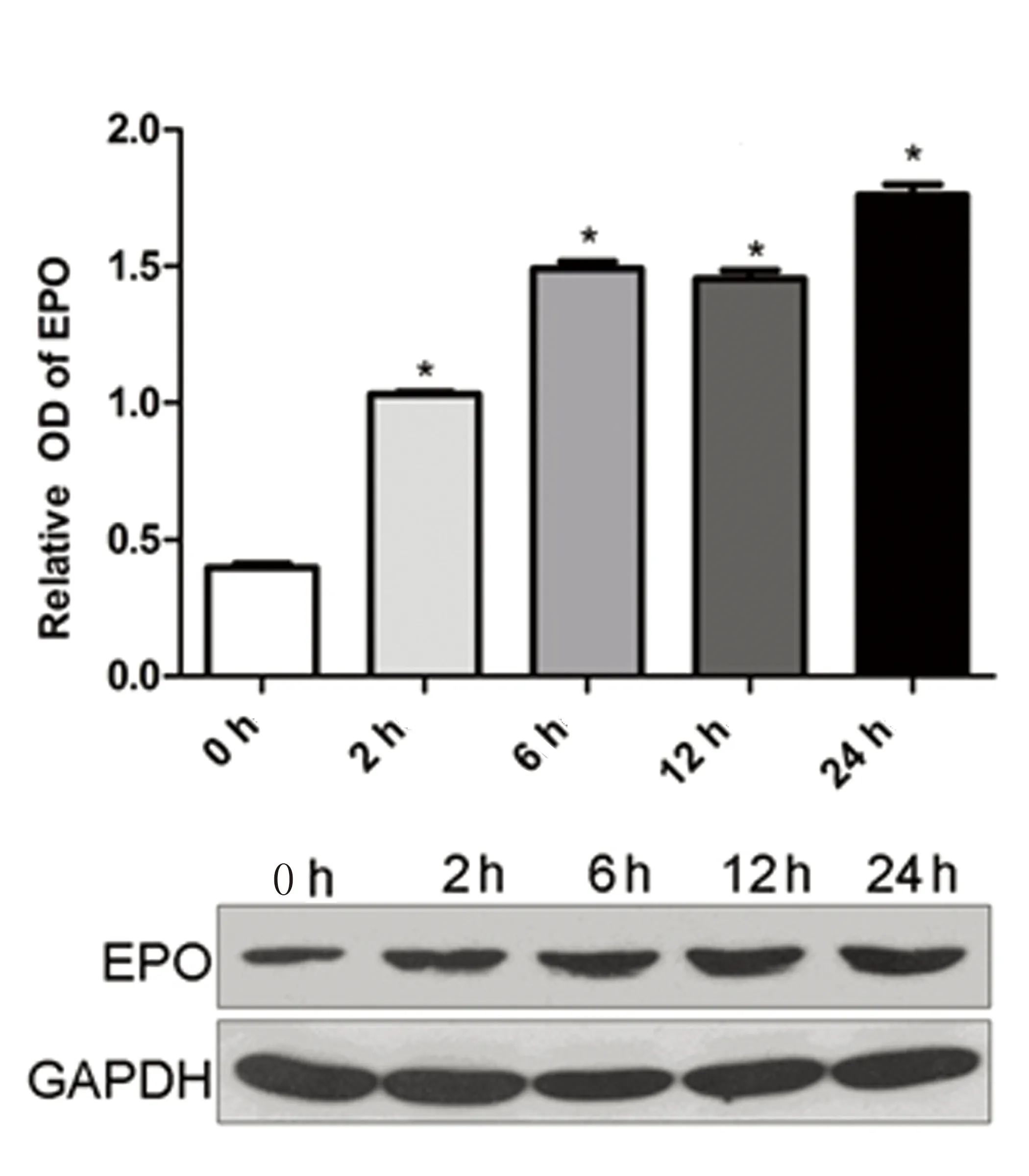
注:与对照组比较,* P<0.05。
图6低氧环境BMSCs细胞EPO蛋白表达
2.5低氧环境BMSCs细胞G-CSF蛋白表达低氧诱导环境下BMSCs细胞G-CSF蛋白分泌量较常氧对照组显著增加(P<0.05),但G-CSF蛋白表达量未随缺氧时间延长而进一步增加。详见图7。
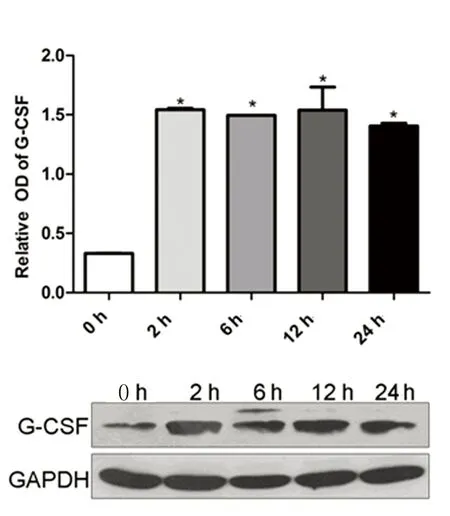
注:与对照组比较,* P<0.05。
3讨论
干细胞是一类具有自我更新、自我维持和多向分化潜能的细胞,能表达、合成或分泌生长因子、细胞因子、调节肽及气体信号分子等多种生物活性因子。而这些生物活性因子又具有调节组织细胞代谢、分化、增殖、迁移、凋亡等功能[9]。植入干细胞的分泌功能不仅直接影响植入干细胞自身的存活和分化,而且是干细胞移植发挥其他生物学效应的重要机制[10]。本研究通过体外分离培养大鼠BMSCs发现,常氧条件下大鼠BMSCs具有分泌神经重构相关因子ET-1、EPO、G-CSF的作用,低氧环境能够显著增加上述因子的表达水平,加剧心肌交感神经重构,从而促使BMSCs移植治疗后心律失常的发生。
ET-1是目前所知最强大的血管收缩因子,最早从猪主动脉内皮细胞上清液中分离发现。ET-1主要来源于内皮细胞,可通过旁分泌的形式激活内皮素受体并参与心血管系统多种生理病理过程[11]。研究发现,ET-1与ET-1受体结合后,可激活P38MAPK、ERK等信号通路,诱导心肌细胞表达与分泌NGF,从而促进交感神经重构[12]。在干细胞相关研究中发现,脂肪源性MSCs可表达ET-1,但骨髓源性MSCs是否同样表达ET-1,尚未见文献报道。本研究观察到BMSCs在P1、P2、P3三代细胞均可表达ET-1,且在纯化的P3中,ET-1表达量最高。通过体外单一细胞培养,排除了造血干细胞、造血细胞如单核细胞、淋巴细胞、成纤维细胞、巨噬细胞等干扰后,本研究首次发现骨髓来源的干细胞BMSCs同样具有分泌ET-1的作用。本研究还观察低氧处理对BMSCs细胞 24 h内ET-1表达量的影响。首次发现低氧可增强BMSCsET-1的表达,并发现在一定缺氧时程内,ET-1表达量随缺氧时程延长而增高,继续延长缺氧时间,ET-1表达量逐渐回降。这一结果提示低氧可调节BMSCs自分泌功能并可能在缺氧早期即发挥这一作用,提示这种机制可能与BMSCs移植治疗的致心律失常副反应相关。
另外,BMSCs由中胚层分化而成,可分泌多种支持造血因子,为BMSCs的存活提供营养支持及支架作用。既往研究发现,BMSCs可分泌和表达EPO和G-CSF[13-15]。EPO作为强大的神经营养因子,具有促进轴突再生的作用,还可促进脑和脊髓的星形胶质细胞分泌NGF,从而发挥神经保护作用[16]。G-CSF是一种促进粒细胞生长的细胞因子,前期研究证实G-CSF可通过与粒细胞集落刺激因子受体结合,促进干细胞迁移及定位[14,17]。Lee等[8]研究发现G-CSF可促进心肌梗死后大鼠梗死区域NGF表达及交感神经重分布。而Kuhlmann和Baldo等学者则持相反观点,认为G-CSF或可通过增加Connexin43表达而减少心肌梗死室性心律失常的发生[1,14]。在本研究中,通过蛋白印迹法检测未分化的BMSCs细胞EPO和G-CSF蛋白表达水平,也发现BMSCs可分泌上述细胞因子,且晚期成熟的BMSCs中更为明显,与国内外研究结论一致[15,18]。同时,本研究还发现,缺氧环境可诱导EPO和G-CSF蛋白表达增加,前者随缺氧时间增加而增加,后者则不随缺氧作用时间变化而进一步变化。该现象说明缺氧可影响BMSCs细胞EPO表达,或可通过持续分泌EPO而促进NGF表达,促进交感神经重构,从而诱发室性心律失常。另外,缺氧也可促进BMSCs细胞G-CSF蛋白表达,但是否能够通过G-CSF表达水平变化这一途径而影响心肌交感神经重构尚有待后续研究探索。
低氧环境可能通过以下途径影响BMSCs细胞交感神经重构相关因子的表达:低氧可增加抗凋亡蛋白Bcl-2的表达,抑制P53信号表达,抑制白介素1β转化酶生成,减少氧化应激损伤和氧自由基生成,稳定线粒体电位,从而保持移植入宿主的干细胞存活率[19];低氧可增强了干细胞的分化能力[20];低氧还可调节干细胞某些基因和受体表达并影响多个细胞信号通路,如ERK1/2、P38 MAPK、JNK通路等,参与其下游多种功能的调节,促进多种生物活性因子的合成与分泌[19,21]。
本研究具有一些不足之处。首先,本研究仅为初期体外实验,暂未进行在体实验或人体研究。其次,既往研究提示外源性ET-1可诱导BMSCs分化成心肌样细胞,本研究采用第1代~第3代BMSCs细胞进行研究,结果发现早期BMSCs可表达ET-1,而BMSCs自分泌的ET-1又能否促进其自身分化并影响其他细胞因子的分泌,本研究未进一步探讨。再次,本研究仅报告了上述三种细胞因子的蛋白表达水平,关注的细胞因子种类有限,且未报告低氧对BMSCs转录水平的影响;本研究未能纵向探讨BMSCs细胞分泌上述细胞因子后如何通过旁分泌影响周围心肌细胞NGF表达,如何进一步诱导心律失常发生。为此,本课题组正在进行后续研究。最后,本研究未进一步观察不同氧浓度下BMSCs分泌各细胞因子水平是否存在差异,且观察时间仅限于24 h内,未能横向多层次比较,有待更多同行的进一步合作与研究。
综上所述,大鼠BMSCs细胞具有分泌神经重构相关因子ET-1、EPO、G-CSF的功能,低氧环境能显著上调其上述细胞因子的表达水平,促进心肌交感神经重构,可能与BMSCs移植治疗后心律失常副反应的发生密切相关。
参考文献:
[1]Baldo MP,Davel AP,Nicoletti-Carvalho JE,et al.Granulocyte colony-stimulating factor reduces mortality by suppressing ventricular arrhythmias in acute phase of myocardial infarction in rats.[J].J Cardiovasc Pharmacol,2008,52(4):375-380.
[2]Gnecchi M,Melo LG.Bone marrow-derived mesenchymal stem cells: isolation,expansion,characterization,viral transduction,and production of conditioned medium[J].Methods Mol Biol,2009,482:281-294.
[3]Wen Z,Zheng S,Zhou C,et al.Repair mechanisms of bone marrow mesenchymal stem cells in myocardial infarction[J].J Cell Mol Med,2011,15(5):1032-1043.
[4]Zhang J,Wang LL,Du W,et al.Hepatocyte growth factor modification enhances the anti-arrhythmic properties of human bone marrow-derived mesenchymal stem cells[J].PLoS One,2014,9(10):e111246.
[5]Macia E,Boyden PA.Stem cell therapy is proarrhythmic[J].Circulation,2009,119(13):1814-1823.
[6]Lee JH,Kemp DM.Human adipose-derived stem cells display myogenic potential and perturbed function in hypoxic conditions[J].Biochem Biophys Res Commun,2006,341(3):882-888.
[7]Kolettis TM.Ventricular tachyarrhythmias during acute myocardial infarction:the role of endothelin-1[J].Life Sci,2014,118(2):136-140.
[8]Lee TM,Chen CC,Chang NC.Granulocyte colony-stimulating factor increases sympathetic reinnervation and the arrhythmogenic response to programmed electrical stimulation after myocardial infarction in rats[J].Am J Physiol Heart Circ Physiol,2009,297(2):H512-H522.
[9]Burdon TJ,Paul A,Noiseux N,et al.Bone marrow stem cell derived paracrine factors for regenerative medicine: current perspectives and therapeutic potential[J].Bone Marrow Res,2011,2011:207326.
[10]Maldonado-Soto AR,Oakley DH,Wichterle H,et al.Stem cells in the nervous system[J].Am J Phys Med Rehabil,2014,93(11 Suppl 3):S132-S144.
[11]Barton M,Yanagisawa M.Endothelin: 20 years from discovery to therapy[J].Can J Physiol Pharmacol,2008,86(8):485-498.
[12]Ieda M,Fukuda K,Hisaka Y,et al.Endothelin-1 regulates cardiac sympathetic innervation in the rodent heart by controlling nerve growth factor expression[J].J Clin Invest,2004,113(6):876-884.
[13]Bunn HF.Erythropoietin[J].Cold Spring Harb Perspect Med,2013,3(3):a11619.
[14]Kuhlmann MT,Kirchhof P,Klocke R,et al.G-CSF/SCF reduces inducible arrhythmias in the infarcted heart potentially via increased connexin43 expression and arteriogenesis[J].J Exp Med,2006,203(1):87-97.
[15]Wei L,Fraser JL,Lu ZY,et al.Transplantation of hypoxia preconditioned bone marrow mesenchymal stem cells enhances angiogenesis and neurogenesis after cerebral ischemia in rats[J].Neurobiol Dis,2012,46(3):635-645.
[16]Tan H,Zhong Y,Shen X,et al.Erythropoietin promotes axonal regeneration after optic nerve crush in vivo by inhibition of RhoA/ROCK signaling pathway[J].Neuropharmacology,2012,63(6):1182-1190.
[17]Shim W,Mehta A,Lim SY,et al.G-CSF for stem cell therapy in acute myocardial infarction: friend or foe?[J].Cardiovasc Res,2011,89(1):20-30.
[18]Liu SP,Lee SD,Lee HT,et al.Granulocyte colony-stimulating factor activating HIF-1alpha acts synergistically with erythropoietin to promote tissue plasticity.[J].PLoS One,2010,5(4):e10093.
[19]Peterson KM,Aly A,Lerman A,et al.Improved survival of mesenchymal stromal cell after hypoxia preconditioning: role of oxidative stress[J].Life Sci,2011,88(1-2):65-73.
[20]Ren H,Cao Y,Zhao Q,et al.Proliferation and differentiation of bone marrow stromal cells under hypoxic conditions[J].Biochem Biophys Res Commun,2006,347(1):12-21.
[21]Zhou Y,Guan X,Wang H,et al.Hypoxia induces osteogenic/angiogenic responses of bone marrow-derived mesenchymal stromal cells seeded on bone-derived scaffolds via ERK1/2 and p38 pathways[J].Biotechnol Bioeng,2013,110(6):1794-1804.
(本文编辑郭怀印)
(收稿日期:2015-10-21)
中图分类号:R329
文献标识码:A
doi:10.3969/j.issn.1672-1349.2016.06.013
文章编号:1672-1349(2016)06-0599-05
通讯作者:伍卫,E-mail:wuwei9@mail.sysu.edu.cn
基金项目:广东省医学科研基金资助项目(No.B2013155)

