缺氧诱导因子1α在促卵泡激素促进卵巢癌SKOV3细胞增殖与侵袭中的作用
黄 平,张立民*,黄冬冬,裴新伟,史春燕
(1.河北省沧州市中心医院妇一科,河北 沧州 061000;2.沧州医学高等专科学校诊断教研室,河北 沧州 061000)
·论 著·
缺氧诱导因子1α在促卵泡激素促进卵巢癌SKOV3细胞增殖与侵袭中的作用
黄 平1,张立民1*,黄冬冬2,裴新伟1,史春燕1
(1.河北省沧州市中心医院妇一科,河北 沧州 061000;2.沧州医学高等专科学校诊断教研室,河北 沧州 061000)
目的探讨缺氧诱导因子1α(hypoxia-induced factor-1α,HIF-1α)抑制促凋亡因子Bid、Bim、Puma在卵泡刺激素(follicle-stimulating hormone,FSH)促进卵巢癌SKOV3细胞增殖与侵袭中的作用。方法培养卵巢癌SKOV3细胞株,并分为对照组、FSH组、HIF-1α抑制组,其中FSH组以40 U/L FSH处理SKOV3细胞48 h,HIF-1α抑制组先以HIF-1α抑制剂甲氧基雌二醇(2-Methoxyestradiol,2ME,5 μmol/L)作用72 h,再加入FSH(40 U/L)处理48 h,采用四甲基偶氮唑蓝法(methyl thiazolyl tetrazolium,MTT)检测细胞的增殖能力,体外侵袭实验检测细胞侵袭能力,免疫蛋白印记法检测HIF-1α及促凋亡因子Bid、Bim、Puma的表达。结果与FSH组相比,HIF-1α抑制组细胞增殖率、侵袭能力、HIF-1α表达均明显下降(P<0.05),促凋亡因子Bid、Bim、Puma表达明显上升(P<0.05)。结论FSH可能通过激活HIF-1α降低促凋亡因子Bid、Bim、Puma表达,促进卵巢癌细胞的增殖与侵袭。
卵巢肿瘤;卵泡刺激素;缺氧诱导因子1α
卵巢癌已成导致发达国家妇女死亡的第5位妇科恶性肿瘤[1]。已有研究表明,过量的卵泡刺激素(follicle-stimulating hormone,FSH)通过增加缺氧诱导因子1α(hypoxia-induced factor-1α,HIF-1α)表达,促使肿瘤血管增生、转移,但其具体发生机制至今尚未阐明[2]。Bid、Bim和Puma是Bcl-2家族重要的促凋亡因子,在引发Bax和Bak形成线粒体膜寡聚蛋白通道、释放细胞色素C、促进肿瘤发生和细胞凋亡中起着重要的作用[3]。本研究通过检测FSH对加入HIF-1α抑制剂甲氧基雌二醇(2-Methoxyestradiol,2ME)的卵巢癌SKOV3细胞中Bid、Bim、Puma表达的影响,探讨其肿瘤发生发展机制,旨在为临床研究提供理论依据。
1 资料与方法
1.1 材料来源 卵巢癌细胞株SKOV3由中国医科大学附属盛京医院中心实验室惠赠,沧州市中心医院中心实验室传代保存。注射用重组人FSH购自瑞士Laboratoires Serono SA公司,HIF-1α抑制剂2ME购自美国San Diego公司,兔抗人Bid、Bim、Puma抗体购自美国Abcam公司,山羊抗兔二抗购自武汉博士德生物工程有限公司,胎牛血清、RPMI 1640、胰蛋白酶及青霉素购自美国Gibco公司。
1.2 SKOV3细胞培养 卵巢癌细胞株SKOV3接种于含有10%胎牛血清和100 kU/L青霉素的RPMI 1640培养基中,将培养皿放入37 ℃、5%CO2的培养箱(Thermo,美国)中培养,细胞呈贴壁生长,当细胞生长至70%~80%时,胰蛋白酶消化、传代,取对数生长期的SKOV3细胞用于实验。
1.3 四甲基偶氮唑蓝法(methyl thiazolyl tetrazolium,MTT)检测SKOV3细胞的增殖能力 将实验细胞分为3组,即对照组、FSH组、HIF-1α抑制组,其中HIF-1α抑制组中已使用HIF-1α抑制剂2ME(5 μmol/L)作用72 h。常规胰酶消化计数后,取96孔培养板,每孔接种200 μL(含有5×104个细胞),均设置5个复孔,培养6~8 h,待细胞贴壁后,参考既往文献[4-5],FSH组更换为含有FSH 40 U/L的培养基,HIF-1α抑制组更换为含有FSH 40 U/L及2ME 5 μmol/L的培养基。将96孔培养板放入37 ℃、5%CO2的培养箱中培养48 h,以不含有细胞、只加培养基的空白孔作为校准孔。在对照组、FSH组、HIF-1α抑制组细胞中,每孔中加入MTT溶液(5 g/L)20 μL,同样条件下继续孵育4 h后终止培养。弃上清液后每孔加入150 μL二甲基亚砜(dimethyl sulfoxide,DMSO)并振荡10 min,置酶标仪于490 nm波长处测定各孔吸光度(A值),计算细胞生长增殖率,细胞生长增殖率(%)=(AFSH-A空白对照)/(A对照-A空白对照)×100%。实验重复3次并取均值[3]。
1.4 体外侵袭实验检测SKOV3细胞的侵袭能力 在置有聚碳酸酯膜(8 μm孔径)的Transwell小室底部膜的上室面使用100 mL Matrigel铺成人工底模,37 ℃下放置2 h,并置于超净台内紫外线照射风干过夜。使用前30 min重新水化成胶。在预包被的Transwell小室中每孔加入SKOV3细胞悬液200 μL(含有2×104个细胞),其中HIF-1α抑制组中已使用HIF-1α抑制剂2ME(5 μmol/L)作用72 h,下室加入RPMI 1640培养基500 μL,37 ℃、5%CO2的培养箱中培养,待细胞贴壁后,各组更换相应培养基(同MTT法)并处理48 h。使用无菌棉签擦去Transwell小室上未穿过的细胞,风干后用0.1%结晶紫染色30 min,倒置显微镜下(×100)计数10个不同视野中的穿膜细胞数。实验重复3次并取均值[6]。
1.5 蛋白免疫印迹分析 同MTT法分组及处理, FSH组以40 U/L的FSH处理SKOV3细胞48 h,HIF-1α抑制组中先以HIF-1α抑制剂2ME(5 μmol/L)作用72 h,再加入FSH(40 U/L)处理48 h。收集各组细胞并使用裂解液(碧云天生物制剂有限公司,中国)将细胞裂解,煮沸使蛋白变性,使用BCA蛋白定量试剂盒(碧云天生物制剂有限公司,中国)检测蛋白质浓度。50 μg蛋白质上样后6聚丙烯酰氨凝胶电泳中电流恒定进行电泳,电压恒定湿转至聚偏氟乙烯(PVDF)膜,5%脱脂奶粉室温封闭1 h后,TBST洗膜,分别加入兔抗人Bid、 Bim、Puma或HIF-1α(1∶500),37 ℃ 下1 h孵育后,TBST洗膜3次,每次10 min。山羊抗兔二抗(1∶1 000)25 ℃ 1 h孵育,TBST洗膜3次,每次10 min,ECL发光,以GADPH作为内参照[3]。

2 结 果
2.1SKOV3细胞生长增殖率与细胞侵袭能力比较MTT比色法检测显示,SKOV3细胞在经过浓度为40U/L的FSH处理48h后,其细胞增殖率明显高于对照组(P<0.05)。 经过HIF-1α抑制剂2ME(5μmol/L)预先处理72h后,HIF-1α抑制组细胞增殖率与FSH组相比明显降低(P<0.05),但仍高于对照组(P<0.05)。FSH组的穿过细胞数明显多于对照组(P<0.05),而HIF-1α抑制组的穿过细胞数明显少于FSH组(P<0.05),但仍高于对照组(P<0.05)。见表1。
表1 3组SKOV3细胞生长增殖率和细胞侵袭能力比较
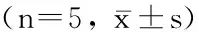

组别 细胞增殖率(%)穿过细胞数(个)对照组100.00±1.1324.0±8.0FSH组173.21±0.93*125.0±16.0*HIF-1α抑制组126.73±1.18*#45.0±10.0*# F5824.930101.441 P0.0000.000
*P<0.05与对照组比较 #P<0.05与FSH组比较(SNK-q检验)
2.2 SKOV3细胞中HIF-1α、Bid、Bim及Puma蛋白的表达 与对照组比较,FSH组中HIF-1α蛋白表达量明显升高(P<0.05);与FSH组比较,HIF-1α抑制组中HIF-1α表达量明显下降(P<0.05);与对照组比较,FSH组Bid、Bim和Puma蛋白的表达明显降低(P<0.05),与FSH组比较,HIF-1α抑制组的Bid、Bim和Puma蛋白的表达明显回升,但仍低于对照组(P<0.05)。见图1,表2。

图1 SKOV3细胞中HIF-1α、Bid、Bim及Puma蛋白表达
C.对照组;F.FSH组,H.HIF-1α抑制组
表2 3组SKOV3细胞中HIF-1α、Bid、 Bim及Puma蛋白表达比较
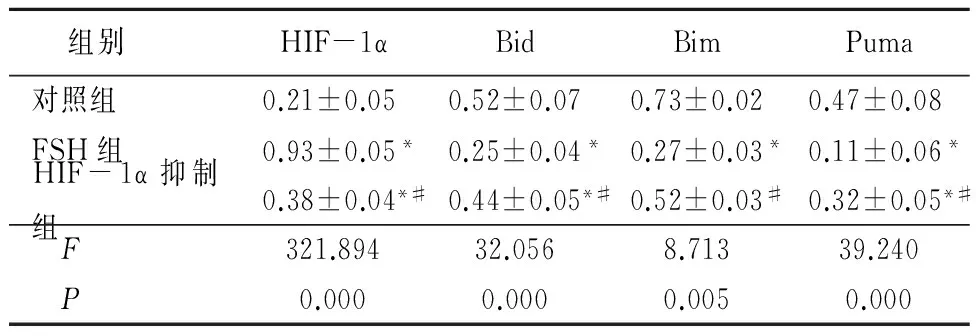
组别 HIF-1αBidBimPuma对照组0.21±0.050.52±0.070.73±0.020.47±0.08FSH组0.93±0.05*0.25±0.04*0.27±0.03*0.11±0.06*HIF-1α抑制组0.38±0.04*#0.44±0.05*#0.52±0.03#0.32±0.05*# F321.89432.0568.71339.240 P0.0000.0000.0050.000
*P<0.05与对照组比较 #P<0.05与FSH组比较(SNK-q检验)
3 讨 论
本研究观察了卵巢癌SKOV3细胞在给予FSH处理和HIF-1α抑制剂后对细胞增殖率和侵袭能力的影响,并观察了2种处理对促凋亡因子Bid、Bim、Puma的影响。结果发现,FSH能够显著提高SKOV3细胞增殖率及侵袭能力,并降低促凋亡因子Bid、Bim、Puma的表达,但经过HIF-1α抑制剂2ME处理后,FSH提高SKOV3细胞增殖率及侵袭能力的作用显著下降,促凋亡因子Bid、Bim、Puma的表达显著升高。表明FSH促进卵巢癌SKOV3细胞增殖及侵袭的作用可能与增加HIF-1α表达后抑制Bid、Bim、Puma表达有关。
FSH作为腺垂体分泌的一种糖蛋白激素,在促进卵巢癌的增殖及侵袭中发挥着重要的作用[7]。根据既往国内外的研究以及我们的预实验,采用40 U/L FSH处理SKOV3细胞48 h,发现细胞的增殖率及侵袭能力最高,同时,这一浓度在绝经后妇女外周血FSH水平范围内,支持促性腺激素致癌的观点[7-8]。
FSH通过激活HIF-1α在促进卵巢癌细胞增殖与侵袭过程中发挥着重要作用[9]。本研究在给予HIF-1α抑制剂2ME处理SKOV3细胞后,HIF-1α表达下降,FSH提高SKOV3细胞增殖率及侵袭能力的作用也显著下降,与之前的研究结果一致[10]。表明HIF-1α在接受到FSH信号传导后可能通过抑制凋亡或促进增殖基因的表达诱发卵巢癌细胞的增殖与侵袭。
通过进一步的研究发现,促凋亡因子Bid、Bim和Puma在接受HIF-1α抑制剂2ME处理后表达增加,说明HIF-1α的表达下降可能导致促凋亡因子Bid、Bim和Puma的表达上升,促进细胞凋亡。Bid、Bim、Puma可以通过激动Bak、Bax或者使Bcl-2、Bcl-XL、MCL-1失活,促进Bak和Bax形成寡二聚体,介导细胞色素C从线粒体释放入细胞质。最近引人注目的一项发现表明,通过Bid、Bim和Puma基因共敲除鼠的研究发现,Bid、Bim和Puma能够直接激活Bax和Bak,从而启动凋亡程序。既往的各种研究表明Bid、Bim和Puma作为促凋亡的关键分子,引发Bax和Bak形成线粒体膜寡聚蛋白通道,释放细胞色素C,促进细胞凋亡[3,11]。
在体外实验中,结肠癌细胞已被证实在缺氧条件下Bid mRNA和蛋白表达均受到抑制,这可能是由于HIF-1α通过与Bid的启动子相结合抑制Bid表达所导致的[12]。另外一项研究也发现,结肠癌患者肿瘤组织中HIF-1α表达增高细胞和组织中伴有Bid表达的下降,而HIF-1α表达降低细胞和组织中伴有Bid表达的上升[4]。在众多肿瘤细胞的失巢性凋亡抵抗机制中,HIF-1α减少Bim表达也成为近来所关注的热点[13-14]。在卵巢癌抗药试验中Puma基因表达的增加也伴有HIF-1α的表达下降[15]。以上研究及本研究结果均表明,抑制HIF-1α可能通过促进Bid、Bim、Puma表达引发细胞凋亡。
综上所述,本研究发现FSH能够显著提高SKOV3细胞增殖率及侵袭能力,并降低促凋亡因子Bid、Bim、Puma的表达,但经过HIF-1α抑制剂2ME处理后,FSH提高SKOV3细胞增殖率及侵袭能力的作用显著下降,而促凋亡因子Bid、Bim、Puma的表达显著提高。说明FSH可能通过激活HIF-1α降低促凋亡因子Bid、Bim、Puma表达,从而促进卵巢癌细胞的增殖与侵袭,这可能为卵巢癌的治疗提供新的思路。
[1] Luvero D,Milani A,Ledermann JA. Treatment options in recurrent ovarian cancer:latest evidence and clinical potential[J]. Ther Adv Med Oncol,2014,6(5):229-239.
[2] Assou S,Haouzi D,Dechaud H,et al. Comparative gene expression profiling in human cumulus cells according to ovarian gonadotropin treatments[J]. Biomed Res Int,2013,2013:354582.
[3] Zhang L,Zhao X,Jiang X. Sevoflurane post-conditioning protects primary rat cortical neurons against oxygen-glucose deprivation/resuscitation:roles of extracellular signal-regulated kinase 1/2 and bid,bim,puma[J]. Neurochem Res,2015 [Epub ahead of print].
[4] Gao C,Li S,Zhao T,et al. Scf,regulated by HIF-1α,promotes pancreatic ductal adenocarcinoma cell progression[J]. PloS One,2015,10(3):e0121338.
[5] Liu L,Zhang J,Fang C,et al. Oct4 mediates FSH-induced epithelial-mesenchymal transition and invasion through the ERK 1/2 signaling pathway in epithelial ovarian cancer[J]. Biochem Biophys Res Commun,2015,461(3):525-532.
[6] Wen Z,Zhao S,Liu S,et al. Microrna-148a inhibits migration and invasion of ovarian cancer cells via targeting sphingosine-1-phosphate receptor 1[J]. Molecular Medicine Reports,2015 [Epub ahead of print].
[7] Yang Y,Zhang J,Zhu Y,et al. Follicle-stimulating hormone induced epithelial-mesenchymal transition of epithelial ovarian cancer cells through follicle-stimulating hormone receptor PI3K/Akt-snail signaling pathway[J]. Int J Gynecol Cancer,2014,24(9):1564-1574.
[8] Zhang HH,Xu PY,Wu J,et al. Dehydroepiandrosterone improves follicular fluid bone morphogenetic protein-15 and accumulated embryo score of infertility patients with diminished ovarian reserve undergoing in vitro fertilization:a randomized controlled trial[J]. J Ovarian Res,2014,7:93.
[9] Zhang Z,Wang Q,Ma J,et al. Reactive oxygen species regulate FSH-induced expression of vascular endothelial growth factor via Nrf2 and HIF1α signaling in human epithelial ovarian cancer[J]. Oncol Rep,2013,29(4):1429-1434.
[10] Xu CL,Lu XL,Yan XN,et al. Effects of PI3K/Akt/NF-κB signal pathway on FSH facilitation on cell proliferation and invasion by human epithelial ovarian cancer[J]. Zhonghua Fu Chan Ke Za Zhi,2012,47(2):134-138.
[11] 申薇,梁冰锋,李秀荣,等.卵巢癌耐药细胞株SKOV3/DDP的建立及其与凋亡途径蛋白的关系[J].河北医科大学学报,2014,35(10):1135-1139.
[12] Chen Y,Xu G,Zheng Y,et al. Nanoformulation of D-α--tocopheryl polyethylene glycol 1000 succinate-b-poly(ε-caprolactone-ran-glycolide) diblock copolymer for siRNA targeting HIF-1α for nasopharyngeal carcinoma therapy[J]. Int J Nanomedicine,2015,10:1375-1386.
[13] Maroni P,Bendinelli P,Matteucci E,et al. Osteolytic bone metastasis is hampered by impinging on the interplay among autophagy,anoikis and ossification[J]. Cell Death Dis,2014,5:e1005.
[14] Whelan KA,Schwab LP,Karakashev SV,et al. The oncogene HER2/neu (ERBB2) requires the hypoxia-inducible factor HIF-1 for mammary tumor growth and anoikis resistance[J]. J Biol Chem,2013,288(22):15865-15877.
[15] Gu J,Tang Y,Liu Y,et al. Murine double minute 2 siRNA and wild-type p53 gene therapy enhances sensitivity of the SKOV3/DDP ovarian cancer cell line to cisplatin chemotherapy in vitro and in vivo[J]. Cancer letters,2014,343(2):200-209.
2015-05-13;
2015-06-25
黄平(1978-),女,河北沧州人,河北省沧州市中心医院主治医师,医学硕士,从事妇科疾病诊治研究。
*通讯作者。E-mail:azai2005@sina.com
10.3969/j.issn.1007-3205.2016.04.020
R737.31
B
1007-3205(2016)04-0450-04
许卓文)

