运动训练对脑出血大鼠脑组织中特异性脑源蛋白B表达的影响
孙 皓,王多姿,郭富强
(1.成都市双流县第一人民医院神经内科,四川 成都 610200;2.四川省医学科学院·四川省人民医院神经内科,四川 成都 610072)
运动训练对脑出血大鼠脑组织中特异性脑源蛋白B表达的影响
孙 皓1,王多姿2,郭富强2
(1.成都市双流县第一人民医院神经内科,四川 成都 610200;2.四川省医学科学院·四川省人民医院神经内科,四川 成都 610072)
目的 探讨运动训练对脑出血大鼠脑组织中特异性脑源蛋白B(S100B)表达的影响。方法 采用自体血注入法将80只SD大鼠制作成右侧纹状体脑出血模型,造模成功后随机分为对照组和运动训练组(运动组),每组又分为1、3、7、14、21 d亚组各8只。运动组行网屏训练、平衡木训练、滚笼训练,对照组不作任何干预。分别于不同时间点对大鼠进行神经功能评分,取右侧脑组织用免疫组化和原位杂交的方法检测S100B的蛋白及mRNA表达。结果 在脑出血后14 d和21 d运动组大鼠的神经功能评分优于对照组;在脑出血后7 d运动组大鼠的S100B表达低于对照组(P< 0.05)。结论 运动训练可使脑出血大鼠脑组织内S100B的含量降低,这可能是运动训练促进神经功能的恢复机制之一。
脑出血;运动训练;S100B;神经功能
脑出血是一类致死率和致残率都很高的疾病[1]。特异性脑源蛋白B(S100B)在脑出血病理损伤过程中发挥着重要作用[2,3]。运动训练能对脑出血后脑的可塑性和神经功能的恢复产生积极的影响[4~7],但具体发生的机制并不十分清楚。目前国内外研究运动训练对脑组织中S100B表达影响的报道较少。2007年3~12月作者通过对脑出血大鼠进行运动训练,动态观察脑出血大鼠神经功能评分和脑组织中S100B的蛋白及mRNA表达,探讨运动训练促进脑出血后神经功能恢复的机制。
1 材料与方法
1.1 实验动物及试剂 健康雄性SD大鼠80只,鼠龄3~4个月,体重250~300 g(四川省医学科学院动物中心提供)。饲养1周,使大鼠适应实验室环境。S100B免疫组化试剂盒及原位杂交试剂盒购于武汉博士德生物工程有限公司。
1.2 实验方法
1.2.1 模型制作及分组 用10%水合氯醛(0.33 ml/100 g)腹腔注射麻醉SD大鼠,参照包新民等[8]绘制的大鼠立体定位图谱,定位前囱前0.2 mm,中线右旁开3 mm,垂直进针5.5 mm,为大鼠右侧尾壳核区。断尾取自体血50 μl注入脑内,将80只SD大鼠都制作成右侧纹状体脑出血模型,造模成功后随机分为对照组和运动训练组(运动组),每组包括1、3、7、14、21d亚组各8只,术后将大鼠单独饲养,运动组行运动训练,对照组不作任何干预,在术后1、3、7、14、21d分别进行大鼠的神经功能评分,然后处死大鼠,取右侧脑组织用免疫组化和原位杂交的方法检测S100B的蛋白及mRNA表达。
1.2.2 神经功能评分 在动物清醒后,采用Zausinger法[9]进行神经功能缺损评分。0分:不能自发行走;1分:自由走动状态下向病变对侧旋转;2分:抓住鼠尾,大鼠向病变对侧旋转;3分:对于施向病变对侧压力抵抗下降者;4分:不能伸直病变对侧前爪,甚至全身向对侧屈曲;5分:无神经功能缺损。1~4分判断为模型成功,0分和5分判定为造模失败。
1.2.3 运动训练方法 造模成功24 h后运动训练组大鼠给予滚笼训练、平衡木训练、网屏训练。每周6天,休息1天。①滚笼训练:自制电动网状滚笼,长度100 cm,直径60 cm,中间分为4格,将大鼠放入笼中,滚笼按5 r/min,10分钟/次,1次/天,进行转动。②平衡木训练:取170 cm长、2 cm宽的方木棒作为平衡木,平放于距地面7 cm处,让大鼠在上面爬行,每天训练10 min。③网屏训练:网屏为50 cm×50 cm铁丝网,铁丝直径为2 mm,网眼规格为1 cm×1 cm,网板的左右和上方都有25 cm高的木板框边,网屏距地面高度为80 cm,下方铺以12 cm厚的海绵,先将网屏水平放置并将老鼠置于其上,然后缓慢地将网屏一端抬高,在2 s内将其抬高至垂直位并保持5 s,期间观察大鼠是否会用前爪抓住网屏或从网屏上掉下,每天训练10 min。运动组及对照组在1、3、7、14、21 d分别作神经功能评分,评分方法按照参考文献[10]中介绍的进行。①平衡木行走评测:该项目评分标准共分为6个等级。0分:大鼠能跳上平衡木并在上面移动且不会掉下;1分:能跳上平衡木并在上面移动,掉下机会<50%;2分:能跳上平衡木并在上面移动,掉下机会>50%;3分:大鼠在健侧肢体帮助下能跳上平衡木,但受累的瘫痪肢体不能帮助其向前移动;4分:大鼠在平衡木上不能移动,但不会掉下;5分:将大鼠放在平衡木上即会掉下。②网屏抓握评测:该项目评分标准共分为4个等级。0分:大鼠前爪抓住网屏5 s,期间不会掉下;1分:大鼠暂时抓住网屏并滑落一段距离,但没有从网屏上掉下;2分:在5 s内从网屏上掉下;3分:网屏转动时,大鼠即刻从网屏上掉下。
1.2.4 标本及病理切片的制作 各组大鼠在相应的时间点用10%水合氯醛麻醉,迅速打开胸腔,由心尖部的左心室灌注生理盐水,直至由剪开的右心耳流出的液体清亮为止;然后断头取脑,脑组织标本浸于4 ℃的4%中性多聚甲醛液中固定24~48 h;以针眼为中心取厚约5 mm的冠状切片,石蜡包埋,在切片机上连续切片(厚度3~4 μm);使用免疫组织化学法和原位杂交法分别测定S100B蛋白及mRNA的表达情况。
1.2.5 检测指标及方法 严格按照免疫组化和原位杂交试剂盒提供的步骤进行操作,最后用DAB显色,镜下观察S100B蛋白和mRNA表达。每只大鼠每个指标随机选一张切片,在400倍光镜下随机选择血肿周围的4个互不重叠的视野,每个时点共计32个视野,计数每个视野的阳性细胞数。S100B蛋白和mRNA表达以胞质染成棕黄色的细胞为阳性细胞。
1.3 统计学方法 采用SPSS 13.0统计学软件进行数据处理。计量资料以均数±标准差表示,均经方差齐性及正态性检验,组内比较采用重复测量数据的方差分析及q检验,组间比较采用t检验。P< 0.05为差异有统计学意义。
2 结果
2.1 神经功能评测 两组第14、21 d的平衡木行走评分和网屏抓握评分与第1、3、7 d比较,差异均有统计学意义(P< 0.05);运动组第14、21 d的评分与对照组比较,差异均有统计学意义(P< 0.05),见表1。
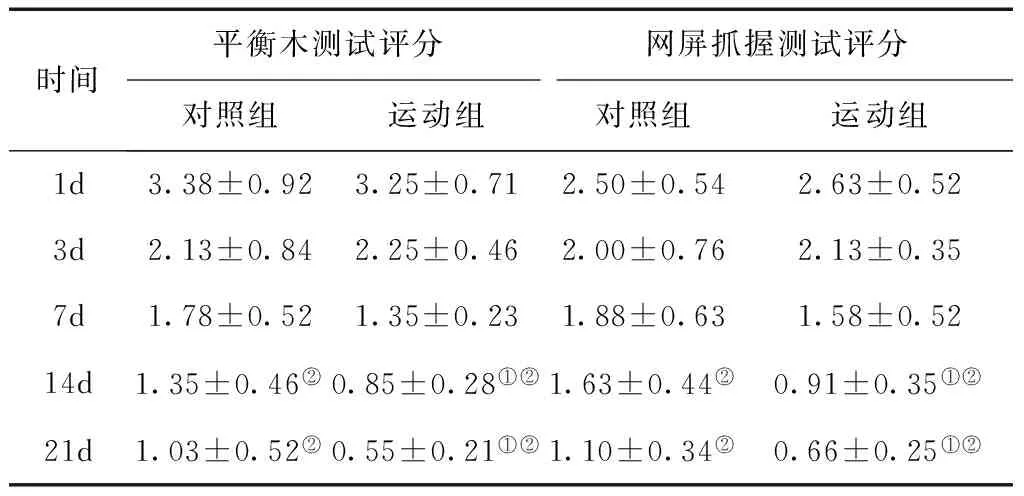
表1 两组不同时间点神经功能评分比较(分)
①与对照组比较,P< 0.05;②与第1、3、7 d比较,P< 0.05
2.2 S100B的蛋白及mRNA表达测定 两组S100B的蛋白表达均在第3 d最高,第21 d降到最低,对照组第3、7 d的水平明显高于第1、14、21 d(P< 0.05),运动组第3 d的水平明显高于第1、7、14、21 d(P< 0.05)。运动组第7 d的水平明显低于对照组(P< 0.05)。两组S100B的mRNA表达均在第3 d最高,第21 d降到最低,第3、7 d的水平明显高于第1、14、21 d(P< 0.05)。运动组第14、21 d的水平明显低于对照组(P< 0.05)。见表2。
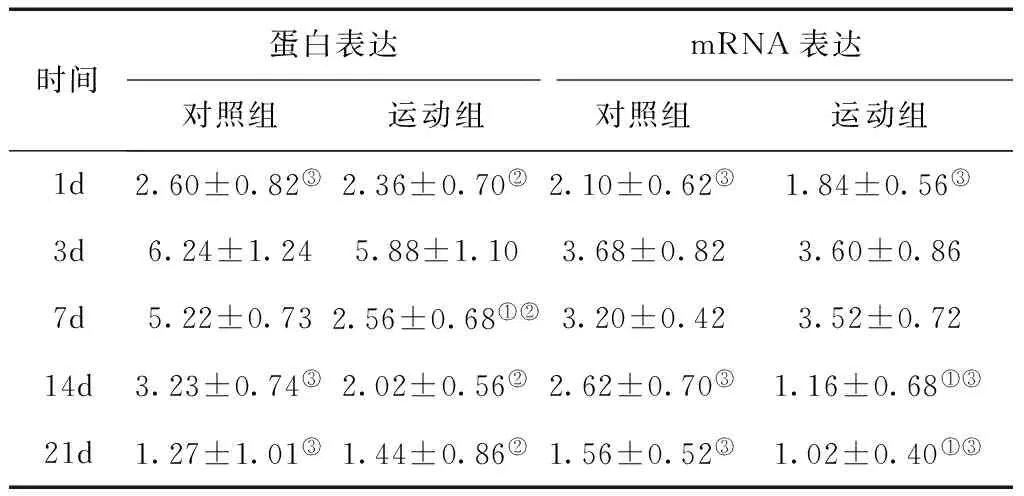
表2 两组不同时间点S100B的蛋白及mRNA表达
①与对照组比较,P< 0.05;②与第3 d比较,P< 0.05;③与第3、7 d比较,P< 0.05
3 讨论
脑出血后在血肿周围组织存在着继发性损伤,许多细胞因子的表达在炎性反应中的作用尤为人们关注,这些细胞因子直接或间接影响着继发损伤的程度[11~13]。S100B蛋白是神经组织蛋白质的一种,其中S100A和S100B是主要成份,它在体内的水平反映了中枢神经系统损伤的程度[2,3,14]。脑内S100B主要由活化的星形胶质细胞产生,其生理浓度具有神经生长因子样作用,促进神经系统的发生、发展。然而,在病理状态下,S100B以高浓度水平存在,能够刺激胶质细胞产生大量致炎因子和一氧化氮,导致神经元功能障碍或死亡,同时,S100B还具有直接神经毒作用[15,16]。因此,近年来S100B也被临床用于评估脑出血患者的预后[17]。
在本研究中,运动组采用网屏训练、滚笼训练、平衡木训练等方法训练脑出血大鼠的抓握、爬行、平衡等能力,在术后第14、21 d,其神经功能恢复优于对照组,说明运动训练可改善脑出血后神经功能的评分,促进脑出血后神经功能的恢复。运动训练能够抑制S100B的表达,减轻脑出血后的炎症反应,从而抑制神经细胞凋亡的发生,起到神经保护的作用,但这种现象的具体机制还不清楚。近年的研究认为:规律的多种运动训练能够诱导抗炎反应,可使肌肉纤维产生具有抗炎效应的细胞因子,如白细胞介素6、白细胞介素10和热休克蛋白70等,这些神经保护因子阻断了炎性反应的部分环节[18~20]。另外一种机制可能是运动训练诱导了雄激素的分泌,雄激素又刺激了促红细胞生成素的分泌[21],促红细胞生成素具有多种生理功能,它既能刺激红细胞的生成,又能改善运动能力[22],可能是通过抑制S100B的合成和分泌[23],同时能够上调热休克蛋白70的表达,从而起到了神经保护的作用[24]。
综上所述,尽管目前脑出血后运动训练促进神经功能恢复的机制还不完全清楚,但本研究结果显示,运动训练使脑组织中S100B的表达下降,故我们认为运动训练能够抑制S100B的表达,减轻血肿周围脑组织的炎性反应,这可能是运动训练促进神经康复的机制之一,更多的作用机制还有待进一步研究。
[1] Bonita R,Mendis S,Truelsen T,et al.The global stroke initiative[J].Lancet Neurol,2004,3:391-393.
[2] Huang M,Dong XQ,Hu YY,et al.High S100B levels in cerebrospinal fluid and peripheral blood of patients with acute basal ganglial hemorrhage are associated with poor outcome[J].World J Emerg Med,2010,1(1):22-31.
[3] Hu YY,Dong XQ,Yu WH,et al.Change in plasma S100B level after acute spontaneous basal ganglia hemorrhage[J].Shock,2010,33(2):134-140.
[4] Dobkin BH.Neurobiology of rehabilitation[J].Ann N Y Acad Sci,2004,1038:148-170.
[5] 刘罡,吴毅,吴军发.脑卒中后大脑可塑性的研究进展[J].中国康复医学杂志,2008,23(1):87-90.
[6] 郑海清,胡昔权,方杰,等.运动训练对脑梗死大鼠梗死边缘区突触可塑性的影响[J].中华医学杂志,2012,92(9):628-633.
[7] 李秋茹,宋春江.早期康复治疗对急性脑卒中患者肢体运动功能及生活能力的影响[J].实用医院临床杂志,2013,10(4):70-71.
[8] 包新民,斯舒云.大鼠脑立体定位图谱[M].北京:人民卫生出版社,1991:26-27.
[9] Faure S,Chapot R,Tallet D,et al.Cerebroprotective effect of angiotensin Ⅳ in experimental ischemic stroke in the rat mediated by AT(4) receptors[J].J Physiol Pharmacol,2006,57(3):329-342.
[10]徐莉,李玲,陈景藻,等.康复训练对大鼠脑梗死神经功能恢复的影响[J].中华物理医学与康复杂志,2000,22(2):86-88.
[11]Xue M,Fan Y,Liu S,et al.Contributions of multiple proteases to neurotoxicity in a mouse model of intracerebral haemorrhage[J].Brain,2009,132(1):26-36.
[12]Hsieh PC,Awad IA,Getch CC,et al.Current updates in perioperative management of intracerebral hemorrhage[J].Neurosurg Clin N Am,2008,19(3):401-414.
[13]Xi G,Keep RF,Hoff JT.Mechanisms of brain injury after intracerebral haemorrhage[J].Lancet Neurol,2006,5(1):53-63.
[14]Tanaka Y,Marumo TH,Omura T,et al.Serum S100B,brain edema,and hematoma formation in a rat model of collagenase-induced hemorrhagic stroke[J],Brain Research Bulletin,2009,78(4-5):158-163.
[15]Donato R,Sorci G,Riuzzi F,et al.S100B’s double life:intracellular regulator and extracellular signal[J].Biochim Biophys Acta,2009,1793(6):1008-1022.
[16]Zimmer DB,Chaplin J,BaldwinA,et al.S100-mediated signal transduction in the nervous system and neurological diseases[J].Cell Mol Biol,2005,51(2):201-214.
[17]王克义,董晓巧,俞文华,等.HSP70、IL-18和S100B水平与脑出血预后的关系研究[J].浙江医学,2010,32(4):457-460.
[18]Pedersen BK.The anti-inflammatory effect of exercise:its role in diabetes and cardiovascular disease control[J].Essays Biochem,2006,42:105-117.
[19]Petersen AM,Pedersen BK.The role of IL-6 in mediating the anti-inflammatory effects of exercise[J].Physiol Phsrmasol,2006,10:43-51.
[20]孙皓,郭富强,王多姿,等.运动训练对脑出血大鼠脑组织中IL-10和caspase-3表达的影响[J].中国康复医学杂志,2009,24(9):783-786.
[21]殷亮,王晓慧.运动时骨骼肌雄激素受体表达和活性改变及其对运动能力的影响[J].中国运动医学杂志,2013,32(3):269-274.
[22]Schuler B,Vogel J,Grenacher B,et al.Acute and chronic elevation of erythropoietin in the brain improves exercise performance in mice without inducing erythropoiesis[J].FASEB J,2012,26(9):3884-3890.
[23]Bian XX,Yuan XS,Qi CP.Effect of recombinant human erythropoietin on serum S100B protein and interleukin-6 levels after traumatic brain injury in the rat[J].Neurol Med Chir (Tokyo),2010,50(5):361-366.
[24]肖现,蒋晓帆,章翔,等.促红细胞生成素对大鼠激光脑损伤神经保护作用的实验研究[J].中华神经外科疾病研究杂志,2009,8(6):492-495.
Effect of exercise on S100B expression in the brain of rats after intracerebral hemorrhage
SUN Hao1,WANG Duo-zi2,GUO Fu-qiang2
(1.Department of Neurology,Shuangliu County First People’s Hospital,Chengdu 610042,China;2.Department of Neurology,Sichuan Academy of Medical Sciences & Sichuan Provincial People’s Hospital,Chengdu 610072,China)
GUOFu-qiang
Objective To investigate the correlation between exercise and S100B expression in rat brain after intracerebral hemorrhage (ICH).Methods A model of ICH was created by injection of their autoblood into right striatum in 80 Sprague-Dawley (SD) rats.The successful models were randomly divided into exercise group (Group E) and control group (Group C),each group including subgroups of 1,3,7,14 and 21d.Animals in the group E were exercised with rolling cage training,net curtain training and walking balance wood training,while rats of the group C had no intervention.The rats were evaluated neurological function at the different time points.Then,the animals were executed to take out the right brain for detection of S100B expression at transcription and translation levels by using immunohistochemistry and hybridization in situ.Results The neurological function score in the group E at the 14d and 21d was better than that in the group C.The expression of S100B in the group E was lower than that in the group C.Conclusion Exercise could decrease the S100B expression in the brain of ICH rat.Exercise could be one of mechanisms of promoting neurological function recovery.
Intracerebral hemorrhage; Exercise; S100B; Neurological function
四川省卫生厅科研基金资助项目(编号:020019);四川省中医药管理局科研基金资助项目(编号:200669)
郭富强
R743.34
A
1672-6170(2016)04-0070-03
2015-11-03;
2016-04-23)

