HPLC-MS法分析玉米须中黄酮苷类化合物
李 强, 李 婷, 王丹丹, 任 虹
(北京工商大学食品学院/北京市食品风味化学重点实验室/北京市食品添加剂工程技术研究中心/食品质量与安全北京实验室,北京 100048)
HPLC-MS法分析玉米须中黄酮苷类化合物
李 强, 李 婷, 王丹丹, 任 虹*
(北京工商大学食品学院/北京市食品风味化学重点实验室/北京市食品添加剂工程技术研究中心/食品质量与安全北京实验室,北京 100048)
研究了玉米须中的黄酮苷类成分。通过硅胶柱层析和Sephadex LH-20层析对玉米须乙酸乙酯提取物初步纯化,采用液相色谱-质谱联用法对其中的黄酮苷类化合物进行分析。结果表明,玉米须乙酸乙酯提取物中含有3种黄酮苷类化合物,分别为5,7,4′-三羟基-3′-甲氧基黄酮-6-C-2"-O-二鼠李糖苷、5,7,4′-三羟基-3′-甲氧基黄酮-3-C-阿拉伯糖-6-C-鼠李糖苷和ax-5"-甲烷-3′-甲氧基玉米素。
玉米须;黄酮苷类;HPLC-MS法
玉米须是禾本科玉蜀黍属植物玉米(Zea mays L.)在成熟收获季节的雌花花柱和柱头。现代药理研究表明玉米须富含黄酮及其苷类、多糖、甾醇、生物碱、有机酸、挥发油、微量元素以及维生素等多种成分[1],具有显著的利尿、降血糖、抑菌、增强免疫、抗氧化、抗癌等功效[2-6]。临床上,玉米须广泛用于高血压、胆道结石、糖尿病等多种疾病的临床治疗[1]。作为农作物玉米生产中的副产物,玉米须来源丰富,价格低廉,易于采集,是一种有待全面开发利用的药用资源。黄酮苷类化合物是玉米须的主要活性成分之一,其分离纯化及活性成为研究热点。目前,大多热衷于玉米须总黄酮苷的提取工艺[7-10],但对玉米须中含有的黄酮苷类化合物成分的报道较少。本实验通过硅胶柱层析和Sephadex LH-20凝胶柱层析对玉米须乙酸乙酯提取物进行分离纯化,采用液相色谱-质谱(high performance liquid chromatography-mass spectrometry,HPLC-MS)联用法分析其黄酮苷类化合物,为玉米须药食同源资源的研究开发提供科学依据。
1 材料与方法
1.1 材料与试剂
玉米须购于山东沂南;甲醇、乙腈(均为色谱纯),Fisher公司;无水甲醇、二氯甲烷、无水乙醇、乙酸乙酯(均为分析纯),北京化工厂;硅胶,青岛海洋化工厂;LH-20型Sephadex,北京博雅宏兴科技有限公司。
1.2 仪器与设备
ME102E/02型电子天平,梅特勒-托利多(上海);SHB-Ⅲ型循环水式多用真空泵,郑州长城科工贸有限公司;RE-520型旋转蒸发仪,上海亚荣仪器厂;1200型高效液相色谱仪、1100型高效液相色谱仪,美国Agilent公司;Deca co型质谱仪,美国Thermo Fisher公司。
1.3 实验方法
1.3.1 玉米须乙酸乙酯提取物萃取
称取3. 5 kg玉米须粉末,用体积分数70%乙醇以料液比1:15(g:mL)浸提3次,每次3 h,过滤,合并滤液,45℃下真空旋转蒸发浓缩。分别用等体积的二氯甲烷、乙酸乙酯对浓缩液进行分级萃取,并将各提取层提取液旋转蒸发浓缩得到不同提取层的浸膏,其中二氯甲烷层浸膏60. 20 g,乙酸乙酯层浸膏19. 95 g。
1.3.2 玉米须乙酸乙酯提取物纯化
采用反复硅胶柱层析和凝胶柱层析方法对乙酸乙酯层浸膏进行纯化,流程见图1。具体操作如下: 1)称取20 g硅胶拌样,选择减压柱型号为6. 5 cm× 30 cm,采用干法装柱,用真空泵抽实,依次用二氯甲烷,二氯甲烷:甲醇(50:1,4:1),甲醇梯度洗脱,每种洗脱剂洗脱3次,根据薄层层析结果合并相同流分。2)对组分3再次进行硅胶柱层析,依次用二氯甲烷:甲醇(10:1,8:1,5:1,2:1),甲醇梯度洗脱,对二氯甲烷:甲醇为5:1洗脱组分进行Sephadex LH-20柱层析,收集组分3-1-1。

图1 玉米须乙酸乙酯提取物纯化流程Fig. 1 Flow chart of purified technology
1.3.3 高效液相色谱制备乙酸乙酯提取物成分
采用半制备高效液相色谱对组分3-1-1中的物质进行制备。色谱条件:反相色谱ZORBAX SB-C18半制备柱(250 mm×9. 4 mm,10 μm),流动相为甲醇-水体系,采用甲醇45%(0~45 min),甲醇45%~70%(45~60 min)梯度洗脱,流速为4. 0 mL/ min,进样量100 μL,柱温30℃,280 nm下检测。
1.3.4 LC-MS分析玉米须乙酸乙酯提取物成分
色谱条件:反相色谱ZORBAX SB-C18分析柱(250 mm×4. 6 mm,5 μm),流动相A为0. 1%TFA-水;B为0. 1%TFA-乙腈,梯度10%~100%B(0~20 min),100%B(20~35 min),流速为200 μL/ min,进样量10 μL,柱温30℃,280 nm下检测。
质谱条件:电喷雾离子源,电子能量70 eV,传输线温度275℃,离子源温度200℃,母离子m/ z 285,激活电压1. 5 V,质量扫描范围m/ z 300~1 000。
2 结果与分析
2.1 HPLC制备乙酸乙酯提取物中黄酮类成分
采用三氯化铝显色法测定乙酸乙酯提取物中黄酮质量分数为6. 47%,乙酸乙酯提取物(19. 95g)经过硅胶柱层析和Sephadex LH-20凝胶柱层析纯化后得到组分3-1-1,其液相色谱图如图2。从图中可以看出在保留时间为17. 24,33. 08,35. 21 min时有3个明显吸收峰,分别命名为组分A、组分B和组分C。
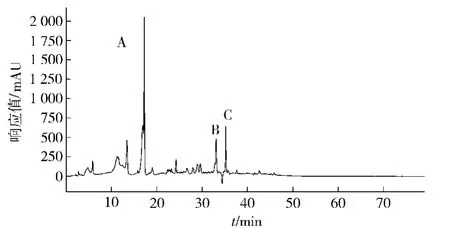
图2 组分3-1-1液相色谱图Fig. 2 HPLC chromatogram of fragment 3-1-1
2.2 HPLC-MS法分析黄酮苷类化合物结构
采用HPLC-MS法对制备得到的化合物A、B、C进行结构推测,见图3~图8。
化合物A呈淡黄色,紫外光谱图(见图3(a))显示其在240~280 nm和320~380 nm都有吸收带,初步判断为黄酮苷类化合物。其正离子一级质谱图(见图4(a))出现m/ z 593. 1[M + H]+离子峰,表明其相对分子质量为592,分子式为C28H32O14,在其二级质谱图(见图4(b))中m/ z 431为[M-Rha + 2H]+峰,提示分子中可能含有鼠李糖基,参照文献[1]推断化合物A为5,7,4′-三羟基-3′-甲氧基黄酮-6-C-2"-O-二鼠李糖苷,其结构如图7(a),其MS裂解过程如图8(a)。
化合物B呈淡黄色,紫外光谱图(见图3(b))与化合物A相似,在240~280 nm和320~380 nm都有吸收带,初步判断为黄酮苷类化合物,其正离子一级质谱图(见图5(a))出现m/ z 579.1[M +H]+离子峰,表明其相对分子质量为578,分子式为C27H30O14,在其二级质谱图(见图5(b))中m/ z 301为[M-280 +3H]+峰,推测可能是黄酮C环产生RDA裂解。参照文献[11]推断化合物B为5,7,4′-三羟基-3′-甲氧基黄酮-3-C-阿拉伯糖-6-C-鼠李糖苷,其结构如图7(b),其MS裂解过程如图8(b)。

图3 化合物A、B、C紫外图谱Fig. 3 UV spectrum of compound A,B and C
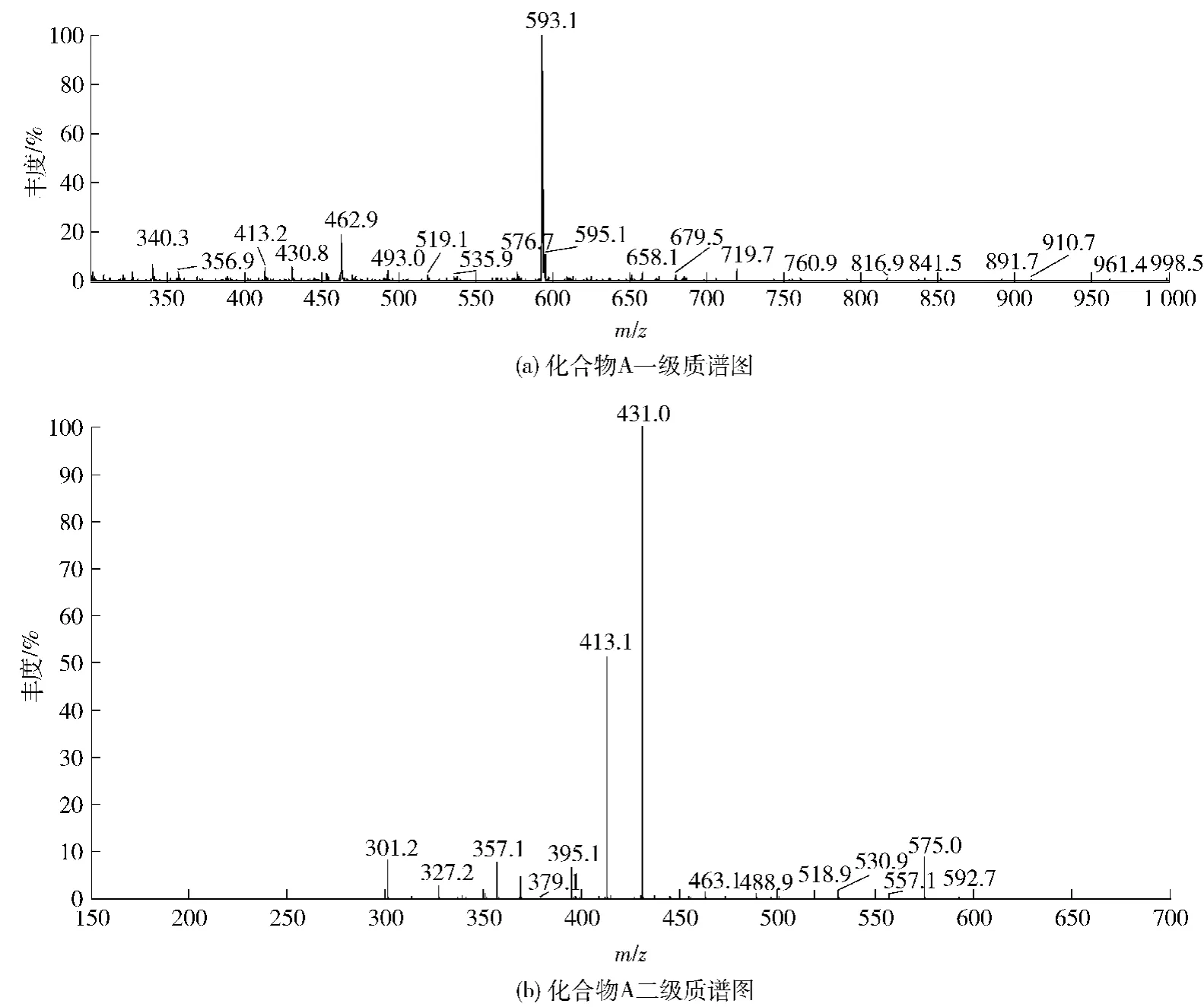
图4 化合物A质谱图Fig. 4 MS spectrum of compound A
化合物C呈淡黄色,紫外光谱图(见图3(c))也与化合物A相似,在240~280 nm和320~380 nm都有吸收带,是黄酮苷类化合物,其正离子一级质谱图(见图6(a))出现m/ z 590. 9[M + H]+离子峰,表明其相对分子质量为590,分子式为C28H30O14,在其二级质谱图(见图6(b))中m/ z 445为[M-Rha + 2H]+峰。参照文献[12]推断化合物C为ax-5"-甲烷-3′-甲氧基玉米素,其结构如图7(c),其MS裂解过程如图8(c)。
3 结 论
玉米须乙酸乙酯提取物的主要活性成分为黄酮苷类物质,其结构类型、含量与其产地、品种及采收时期等多因素有关,萃取溶剂不同,得到的成分也不同。张慧恩等[13]从产自无锡玉米须中分离纯化出3个黄酮苷类化合物,分别为刺芒柄花素,2"-O-α-L-鼠李糖基-6-C-(3-脱氧葡萄糖基)-3"-甲氧基木犀草素和2"-O-α-L-鼠李糖基-6-C-(6-脱氧-ax-5甲基-木-己-4-羰基)-3"-甲氧基木犀草素。徐燕等[14]从产自安徽的玉米须中分离得到6-乙酰基-木犀草素。任顺成等[15-16]在玉米须黄酮的含量测定、分离纯化方面做了大量研究,并通过柱层析法得到6个黄酮类化合物,经鉴定其中4个分别为ax-5"-methane-3′-metho xymaysin、2"-O-α-L-鼠李糖基-6-C-岩藻糖基-3′-甲氧基木犀草素、7,4′-二羟基-3′-甲氧基黄酮-2"-O-α-L-鼠李糖基-6-C-岩藻糖苷、6,4′-二羟基-3′,5′-二甲氧基黄酮-7-O-葡萄糖苷。
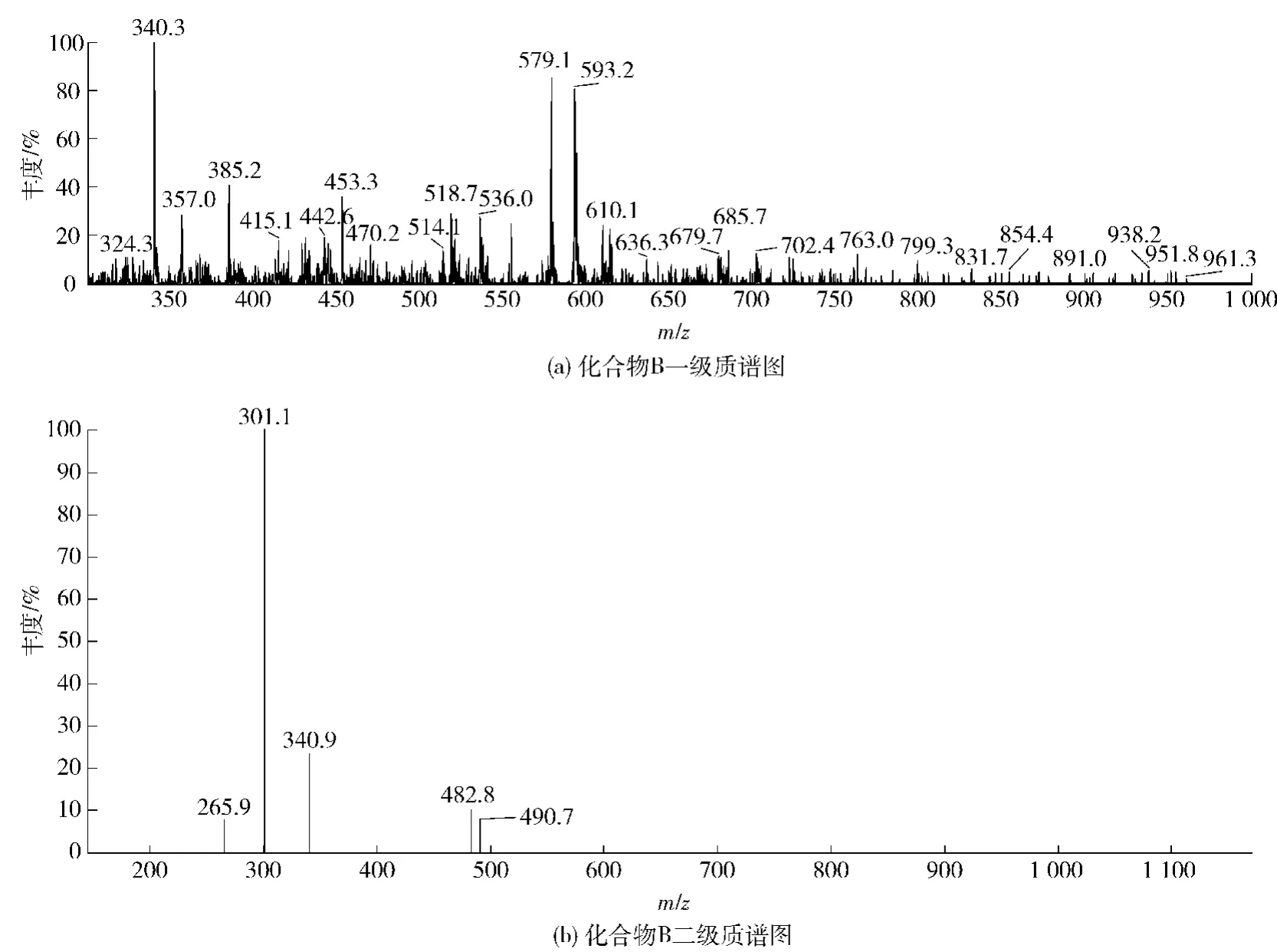
图5 化合物B质谱图Fig. 5 MS spectrum of compound B
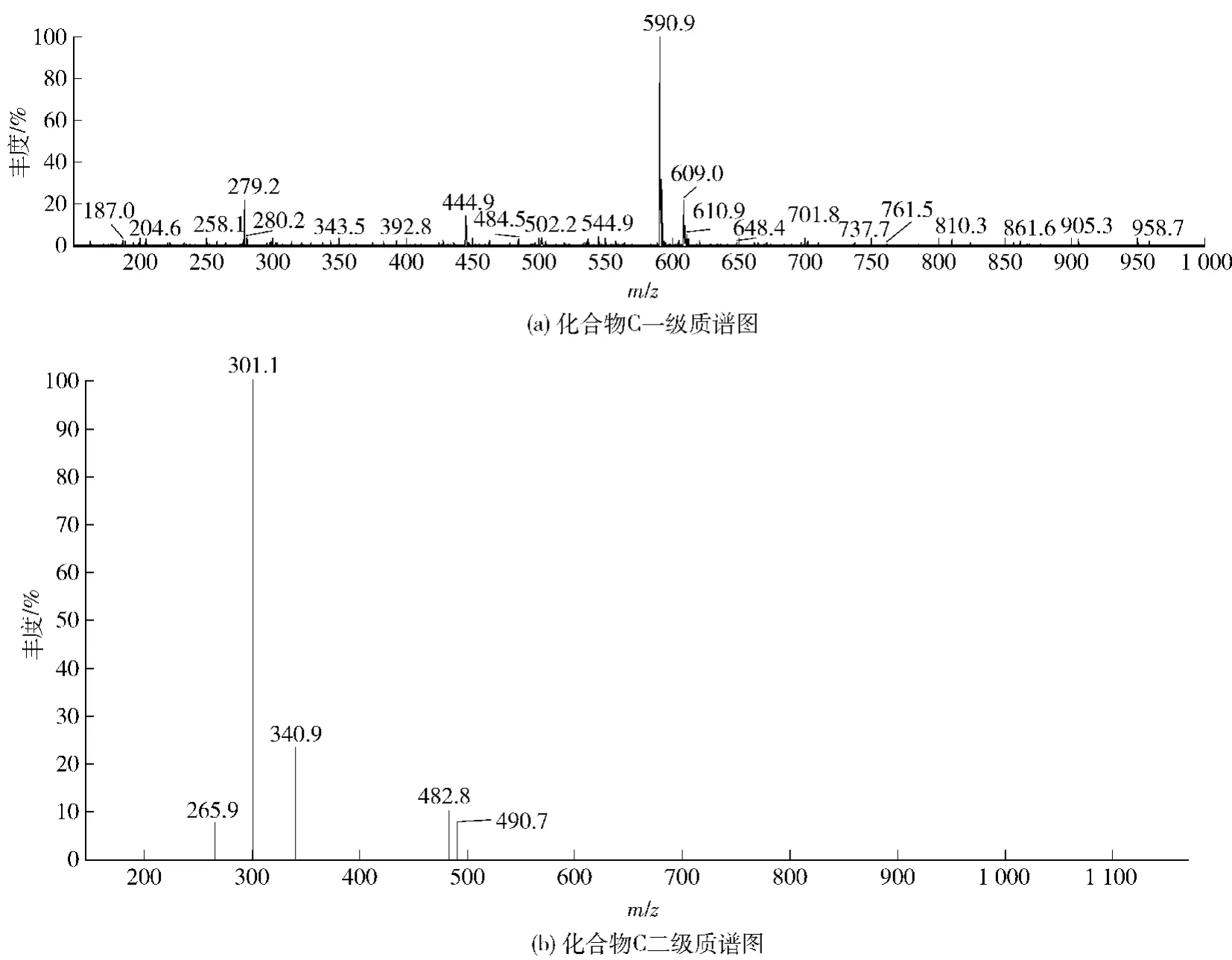
图6 化合物C质谱图Fig. 6 MS spectrum of compound C
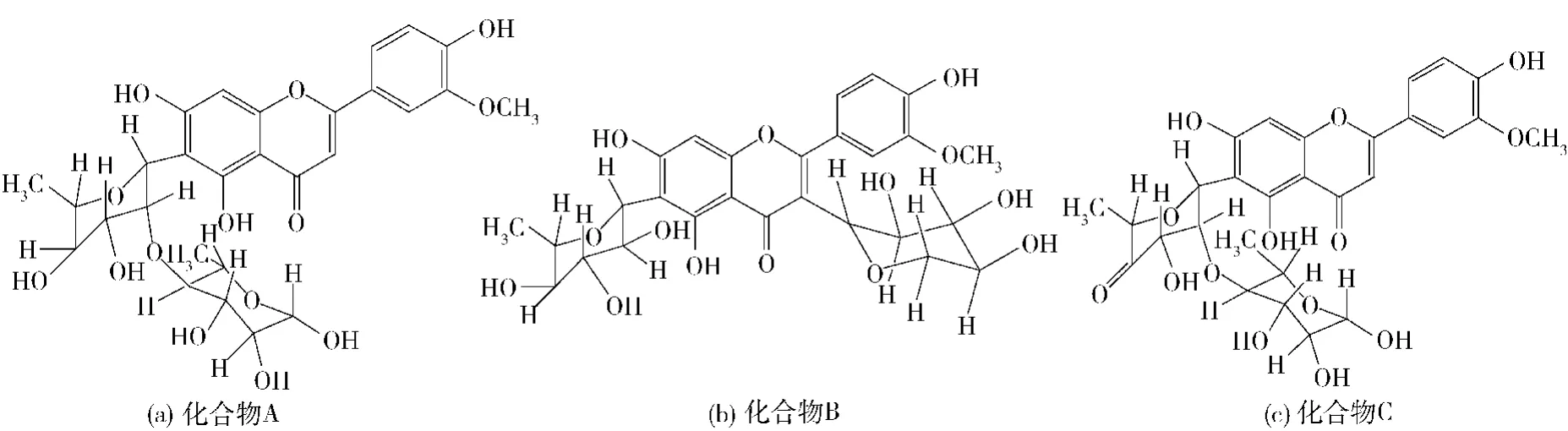
图7 化合物A、B、C结构Fig. 7 Chemical structures of compound A,B,and C
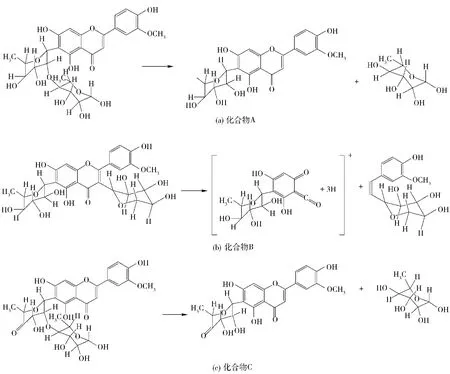
图8 化合物A、B、C裂解过程Fig. 8 Pyrolysis process of compound A,B,and C
本实验通过硅胶柱层析和Sephadex LH-20柱层析对山东产玉米须乙酸乙酯提取物中黄酮苷类成分进行分离纯化,并利用半制备高效液相色谱制备,采用HPLC-MS法分析得到3个黄酮苷类化合物,分别是5,7,4′-三羟基-3′-甲氧基黄酮-6-C-2"-O-二鼠李糖苷、5,7,4′-三羟基-3′-甲氧基黄酮-3-C-阿拉伯糖-6-C-鼠李糖苷和ax-5"-甲烷-3′-甲氧基玉米素。
[1] HASANUDIN K,HASHIM P,MUSTAFA S. Corn silk (Stigma maydis)in healthcare: a phytochemical and pharmacological review[J]. Molecules,2012,17:9697-9715.
[2] VELAZQUEZ D V O,XAVIER H S,BATISTAC J E M,et al. Zea mays L. extracts modify glomerular function and potassium urinary excretion in conscious rats[J]. Phytomedicine,2005,12.3.3-369.
[3] GUO Jianyou,LIU Tongjun,HAN Linna,et al. The effects of corn silk on glycaemic metabolism[J]. Nutrition & Metabolism,2009(6):47.
[4] LIU Jun,WANG Cuina,WANG Zuozhao,et al. The antioxidant and free-radical scavenging activities of extract and fractions from corn silk(Zea mays L.)and related flavone glycosides[J]. Food Chemistry,2011,126(1): 261-269.
[5] ZHAO Wenzhu,YIN Yongguang,YU Zhipeng,et al. Comparison of anti-diabetic effects of polysaccharides from corn silk on normal and hyperglycemia rats[J]. International Journal of Biological Macromolecules,2012,50 (4):1133-1137.
[6] WANG Guangqiang,XU Tao,BU Xuemei,et al. Antiinflammation effects of corn silk in a rat model of carrageenin-induced pleurisy[J]. Inflammation,2012,35(3):822-827.
[7] 张艳,李海涛,周鸿立.响应面法优化玉米须黄酮提取工艺[J].食品科学,2012,33(18):133-137.
[8] 罗登宏,周桃英.玉米须黄酮的超声波辅助提取工艺[J].江苏农业科学,2012,40(9):269-271.
[9] 郭志红,周鸿立,郭向明. Box-behnken设计优化玉米须黄酮纯化工艺研究[J].食品工业科技,2015(4): 260-264,268.
[10] 李春阳,闫征.大孔树脂分离纯化青玉米须中总黄酮的研究[J].广西农学报,2007,22(5):22-25.
[11] 王英平.玉米须化学成分及其抗氧化作用研究[D].长春:吉林大学,2004.
[12] LIU Jun,WANG Cuina,WANG Zuozhao,et al. The antioxidant and free-radical scavenging activities of extract and fractions from corn silk(Zea mays L.)and related flavone glycosides[J]. Food Chemistry,2011,126:261-269.
[13] 张慧恩,徐德平.玉米须黄酮类成分的研究[J].中药材,2007,30(2):164-166.
[14] 徐燕,梁敬钰,邹忠梅,等.玉米须中的一个新黄酮和两个尿素苷[J].化学学报,2008,66(10):1235-1238.
[15] 任顺成,丁霄霖.玉米须黄酮类成分的提取分离与结构鉴定(Ⅰ)[J].中草药,2004,35(8):857-858.
[16] 任顺成,丁霄霖.玉米须黄酮类成分的提取分离与结构鉴定(Ⅱ)[J].河南工业大学学报(自然科学版),2007,28(4): 34-36,40.
Analysis of Flavonoid Glycosides Derived from Corn Silk by HPLC-MS
LI Qiang, LI Ting, WANG Dandan, REN Hong*
(School of Food and Chemical Engineering/ Beijing Key Laboratory of Flavor Chemistry/ Beijing Engineering and Technology Research Center of Food Additives/ Beijing Laboratory for Food Quality and Safety,Beijing Technology and Business University,Beijing 100048,China)
Composition of flavonoid glycosides in corn silk were analyzed in this study. Ethyl acetate extractive of corn silk was purified by the silica gel column and sephadex LH-20 column chromatography. Flavonoid glycosides in corn silk were analyzed by HPLC-MS. Results showed that ethyl acetate extractive of corn silk had three kinds of flavonoid glycosides,which were 5,7,4′-trihydroxy-3′-methoxyflavone-6-C-2"-O-dirhamnoside,5,7,4′-trihydroxy-3′-methoxyflavone-3-C-arabinose-6-C-rhamnoside,and ax-5"-methane-3′-methoxymaysin were analyzed by HPLC-MS.
corn silk;flavonoid glycosides;HPLC-MS method
檀彩莲)
TS201.2.
A
10. 3969/ j. issn. 2095-6002. 2016. 02. 009
2095-6002(2016)02-0056-06
李强,李婷,王丹丹,等. HPLC-MS法分析玉米须中黄酮苷类化合物[J].食品科学技术学报,2016,34(2):56-61.
LI Qiang,LI Ting,WANG Dandan,et al. Analysis of flavonoid glycosides derived from corn silk by HPLC-MS[J]. Journal of Food Science and Technology,2016,34(2):56-61.
2015-06-24
国家“863”计划项目(2011AA060701)。
李 强,女,硕士研究生,研究方向为天然活性物质;
*任 虹,女,副教授,博士,主要从事天然活性物质方面的研究。通信作者。

