无创产前检测筛查胎儿微缺失微重复综合征阳性病例的临床分析
胡芷洋 高雅 郭辉 林琳华 任景慧 苏放明*
(1.深圳市人民医院,广东 深圳 518020;2.深圳华大基因研究院,广东 深圳 518083)
无创产前检测筛查胎儿微缺失微重复综合征阳性病例的临床分析
胡芷洋1高雅1郭辉2林琳华1任景慧1苏放明1*
(1.深圳市人民医院,广东 深圳518020;2.深圳华大基因研究院,广东 深圳518083)
【摘要】目的探索无创产前基因检测(NIPT)微缺失微重复综合征(MD)阳性病例的产前诊断以及咨询方法。方法对NIPT筛查MD阳性的病例进行产前超声检查、遗传咨询并进行有创性产前诊断,送检核型分析以及基因芯片(CMA)或者多重连接探针扩增技术(MLPA)检查,验证NIPT的结果,同时抽取双亲血样进行核型分析以及MLPA。结果2015年1~5月期间送检1191例NIPT检查,9例MD筛查阳性,其中3例MD筛查阳性病例完成验证检查。NIPT提示18q21.31-q23.23处23M缺失的一例病例,经验证为18q22.3-q23处8.6M的微缺失;另一例NIPT提示9p24.3-9p13.2处36M重复的病例,经验证除了该处有37M左右重复外,另外还有两处5M以下的MD。1例证实为假阳性,该假阳性病例母亲血测序发现有微重复。两名证实MD病例超声检查均发现异常,孕妇选择引产。假阳性病例继续妊娠。结论NIPT可以筛查较大片段的缺失和重复,但对较小的缺失或重复检出能力欠佳,母体背景可以干扰结果。应建议筛查阳性的病例接受有创性产前诊断取样进行验证。
【关键词】无创产前检查;微缺失微重复综合征;产前诊断
新一代测序技术(NGS)快速发展,基于产前无创检测技术(noninvasive prenatal testing, NIPT)检测胎儿21-三体、18-三体和13-三体综合征已成为临床产前筛查的重要部分,其临床价值受到广泛肯定。NIPT在产前筛查诊断的适应证在不断扩大。自从2011年新英格兰医学杂志报道的首例应用NIPT进行胎儿微缺失综合征的产前诊断后[1],国内外相继报道多篇无创检测胎儿微缺失微重复综合征(microdeletion / microduplication syndrome, MD)的案例[2-5]。MD是指亚染色体结构的异常,结构正常的胎儿中约1%~1.7%携带有临床意义的MD[6]。MD患者往往有智力发育障碍伴有或不伴结构异常,如Di-George综合征、X连锁鱼鳞病、猫叫综合征、Angelman综合征等。MD的发生率与孕妇年龄无关,因此在年轻孕妇中,子代发生MD的风险很可能高于发生唐氏综合征的风险[7]。目前,对MD的产前诊断多局限在已有先证者的病例或者超声检查异常的病例,没有生化学指标筛查可筛查MD。虽然利用NIPT技术有可能查出子代的MD,然而在临床处理时,医生需要更为小心谨慎。
本文对本院产前诊断中心5个月中接诊NIPT发现疑似MD病例的诊疗经过进行报道,并对规范临床处理流程进行讨论。
1资料与方法
1.1 研究对象选取2015年1~5月因NIPT结果提示疑似染色体MD而就诊于深圳市人民医院产前诊断门诊并进行侵入性产前诊断病例。穿刺时满16周病例进行羊膜腔穿刺,满23孕周的病例进行脐带穿刺。
1.2研究方法12孕周以上孕妇签署同意书后抽取5ml外周血送深圳华大基因行NIPT,抽血2周后报告结果。NIPT采用高通量测序技术对母血中游离DNA进行低覆盖度全基因组测序,并对测序数据进行比对和计量效应分析评估胎儿21-三体、18-三体、13-三体风险[8],分析方法中包括胎儿基因拷贝数变异分析(fetal copy-number analysis through maternal plasma sequencing,FCAPS)的算法,用于评估胎儿染色体缺失和重复的风险[5, 9]。疑似胎儿MD病例转至产前诊断门诊就诊,由产前诊断中心的超声专家进行三维超声检查。产前诊断医生对孕妇解释NIPT结果,建议进行羊膜腔或脐带穿刺,羊水或脐血标本送检染色体核型以及比较基因组微阵列(CMA,Affymetrix HD)检查或多重连接探针扩增技术(MLPA)检查。根据孕妇意愿以及NIPT报告涉及MD的位点选择进行CMA或MLPA。MLPA采用MRC-Holland的P036、P070、P095以及P245试剂盒检测23种常见微缺失位点、各染色体亚端粒以及近着丝粒位点。穿刺同时抽取母血送核型以及MLPA检测,并另外抽取母血2ml与羊水(羊膜腔穿刺病例,6ml以上)或脐血(脐带穿刺病例,1ml)送华大基因研究院用Hiseq测序进行验证。
2结果
2.1基本资料2015年1月1日至5月15日期间,深圳市人民医院产科门诊共送检1191例NIPT检测,其中9例报告提示胎儿存在疑似MD,3例疑似MD病例完成产前诊断以及验证。3例的NIPT结果中1例为微缺失(23M),2例为重复,大小分别为36M和5M,详细内容见表1。截止到2015年5月15日时未在本院进行产前诊断MD筛查阳性病例中,涉及染色体分别为10号(2例)、3号、13号、15号和18号各1例。
2.2 检测以及验证结果 3例MD疑似病例中,2例细胞核型检查异常,而且CMA或MLPA结果存在MD,但片段大小以及类型与NIPT结果稍有差别。病例1羊水细胞DNA测序检测到缺失大小为8.6M,与CMA检测结果一致,但明显小于NIPT检测报告中的缺失片段;其父母核型以及MLPA未见异常。病例2脐血测序不仅检测到与NIPT报告大小相近的重复,还在9q34.2q34.3和9q34.3处分别检测到1.61M的微重复和3.28M的微缺失;父母核型以及MLPA检查未见异常。1例(病例3)核型分析及测序均未见异常,与NIPT报告不一致;父母核型以及MLPA正常,母血测序发现在18p11.2p11.1处有1.2M大小微重复,详见表1。
2.3妊娠结局病例1以及病例2超声检查均有结构异常(表1)。病例1微缺失片段覆盖KCNG2和PQLC1基因;病例2超声检查存在多个系统的结构异常(图1),衍生染色体片段以及微缺失片段覆盖DOCK8、KANK1、DMART1以及SMARCA2等数个基因区域。经过详细的产前诊断咨询后,两名孕妇决定终止妊娠。病例3则各项检查未见异常,具体资料见表1。截止报告时,病例3仍继续妊娠。
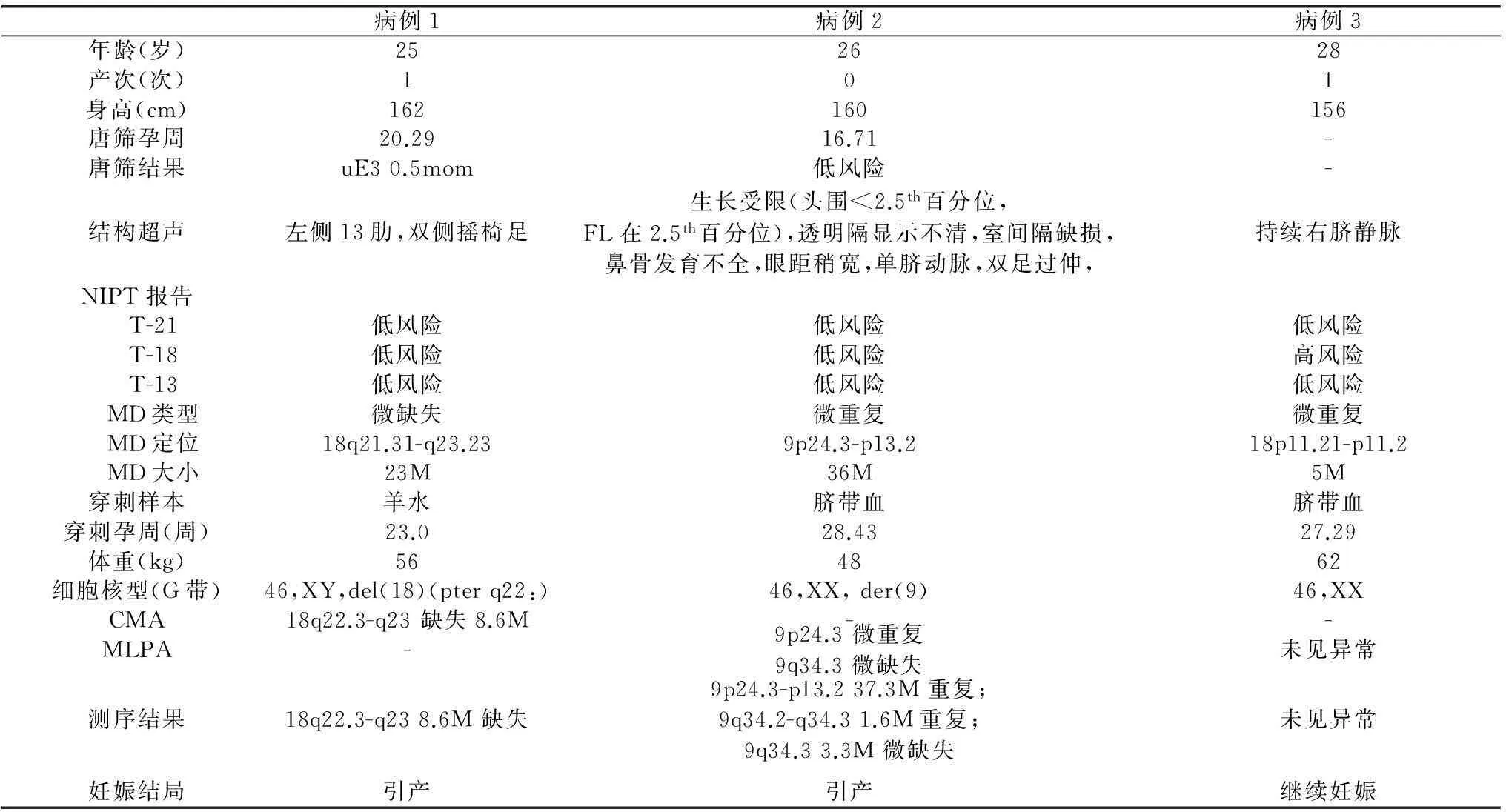
表1 病例资料
注:-: 未进行检查
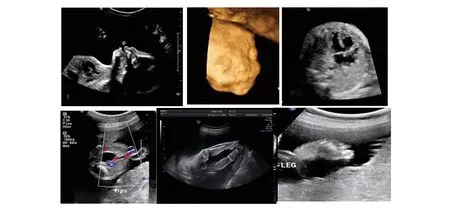
图1 病例2 的超声检查图像提示胎儿鼻骨极小(上左),眼距增宽(上中),心脏室间隔缺损(上右),
3讨论
3.1MD与胎儿异常核型分析只能探测出8~10M以上的缺失或重复,仅有约2%~3%的多发胎儿畸形、不明原因的发育迟缓/智力障碍以及自闭症能通过核型分析查找到原因。利用比较基因组检查(CMA)或NGS可以检测出片段更小的MD,12.2% 的上述异常病例可以通过CMA发现致病片段[10]。病例1缺失的片段位于长臂末端,缺失大小8.56M,接近核型分析分辨率的下限。鉴于NIPT的报告,细胞实验室人员仔细辨认后才发现18q末端的少许缺失。因此在发现胎儿有结构异常时,如果仅进行单纯核型检查极有可能漏诊MD。
病例1缺失片段位于18q末端(18q22.3-q23),超声表现为单侧13肋骨,双足摇椅状。Feenstra等[11]总结29例18q部分缺失病例的临床表型及CMA结果,结合文献,指出18q部分缺失的表型差异性较大,共同特点是特征性面容、身材矮小、外耳道闭锁、足部畸形以及智力发育迟缓,而位于18q22.3-q23处的一段4.3M片段缺失与典型18q部分缺失表现有关。病例1胎儿双足的异常超声改变可能是神经系统发育异常的表现。病例2中胎儿超声表现为小头、透明隔显示不清、短股骨、鼻骨极其短小、眼距宽、双足过伸、单脐动脉以及室间隔缺损,该病例中,9p以及9q两个重复片段共达38.9M,在Decipher数据库中均属于病理性重复,表现为发育迟缓、视力/听力障碍、小头、足部异常、鼻梁塌陷、单脐动脉等表现;此外MLPA及测序均新发现9q34.3存在缺失片段,该片段覆盖SMARCA2,编码基因表达所必需的染色质重组复合物中的一个蛋白,表达异常可以导致Nicolaides-Baraistser 综合征,表现为特殊面容(小头、鼻梁矮塌或狭窄,鼻孔朝上,人中宽长)、严重的智力发育迟缓、语言障碍、暴力倾向、癫痫、身材矮小、掌骨短小而指节突出[12]。以上的特征与病例2 超声表现相符合。
3.2NIPT检测MD的技术路线自从在母血中发现胎儿游离DNA后,无创产前诊断胎儿染色体异常、甚至单基因疾病[13]都陆续成为现实。2011年新英格兰医学杂志报道了首例无创产前诊断胎儿微缺失综合征。该研究利用目标区域测序的方法成功地鉴定出一例12p11.22和12p12.1之间4.2M的缺失[1]。此法仅适用于针对已知先证者缺失的特定部位进行检测。目前,主要通过以下4种方法进行检测:① GC校正及信息对比判定CNV,如2013年Yu等[14]利用Illumina深度全基因测序结合(locally weighted Scatterplot smoothing,LOESS)进行GC含量校正的方法对22q11.2区域3例微缺失、2例微重复样本进行鉴定,分辨率达到3Mb水平[14]; ② 加深测序,如Srinivasan等[15]同样采用Illumina全基因测序的方法对模拟血浆样本进行高深度测序,平均每个样本需要约109条测序读数,通过改进的统计方法,成功鉴定了一例300kb的染色体微缺失,但该方法需要较高的测序深度,成本较高;③ 滑动窗口分析测序数据,此法可以有效减低测序深度,并有助于更准确地确定CNV断点位置;④ 二元分割-双向节段调节阈值的分析法,针对N区的动态调节检测阈值,可以有效提高检测准确度[4]。Rampasek等[16]则通过结合上述四种模式,检测400kb以上的MD的准确度可以高达90% ,但该研究的胎儿DNA浓度高达13%。本研究中, NIPT检测方面结合模式①+③+④,采用华大基因研发的检测流程FCAPS,曾以低于7×106的低测序读数,在1311例受试样本中鉴定出4例微缺失微重复患者(9~28M)[5]。优化数据信息处理模式是提高NIPT检测MD准确性的重要途径。
3.3如何分析NIPT报告MD Cheung SW等[17]总结了5家NIPT公司的307例非整倍体阳性报告病例,T21、T18、T13、X单体和性染色体三体阳性报告中,分别有9%、23%、46%、62% 和17%的病例经验证为正常核型。与检测非整倍体一样,NIPT检测MD的准确性也受到多个因素影响,如胎儿DNA浓度、胎儿胎盘嵌合、母体拷贝数异常等。目前普遍采用的NIPT计算模式均假设所有母亲全部片段的DNA拷贝数是一致的,因此如果母体有缺失或重复时,就可能造成NIPT结果的假阳性或假阴性。Snyder MW等[18]对3例T18假阳性病例母血进行检测,发现2例都有微重复[18]。本文中病例3出现微重复以及T18的假阳性,也可能是由于母亲自身存在微重复,干扰实验结果。因此NIPT筛查MD阳性的病例必须进行侵入性产前诊断进行确认。
此外,2例确认的MD病例中验证检查的片段以及类型与NIPT报告有出入。相对小片段MD(病例1),NIPT对于较大片段MD的具体大小判断(病例2)比较准确。病例1实际缺失大小约为8.56M, NIPT报告为23M;而病例2中9p24.3-p13.2的重复片段大小与NIPT报告相似,但其他的两个1.6M以及3.3M的MD则未能在NIPT中测出。本案例中使用的NIPT采用的测序数据量和FCAPS算法主要是针对检测10M以上的缺失或重复[5],因此对于更小片段的MD,可能需要通过提高测序数据量和优化信息分析方法。本研究中1191例NIPT检查中,仅9例筛查阳性,低于文献中结构正常胎儿中1%~1.7%的MD发生率[6],不排除现有的NIPT方法漏诊更小片段的MD可能。
利用NIPT筛查MD是可能的,但如何选择检测对象值得讨论。如果在胎儿没有结构异常也没有不良生育史、家族史的低危人群中进行普筛,有可能增加许多不必要的侵入性产前诊断操作以及孕妇的焦虑。对待NIPT报告中的MD阳性病例,必须进行详细的超声检查并建议孕妇接受侵入性产前诊断,进行核型分析以及CMA检查确诊,必要时可抽取孕妇血进行对照。
参 考 文 献
[1]Peters D, Chu T, Yatsenko SA, et al. Noninvasive prenatal diagnosis of a fetal microdeletion syndrome[J]. N Engl J Med, 2011, 365: 1847-1848.
[2]Jia Y, Zhao H, Shi D, et al. Genetic effects of a 13q31.1 microdeletion detected by noninvasive prenatal testing (NIPT)[J]. Int J Clin Exp Pathol, 2014, 7: 7003-7011.
[3]Yatsenko SA, Peters DG, Saller DN, et al. Maternal cell-free DNA-based screening for fetal microdeletion and the importance of careful diagnostic follow-up[J]. Genet Med, 2015,17(10):836-838.
[4]Zhao C, Tynan J, Ehrich M, et al. Detection of fetal subchromosomal abnormalities by sequencing circulating cell-free DNA from maternal plasma[J]. Clin Chem, 2015, 61: 608-616.
[5]Chen S, Lau TK, Zhang C, et al. A method for noninvasive detection of fetal large deletions/duplications by low coverage massively parallel sequencing[J]. Prenat Diagn, 2013, 33: 584-590.
[6]Wapner RJ, Martin CL, Levy B, et al. Chromosomal microarray versus karyotyping for prenatal diagnosis[J]. N Engl J Med, 2012, 367: 2175-2184.
[7]Wapner RJ, Babiarz JE, Levy B, et al. Expanding the scope of noninvasive prenatal testing: detection of fetal microdeletion syndromes[J]. Am J Obstet Gynecol, 2015, 212: 332. e331-339.
[8]Jiang F, Ren J, Chen F, et al. Noninvasive Fetal Trisomy (NIFTY) test: an advanced noninvasive prenatal diagnosis methodology for fetal autosomal and sex chromosomal aneuploidies[J]. BMC Med Genomics, 2012, 5: 57.
[9]Dan S, Wang W, Ren J, et al. Clinical application of massively parallel sequencing-based prenatal noninvasive fetal trisomy test for trisomies 21 and 18 in 11,105 pregnancies with mixed risk factors[J]. Prenat Diagn, 2012, 32: 1225-1232.
[10]Miller DT, Adam MP, Aradhya S, et al. Consensus statement: chromosomal microarray is a first-tier clinical diagnostic test for individuals with developmental disabilities or congenital anomalies[J]. Am J Hum Genet, 2010, 86: 749-764.
[11]Feenstra I, Vissers LE, Orsel M, et al. Genotype-phenotype mapping of chromosome 18q deletions by high-resolution array CGH: an update of the phenotypic map[J]. Am J Med Genet A, 2007, 143A: 1858-1867.
[12]Sousa SB, Hennekam RC, and Nicolaides-Baraitser Syndrome International C. Phenotype and genotype in Nicolaides-Baraitser syndrome[J]. Am J Med Genet C Semin Med Genet, 2014, 166C: 302-314.
[13]Lam KW, Jiang P, Liao GJ, et al. Noninvasive prenatal diagnosis of monogenic diseases by targeted massively parallel sequencing of maternal plasma: application to beta-thalassemia[J]. Clin Chem, 2012, 58: 1467-1475.
[14]Yu SC, Jiang P, Choy KW, et al. Noninvasive prenatal molecular karyotyping from maternal plasma[J]. PLoS One, 2013, 8: e60968.
[15]Srinivasan A, Bianchi DW, Huang H, et al. Noninvasive detection of fetal subchromosome abnormalities via deep sequencing of maternal plasma[J]. Am J Hum Genet, 2013, 92: 167-176.
[16]Rampasek L, Arbabi A, and Brudno M. Probabilistic method for detecting copy number variation in a fetal genome using maternal plasma sequencing[J]. Bioinformatics, 2014. 30: i212-218.
[17]Cheung SW, Patel A, and Leung TY. Accurate description of DNA-based noninvasive prenatal screening[J]. N Engl J Med, 2015, 372: 1675-1677.
[18]Snyder MW, Simmons LE, Kitzman JO, et al. Copy-number variation and false positive prenatal aneuploidy screening results[J]. N Engl J Med, 2015, 372: 1639-1645.
编辑:宋文颖
【Abstract】ObjectiveTo explore a clinical prenatal management for cases with a positive result of microdeletion / duplication (MD) by invasive prenatal test (NIPT). MethodInvasive prenatal diagnosis was arranged for cases with positive MD screening results after detail ultrasound fetal anomaly scan and genetic consultation. Both the fetal and parental samples were sent for karyotyping and multiplex ligation-dependent implication probe amplification (MLPA) / chromosomal microarray analysis (CMA).ResultsA total of 1191 NIPT were performed with 9 cases screened positive for MD. 2 of 3 cases which underwent testify examinations were confirmed to have MD, and two more MD were detected only by CMA in one MD case, whereas the other one was false positive. The maternal sample of the false-positive one was found to have microduplication by sequencing. The two confirmed MD cases terminated the pregnancies whereas the false positive one continued.ConclusionsNIPT can be used as a screening tool to detect MD with a relatively large fragment but its ability to detect small-sized MD is limited and can be affected by maternal background. Therefore invasive prenatal diagnosis is indicated to confirm diagnosis in positive cases.
【Key words】noninvasive prenatal testing; microdeletion / microduplication syndrome; prenatal diagnosis
DOI:10.13470/j.cnki.cjpd.2016.01.006
*通讯作者:苏放明,E-mail:sfmlxq@163.com
【中图分类号】R394.3
【文献标识码】A
(收稿日期:2015-07-14)

