西藏羊八井高温地热田中度嗜热放线菌多样性及生物活性
尹明远,张格杰,何建清*,燕 飞
(1.西藏大学农牧学院,西藏林芝 860000;2.浙江省农业科学院病毒学与生物技术研究所,浙江杭州 310021)
西藏羊八井高温地热田中度嗜热放线菌多样性及生物活性
尹明远1,张格杰1,何建清1*,燕 飞2
(1.西藏大学农牧学院,西藏林芝 860000;2.浙江省农业科学院病毒学与生物技术研究所,浙江杭州 310021)
摘要[目的]探明羊八井地热田放线菌的数量、种类组成、拮抗活性和酶活性。[方法]采用稀释平板法对羊八井地热田底泥和水样放线菌进行分离,通过形态特征、培养特征和 16S rRNA 基因系统发育分析的方法研究样品中度嗜热放线菌的多样性,并对分离到的放线菌进行抑菌、酶活性及温度耐受试验。[结果]从羊八井温泉底泥和水样中分离到21株中度嗜热放线菌,分布于放线菌门放线菌纲3个亚目3个科3个属,即链霉菌属(Streptomyces)、拟诺卡氏菌属(Nocardiopsis)和小单孢菌属(Micromonospora)。21株中度嗜热放线菌中,14.2%的菌株具有纤维素酶活性,52.3%的菌株具有过氧化氢酶活性,28.6%的菌株具有硝酸盐还原活性,33.3%的菌株可产生硫化氢,只有1株菌对大肠杆菌(E.coil)有抑菌活性,21株中度嗜热放线菌最适生长温度为45~55 ℃,超过65 ℃都不能生长。[结论]羊八井地热田放线菌多样性较丰富,产酶特性良好,为开发利用地热环境放线菌资源奠定了基础。
关键词嗜热放线菌;16S rRNA;生物活性;多样性
世界上存在各种各样适合嗜热放线菌栖息的生境,如火山、地热、堆肥、温泉等。国内外陆续报道了温泉里分离的嗜热放线菌可产生一些具有重要价值的热稳定的酶,如脂肪酶、淀粉酶、纤维素酶、DNA聚合酶等,并已广泛应用在工业、农业、医药和生物技术行业[1-4]。目前,在以下属中发现较多的高温放线菌菌株:高温单孢菌属(Thermomonospora)[5-6]、糖单孢菌属(Saccharomonospora)[7]、高温双岐菌属(Thermobifida)[8]、糖多孢菌属(Saccharopolyspora)[8]、链霉菌属(Streptomyces)[9]、假诺卡氏菌属(Pseudonocarcardia)、类诺卡氏菌属(Nocardioides)、马杜拉放线菌属(Actinomadura)、小单孢菌属(Micromonospora)、高温多孢菌属(Thermopolyspora)等。
羊八井地热位于我国西藏自治区拉萨市西北约90 km的当雄县羊八井镇西侧,地理坐标为30°~31° N、90°~91°E,海拔高度在4 290~4 500 m。羊八井分布有规模宏大的喷泉与间歇喷泉、温泉、热泉、沸泉、热水湖等,温度保持在47 ℃左右,是研究嗜热放线菌的理想之地。随着人们对嗜热放线菌关注度的日益增加,许多学者对国内不同高温环境的放线菌的资源进行了研究,但对羊八井地热田放线菌的研究鲜见报道。鉴于此,笔者研究了羊八井地热田嗜热放线菌的资源种类、拮抗活性及其酶的应用潜力,旨在为开发高温环境放线菌资源提供理论依据。
1材料与方法
1.1材料
1.1.1供试样品。从西藏羊八井采集了10份温泉底泥和5份温泉水样(表1),并保存于无菌塑料袋和无菌瓶中。
1.1.2培养基。分离培养基采用高氏一号琼脂培养基、精氨酸甘油琼脂培养基、察氏培养基[10],为抑制细菌和真菌的生长,在培养基中均加入质量浓度为70 mg/L的重铬酸钾。
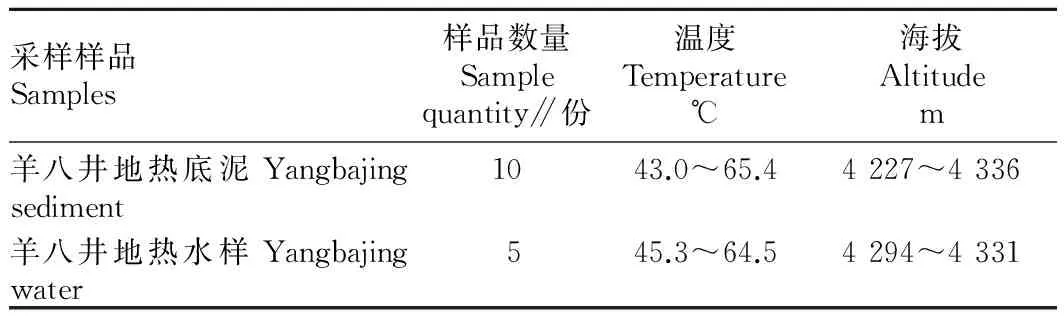
表1 羊八井地热田环境数据
1.1.3主要试剂与仪器。脱脂奶粉、酵母膏、蛋白胨、淀粉等试剂均为国产分析纯;DNA Polymerase、dNTPs、DNA marker DL-2000、pMD18-T vector 购自TaKaRa公司;PCR仪为东胜公司产品;胶回收试剂盒购自Qiagen公司。
1.1.4病原菌。大肠杆菌、金黄色葡萄球菌(Staphylococcusaureus)、小麦赤霉菌(Fusariumgraminearum)、番茄灰霉菌(Botrytiscinerea)、南瓜枯萎菌(Fusariumoxysporum)、粉红聚端孢(Trichotheciumroseum)、小麦根腐菌(Bipolarissorokiniana)菌株由西藏大学农牧学院真菌实验室保存并提供。
1.2方法
1.2.1样品预处理与菌株分离。用无菌袋盛取地热田底泥样品,置于室内风干,充分研磨,过筛,称量10 g,转移至盛有90.0 mL无菌水的三角瓶中,置于45 ℃恒温振荡箱中120 r/min振荡,使蕴藏在样品中的微生物充分释放,用移液枪分别取1.0 mL样品至盛有9.0 mL无菌水的试管中,稀释至1×10-2,取0.2 mL涂布于分离培养基上,于45 ℃恒温培养箱中倒置培养7~14 d。
取一定体积的水样通过0.22 μm无菌滤膜富集,取下滤膜放在平板上,用1.0 mL无菌水将滤膜上的沉积洗掉,采用倾注平板法将适当温度的培养基倒入相应平板,摇匀冷却后于45 ℃恒温培养箱中倒置培养7~21 d。根据菌落形态、大小、颜色初步分离筛选,利用高氏培养基纯化并保藏。
1.2.2嗜热放线菌鉴定。经纯化后的嗜热放线菌,采用插片法适时取片,用番红染色在光学显微镜下观察和初步鉴定[11]。同时按照参考文献[12]的方法提取总DNA,用细菌16S rRNA通用引物PA5’-CAGAGTTTGATCCTGGCT-3’和PB 5’-AGGAGGTGATCCAGCCGCA-3’进行PCR扩增,PCR产物直接送浙江杭州擎科梓熙生物技术有限公司测序,经ClustalX软件[13]进行序列比对,利用MEGA4软件[14]中的Neighbour-Joining法[15]构建系统进化树,设置的重复抽样次数为1 000次。
1.2.3酶活测定。淀粉酶水解、硝酸盐还原、纤维素分解、明胶利用、氧化酶、硫化氢、过氧化氢酶活性筛选均参照文献[16]的方法进行。
1.2.4拮抗活性测定。采用生长速率法测定供试嗜热放线菌发酵液的皿内抑菌作用,选用的细菌为大肠杆菌和金黄色葡萄球菌,植物病原真菌为小麦赤霉菌、番茄灰霉菌、南瓜枯萎菌、粉红聚端孢和小麦根腐菌。
1.2.5生长温度测定。以高氏培养基为基础培养基检测不同试验菌株在30~75 ℃下的生长情况。
2结果与分析
2.1羊八井地热田底泥放线菌数量分布 3种培养基对不同样品中的放线菌出菌率明显不同。由表2可知,精氨酸甘油琼脂培养基分离的放线菌数量最大,菌落形态较丰富,高氏一号琼脂培养基和蔗糖察氏培养基分离的放线菌数量相对较少,种类单一。因此,精氨酸甘油琼脂培养基的分离效果最好,分离的放线菌种类及数量均最多。
2.2中度嗜热放线菌的多样性从羊八井地热田采集10份底泥和5份水样,采用稀释平板法分离出21株嗜热放线菌,其中底泥19株,水样2株,测定其16S rRNA序列。由图1可知,分离菌株分布于放线菌纲3个亚目3个科3个属,即链霉菌属、拟诺卡氏菌属和小单孢菌属。其中,链霉菌属为羊八井地热田底泥中的优势放线菌,占分离菌株数的89.50%,其次是拟诺卡氏菌属,占分离菌株数的10.50%;水样中全部为小单孢菌属。
表2样区土壤嗜热放线菌数量
Table 2The quantity of thermophilic actinomycetes in sample plot soil×103个/g
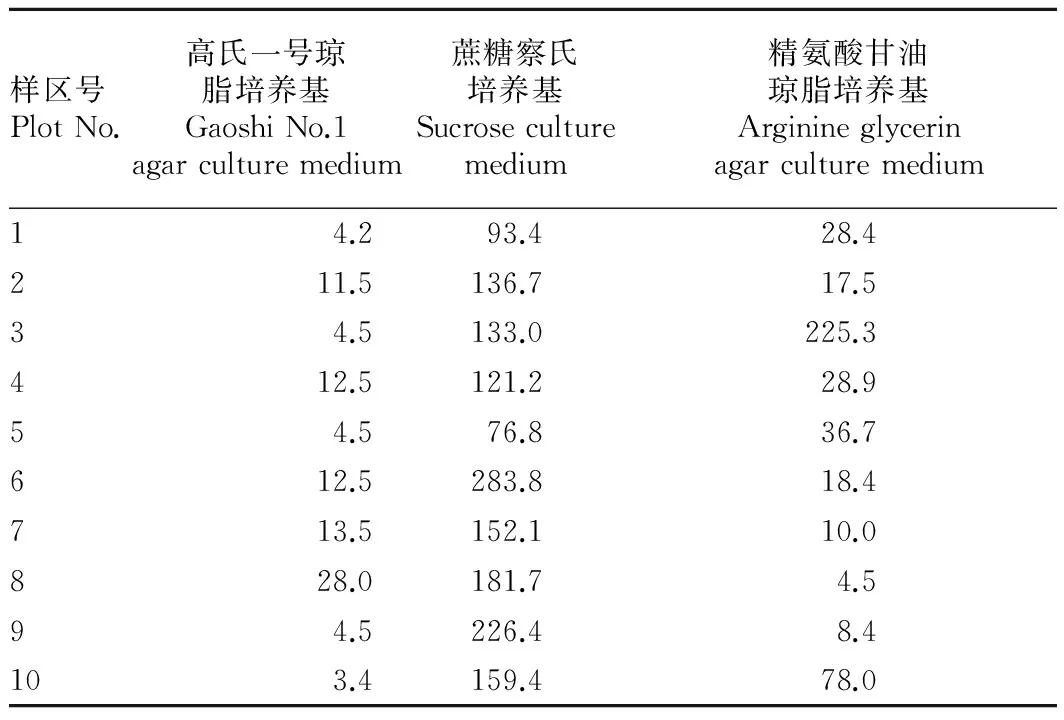
样区号PlotNo.高氏一号琼脂培养基GaoshiNo.1agarculturemedium蔗糖察氏培养基Sucroseculturemedium精氨酸甘油琼脂培养基Arginineglycerinagarculturemedium14.293.428.4211.5136.717.534.5133.0225.3412.5121.228.954.576.836.7612.5283.818.4713.5152.110.0828.0181.74.594.5226.48.4103.4159.478.0
注:高氏一号琼脂培养基含链霉菌属(4);蔗糖察氏培养基含链霉菌属(3)、小单孢菌属(1);精氨酸甘油琼脂培养基含链霉菌属(10)、小单孢菌属(1)、拟诺卡氏菌属(2)。
Note:Gaoshi No.1 arar culture medium containsStreptomyces;Sucrose culture medium containsStreptomyces,Micromonospora;Arginine glycerin agar culture medium containsStreptomyces,Micromonospora,Nocardiopsis.
2.3酶活及拮抗活性测定结果由表3可知,21株嗜热放线菌中,14.2%的菌株具有纤维素酶活性,52.3%的菌株具有过氧化氢酶活性,28.6%的菌株可把硝酸盐还原,33.3%的菌株可产生硫化氢,其中菌株R5、R10、R20具有高活性的纤维素酶活性,说明羊八井地热田放线菌具有较强的酶活性。拮抗测定结果显示,只有1株菌对大肠杆菌有拮抗活性,说明羊八井地热田放线菌产拮抗活性能力较弱。
2.4分离菌株的生长温度21株嗜热放线菌在30~60 ℃下都可生长,65~75 ℃下均不能生长,45~55 ℃下生长状况最好,因此,最适生长温度范围为45~55 ℃。
3结论与讨论
该研究从羊八井地热田中分离得到21株放线菌,分布于放线菌纲3亚目3科3属,即链霉菌属、拟诺卡氏菌属和小单孢菌属,表明羊八井地热田放线菌数量少,种类较单一,这可能与分离培养基的种类及样品的分析量较少有关,或者羊八井地热田的微生物以细菌为主[17]。该研究进一步发现羊八井地热田放线菌中以链霉菌为优势菌种,这与Thawai[18]对泰国温泉放线菌的多样性研究结果一致,Thawai在泰国某温泉分离到链霉菌属和小单孢菌属,与Song等[19]对中国云南腾冲、俄罗斯堪察加半岛和美国内华达温泉放线菌多样性研究结果不一致,分析原因是由很多因素造成,如温度、光照、氧气、pH、水的理化性质、地理位置等生态因子[20]。主要原因可能是由于羊八井温泉与其他温泉温度具有一定差异,而温度是影响放线菌多样性的重要因素[19,21-22]。该研究分离的21个菌株具有纤维素酶、过氧化氢酶、硝酸盐还原、硫化氢产生的比率分别为14.2%、52.3%、28.6%、33.3%,其中菌株R5、R10、R20具有较高的纤维素酶活性,后续工作将对这3株菌产生的纤维素分解酶进一步研究和利用,个别菌株可产生2种酶。综上所述,西藏羊八井高温地热田是获得酶的潜在资源。分离的21株菌中只有1株菌对大肠杆菌有抑菌活性,对其他5种植物病原真菌和金黄色葡萄球菌无抑菌活性,这可能与供试菌株数量较小有关,曹艳茹等[23]发现具有合成抗生素相关基因的菌株只有在适当的发酵条件下才会表现出相应的抗性,而该研究中21株供试菌的发酵条件可能由于不适合从而导致拮抗活性较低。

图1 基于16S rRNA 序列的西藏羊八井地热田放线菌系统发育树Fig.1 Phylogenetic tree of tested strains based on 16S rRNA sequence
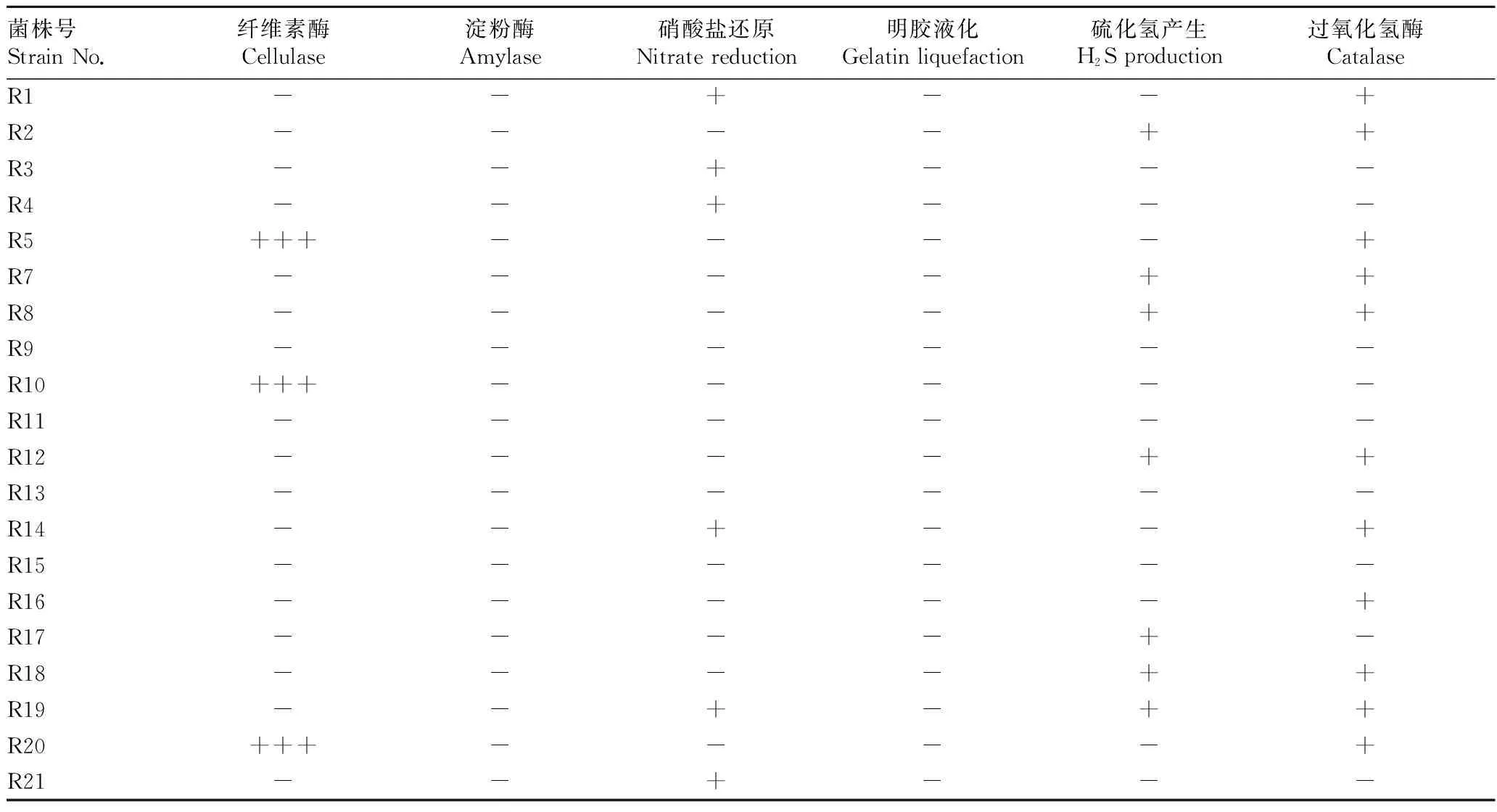
菌株号StrainNo.纤维素酶Cellulase淀粉酶Amylase硝酸盐还原Nitratereduction明胶液化Gelatinliquefaction硫化氢产生H2Sproduction过氧化氢酶CatalaseR1--+--+R2----++R3--+---R4--+---R5+++----+R7----++R8----++R9------R10+++-----R11------R12----++R13------R14--+--+R15------R16-----+R17----+-R18----++R19--+-++R20+++----+R21--+---
注:“-” 表示无酶活性;“+”表示有活性;“+++”为滤纸条降解≥2/3。
Note:“-”.negative.“+”.positive.“+++” Degradation of the filter paper≥2/3.
参考文献
[1] LAZZARINI A,CAVALETTI L,TOPPO G,et al.Rare genera of actinomycetes as potential producers of new antibiotics[J].Antonie van Leeuwenhoek,2000,78(3/4):399-405.
[2] BULL A T,STACH J E,WARD A C,et al.Marine Actinobacteria:Perspectives,challenges,future directions[J].Anton Van Leeuw,2005,87(1):65-79.
[3] CHEN W M,CHANG J S,CHIU C H,et al.Caldimonastaiwanensissp.nov.,a amylase producing bacterium isolated from a hot spring[J].Systematic and applied microbiology,2005,28(5):415-420.
[4] TANG K,UTAIRUNGSEE T,KANOKRATANA P,et al.Characterization of a novel cyclomaltodextrinase expressed from environmental DNA isolated from Bor Khleung hot spring in Thailand[J].FEMS microbiology letters,2006,260(1):91-99.
[5] ZHANG Z,WANG Y,RUAN J.Reclassification ofThermomonosporaandMicrotetraspora[J].International journal of systematic bacteriology,1998,48(2):411-422.
[6] YAP W H,ZHANG Z,WANG Y.Distinct types of rRNA operons exist in the genome of the actinomyceteThermomonosporachromogenaand evidence for horizontal transfer of an entire rRNA operon[J].Journal of bacteriology,1999,181(17):5201-5209.
[7] KIM S B,YOON J H,KIM H,et al.A phylogenetic analysis of the genusSaccharomonosporaconducted with 16S rRNA gene sequences[J].International journal of systematic bacteriology,1995,45(2):351-356.
[8] EMBLEY T M,SMIDA J,STACKEBRANDT E.Reverse transcriptase sequencing of 16S ribosomal RNA fromFaeniarectivirgula,PseudonocardiathermophilaandSaccharopolysporahirsuta,three wall type IV actinomycetes which lack mycolic acids[J].Journal of general microbiology,1988,134(4):961-966.
[9] KIM B,SAHIN N,MINNIKIN D E,et al.Classification of thermophilic streptomycetes,including the description ofStreptomycesthermoalcalitoleranssp.nov[J].International journal of systematic bacteriology,1999,49(1):7-17.
[10] 阮继生.放线菌分类基础[M].北京:科学出版社,1977:1-145.
[11] 阮继生,黄英.放线菌快速鉴定与系统分类[M].北京:科学出版社,2010:208-300.
[12] 徐平,李文均,徐丽华,等.微波法快速提取放线菌基因组 DNA[J].微生物学通报,2003,30(4):82-84.
[13] THOMPSON J D,GIBSON T J,PLEWNIAK F,et al.The CLUSTAL-X windows interface:Flexible strategies for multiple sequence alignment aided by quality analysis tools[J].Nucleic acids research,1997,25(24):4876-4882.
[14] TAMURA K,DUDLEY J,NEI M,et al.MEGA4:molecular evolutionary genetics analysis(MEGA)software version 4.0[J].Molecular biology and evolution,2007,24(8):1596-1599.
[15] SAITOU N,NEI M.The neighbor-joining method:A new method for reconstructing phylogenetictrees[J].Molecular biology and evolution,1987,4(4):406-425.
[16] 徐丽华,李文均,刘志恒,等.放线菌系统学原理、方法及实践[M].北京:科学出版社,2007:42-43.
[17] 陈彬,马超,周世宁,等.西藏羊八井废弃地热热井的细菌多样性[J].微生物学报,2009,49(2):217-226.
[18] THAWAI C.Isolation and characterization of antibiotic-producing actinomycetes from hot spring sediment of Thailand[C]//International Conference on BioScience:Biotechnology and Biodiversity-Step in the Future.The Fourth Joint UNS-PSU Conference,Novi Sad,Serbia,18-20 June 2012.Institut za Ratarstvo i Povrtarstvo & Semenarska Asocijacija Srbije,2012:215-219.
[19] SONG Z,ZHI X,LI W,et al.Actinobacterial diversity in hot springs in Tengchong(China),Kamchatka(Russia),and Nevada(USA)[J].Geomicrobiology journal,2009,26(4):256-263.
[20] 于新娟,王莉莉,贾盛佼,等.温泉微生物多样性与酶类分析[J].微生物学通报,2014(1):130-135.
[21] VALVERDE A,TUFFIN M,COWAN D A.Biogeography of bacterial communities in hot springs:A focus on the actinobacteria[J].Extremophiles,2012,16(4):669-679.
[22] WANG S,HOU W,DONG H,et al.Control of temperature on microbial community structure in hot springs of the Tibetan Plateau[J].PloS one,2013,8(5):62901.
[23] 曹艳茹,姜怡,陈义光,等.武陵山放线菌多样性[J].微生物学报,2008,48(7):952-958.
Biological Activity and Diversity of Moderately Thermophilic Actinomyccetes from Geothermal Field in the Yangbajing of Tibet
YIN Ming-yuan, ZHANG Ge-jie, HE Jian-qing*et al
(College of Agriculture and Animal Husbandry, Tibet University, Linzhi, Tibet 860000)
Abstract[Objective] The aim was to explore the quantity, composition, antagonistic activity and enzyme activity of actinomyccetes from geothermal field in Yangbajing. [Method] Thermophilic actinomycetes were isolated via plate dilution from the sediment and water of Yangbajing geothermal field in Tibet Province. Based on the morphology, cultural characteristics and 16S rRNA sequence, diversity of thermophilic actinomycetes were studied, antibacterial activity, enzyme activity and temperature tolerance tests were conducted on isolates. [Result] The results showed that 21 isolates were identified and found to distribute into 3 genus: Streptomyce, Micromonospora and Nocardiopsis. Among those,14.2% produced cellulase, 52.3% produced catalase, 33.3% produced H2S and 28.6% could reduce nitrate, and 1 strain had antibacterial activity against Escherichia coil. The optimal growth temperature range for strains was 45-55 ℃ and temperature over 65 ℃ totally blocked the growth. [Conclusion] The discovery of diverse thermophilic actinobacteria from Yangbajing geothermal field indicates a potential source for enzymes.This study lays a foundation for the exploration and utilization of thermophilic actinobacteria resource.
Key wordsThermophilic actinomycetes; 16S rRNA; Biological activity; Diversity
基金项目国家自然科学基金项目(31260005)。
作者简介尹明远(1991- ),男,内蒙古赤峰人,硕士研究生,研究方向:极端环境放线菌。*通讯作者,教授,硕士,硕士生导师,从事放线菌和生物防治研究。
收稿日期2016-02-24
中图分类号Q 938
文献标识码A
文章编号0517-6611(2016)12-001-04

