小鼠Klf4基因的原核表达研究
孟书燕,郭 杰,高庚渠,刘改霞,马 威
(河南质量工程职业学院,河南平顶山 467000)
小鼠Klf4基因的原核表达研究
孟书燕,郭 杰,高庚渠,刘改霞,马 威*
(河南质量工程职业学院,河南平顶山 467000)
摘要[目的]对小鼠Klf4基因重组蛋白进行原核表达分析。[方法]利用双酶切从重组质粒pMXs-Klf4上回收小鼠Klf4基因片段,克隆入pET-41a(+)载体后转化BL21大肠杆菌,用IPTG诱导表达,探讨诱导表达最佳浓度和时间,最后采用SDS-PAGE对重组蛋白进行鉴定及分析。[结果]重组质粒Klf4-pET-41a(+)在IPTG诱导下可表达与预期相符的约为51 ku的KLF4蛋白;经IPTG刺激后重组蛋白表达增多,以0.8 mmol/L IPTG诱导6 h为佳;重组蛋白以包涵体形式存在于大肠杆菌BL21中。[结论]小鼠Klf4基因可在原核细胞中表达。
关键词小鼠;Klf4基因;原核表达;大肠杆菌
Krüppel样因子4(Krüppel-likefactor4,Klf4)为1996年发现的锌指转录因子家族成员之一,其在细胞增殖、分化、胚胎发育等生命过程中发挥重要作用[1]。研究表明,采用体外导入Klf4、Oct4/POU5F1、Sox2和c-Myc 4个转录因子可将小鼠体细胞直接重构为胚胎干细胞(ES,embryonicstemcells)样的诱导性多能干细胞[2],因此Klf4作为分化体细胞重编程的重要诱导因子之一,一直是该领域的研究热点[3]。但目前关于Klf4基因原核表达的研究较少。笔者以小鼠Klf4基因为目的基因,构建原核表达载体,对其原核表达进行分析,为今后Klf4融合蛋白多克隆抗体制备及其基因表达调控机理的功能研究奠定基础。
1材料与方法
1.1主要试剂、载体及菌株大肠杆菌工程菌DH5α、BL21(DE3)、pMXs重组质粒和原核表达载体pET-41a(+)均为西北农林科技大学干细胞研究中心保存;DNA纯化回收试剂盒(Tiangen),蛋白Marker、SalⅠ、NcoⅠ、PstⅠ和HindⅢ、T4DNA连接酶、DNAMarker、Amp、Kan(TaKaRa),其他试剂均为国产分析纯。
1.2小鼠Klf4基因原核表达载体的构建与鉴定用SalⅠ和NcoⅠ分别对含有小鼠Klf4基因片段的pMXS-Klf4重组质粒和pET-41a(+)进行37 ℃双酶切,前者回收Klf4基因片段,后者回收大片段,并将两者在16 ℃连接过夜。将连接产物转化DH5α感受态细胞,先经SalⅠ和NcoⅠ双酶切鉴定,再经PstⅠ和HindⅢ双酶切鉴定正确后,获得重组原核表达载体Klf4-pET-41a(+)。
1.3重组质粒Klf4-pET-41a(+)的诱导表达将阳性重组质粒接种于含Kan的LB液体培养基中,37 ℃培养过夜,将菌液按1%剂量接种于50mL相同LB培养基中,200r/min振荡培养至OD为0.6左右,加入终浓度为1mmol/L的IPTG诱导表达,在诱导不同时间(4、6h)分别取样1.5mL。同时以诱导的pET-41a(+)载体作为阴性对照。
1.4小鼠Klf4基因表达产物的SDS-PAGE分析将1.5mL诱导菌液4 ℃离心收集菌体,室温12 000r/min离心1min,弃上清,加入100μL1×SDS凝胶加样缓冲液重悬,100 ℃煮沸10min后冰浴10min,室温12 000r/min离心1min,取上清进行12%SDS-PAGE电泳,考马斯亮蓝R250染色观察。
1.5重组质粒Klf4-pET-41a(+)诱导表达条件的优化①将含Klf4-pET-41a(+)的BL21以1%剂量接种于含Kan的LB培养液中,37 ℃培养3~4h,分别加入IPTG至终浓度0、0.2、0.4、0.6、0.8、1.0mmol/L进行诱导,SDS-PAGE电泳分析结果。②将含Klf4-pET-41a(+)的BL21以1%剂量接种于含Kan的LB培养液中,37 ℃培养3~4h,在添加0.8mmol/LIPTG后继续诱导0、4、5、6、7h分别取样处理,SDS-PAGE电泳分析。
1.6融合蛋白表达形式的鉴定收集100mL菌液,12 000r/min离心5min,弃去培养液,PBS洗涤2次,12 000r/min离心5min后弃去上清。5mLPBS悬浮沉淀,冰浴条件下对菌体进行超声波破碎(工作条件为:400W,5s,5s,30min),待菌体悬浮液由黏稠变透亮时即可。12 000r/min离心40min,取上清100μL,加入1×SDS上样缓冲液混合完全,后加入PBS重悬沉淀,再加入1×SDS上样缓冲液混合制样,分别取上清和沉淀进行SDS-PAGE分析。
2结果与分析
2.1pMXs-Klf4重组质粒的酶切鉴定重组质粒pMXs-Klf4经双酶切后获得一条约为1 925bp的基因片段,根据载体的酶切位点分析,并与NCBI上公布的小鼠Klf4基因长度相比,可以确定该特异性条带即为Klf4片段(图1)。

注:M.DL2 000 DNA Marker;1.酶切结果(SalI和NcoI)。Note:M.DL2 000 DNA Marker;1.Product of plasmid digested by SalI and NcoI.图1 pMXs-Klf4的双酶切结果Fig.1 Identification of plasmid pMXs-Klf4 by double restriction endonuclease digestion
2.2Klf4-pET-41a(+)重组质粒的酶切鉴定提取阳性重组表达质粒Klf4-pET-41a(+)进行酶切鉴定。经琼脂糖凝胶电泳检测,结果显示经SalⅠ和NcoⅠ双酶切获得一条约1 925bp条带,与预期片段大小相符;经PstⅠ和HindⅢ双酶切获得一条约1 460bp条带,与预期片段大小相符。
2.3Klf4-pET-41a(+)重组质粒的诱导表达鉴定将含有Klf4-pET-41a(+)的BL21 37 ℃培养后,加入1mmol/LIPTG诱导表达,于不同时间取样进行SDS-PAGE电泳,结果在约77ku处有明显的蛋白条带,与预期融合蛋白大小一致,而未诱导的重组菌对照组未见该条带(图2)。
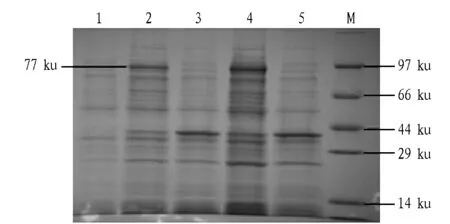
注:1.未诱导的Klf4-pET-41a(+);2.加入IPTG诱导4 h后的Klf4-pET-41a(+);3.pET-41a(+)空载体诱导4 h;4.加入IPTG诱导6 h后的Klf4-pET-41a(+);5.pET-41a(+)空载体诱导6 h;M.蛋白Marker。Note:1.Non-induced Klf4-pET-41a(+);2.Klf4-pET-41a(+)after IPTG induction for 4 h;3.pET-41a(+)empty carrier induction for 4 h;4.Klf4-pET-41a(+)after IPTG induction for 6 h;5.pET-41a(+)empty carrier induction for 6 h;M.Protein Marker.图2 表达产物的SDS-PAGEFig.2 SDS-PAGE analysis of expressed protein
2.4Klf4-pET-41a(+)重组质粒诱导表达条件的优化在诱导时间相同的条件下,通过改变诱导物IPTG浓度来观察IPTG浓度对KLF4蛋白表达的影响。在IPTG浓度为0.8mmol/L时KLF4蛋白的表达量最多,因此,最适IPTG浓度为0.8mmol/L(图3)。当加入终浓度为0.8mmol/L的IPTG后,观察不同时间对KLF4蛋白表达的影响,结果表明诱导6h后KLF4蛋白的表达量较多,因此,最适诱导时间为6h(图4)。

注:M.蛋白Marker,1~7分别为IPTG浓度为1.0、0.8、0.6、0.6、0.4、0.2、0 mmol/L。Note:M.Protein Marker;1-7.IPTG concentration 1.0,0.9,0.6,0.6,0.4,0.2,0 mmol/L,respectively.图3 不同IPTG浓度对KLF4蛋白表达的影响Fig.3 Effects of different concentration of IPTG on the expression of KLF4 protein

注:M.蛋白Marker,1.诱导3 h,2.诱导4 h,3.诱导5 h,4.诱导6 h。Note:M.Protein Marker;1.Induction for 3 h;2.Induction for 4 h;3.Induction for 5 h;4.Induction for 6 h.图4 不同时间对KLF4蛋白表达的影响Fig.4 Effects of different time on the expression of Klf4 protein
2.5目的蛋白表达形式的鉴定含重组质粒Klf4-pET-41a(+)的菌体诱导后超声破碎,离心获得上清和沉淀,SDS-PAGE电泳结果显示,上清中几乎无目的蛋白存在,而在沉淀中含有大量目的蛋白,说明诱导表达的KLF4蛋白是以包涵体的形式存在于细菌胞液中(图5)。
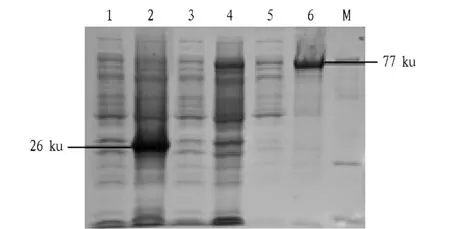
注:1.未诱导含pET-41a(+)的BL21蛋白,2.诱导6 h含pET-41a的BL21蛋白,3.未诱导的含Klf4-pET-41a+的BL21蛋白,4.0.8 mmol/L IPTG诱导6 h的含Klf4- pET-41a+的BL21蛋白,5.破碎含重组载体的细胞后的上清,6.破碎含重组载体的细胞后的沉淀,M.蛋白Marker。Note:1.The protein in BL21 with non-induced pET-41a(+);2.The protein in BL21 with IPTG induced pET-41a(+);3.The protein in BL21 with non-induced Klf4 -pET-41a(+);4.The protein in BL21 with 0.8 mmol/L IPTG induced Klf4 -pET-41a(+)for 6h;5.The supernatant of induced BL21 with Klf4-pET-41a(+);6.The precipitation of induced BL21 with Klf4 -pET-41a(+);M.Protein Marker.图5 目的蛋白表达形式的鉴定Fig.5 The identification of the expressed KLF4 protein
3讨论
KLF4蛋白结构的高度保守性决定了Klf4是一个双向调节的转录因子,其参与维持干细胞的全能性、调控细胞增殖、促进正常组织的生长,并与肿瘤的形成与发展有关[4-6]。研究表明,Oct4/POU5F1、Sox2、Klf4和c-Myc可将小鼠成纤维细胞诱导为多能性干细胞(inducedpluripotentstemcells,iPSC),说明这4因子在细胞重编程中发挥重要作用[2]。关于Klf4的研究主要集中于对4因子共同调控作用的分析,而对于单转录因子的作用研究较少[7]。该研究利用酶切技术构建Klf4 -PET-41a(+)重组质粒,经IPTG诱导表达与预期相符的约为51ku的KLF4蛋白,且经IPTG刺激后重组融合蛋白表达明显上调,其中以IPTG为0.8mmol/L诱导6h效果最佳。
稀有密码子的存在影响目的基因在大肠杆菌中的高效表达[8],在大肠杆菌的8个稀有密码子中,小鼠Klf4基因中有AGA、AGC、CCG、CCC4种,且均位于近氨基端,这是小鼠KLF4蛋白诱导表达时存在潜在低量表达的原因之一。解决该问题最好用点突变的方法将稀有密码子进行改造,以提高表达效率[9]。
体外诱导表达小鼠KLF4蛋白,有助于研究KLF4蛋白对细胞重编程的作用,以及与其他多能性相关因子的相互作用,为进一步研究该基因的体外功能提供理论依据。
参考文献
[1]CHRISTYRJ.IdentificationandcharacterizationofageneencodingaGut-enrichedKruppel-likefactorexpressedduringgrowtharrest[J].BiolChem,1996,271(33):20009-20017.
[2]TAKAHASHIK,YAMANAKAS.Inductionofpluripotentstemcellsfrommouseembryonicandadultfibroblastculturesbydefinedfactors[J].Cell,2006,25(126):663-676.
[3] 赵乔佳杰,黄秉仁,陈虹,等.KLF4的结构、功能及其与癌症的关系[J].医学研究杂志,2014,43(4):11-14.
[4]CAOQ,ZHANGX,LUL,etal.Klf4isrequiredforgerm-layerdifferentiationandbodyaxispatterningduringXenopusembryogenesis[J].Development,2012,139(21):3950-3961.
[5]MECONNELLBB,GHALEBAM,NANDANMO,etal.ThediversefunctionsofKruppel-likefactors4and5inepithelialbiologyandpathobiology[J].Bioessays,2007,29(6):549-557.
[6]CHENX,JOHNSDC,GEIMANDE,etal.Kruppel-likefactor4(gut-enrichedKruppel-ikefactor)inhibitscellproliferationbyblockingG1/Sprogressionofthecellcycle[J].JBiolChem,2001,276(32):30423-30428.
[7] 王春生,罗芳,杜文敬,等.小鼠Klf4基因的克隆及原核表达分析[J].中国实验动物学报,2009,17(2):103-107.
[8] 张锐,孙美蓉,杜文敬,等.真核基因在pET系统中表达出现的问题与拟解决的方案[J].生物技术,2004,14(2):62-63.
[9]HANMJ,LEESY.TheEscherichia coliproteome:Past,present,andfutureprospects[J].Microbiologyandmolecularbiologyreviews,2006,70(2):362-439.
TheResearchofProkaryoticExpressionofKrüppel-likeFactor4inMouse
MENGShu-yan,GUOJie,GAOGeng-qu,MAWei*etal
(HenanQualityPolytechnic,Pingdingshan,Henan467000)
Abstract[Objective] Prokaryotic expression analysis of recombinant protein of Klf4 gene in mice was conducted. [Method] Klf4 gene segments were recovered from recombinant plasmid pMXs-Klf4 by double enzyme digestion, then they were cloned into pET-41a (+) vector and transformed into E.coli BL21. The expression was induced by IPTG, the optimal concentration and time was explored, finally, SDS-PAGE was adopted to identify and analyze recombinant plasmid. [Result] Induced by IPTG, recombinant plasmid Klf4-pET-41a(+) can be expressed in accordance with the expected protein about 51 ku; after IPTG stimulation, the expression of recombinant protein was increased, and 0.8 mmol/L IPTG induction for 6 h was optimal; the recombinant protein was expressed in the form of inclusion bodies in E. coli BL21.[Conclusion] The mouse Klf4 gene can express in prokaryotic cells.
Key wordsMouse; Klf4 gene; Prokaryotic expression; E. coli
作者简介孟书燕(1986- ),女,河南漯河人,助教,硕士,从事食品微生物研究。*通讯作者,副教授,从事食品化工研究。
收稿日期2016-04-06
中图分类号Q 78
文献标识码A
文章编号0517-6611(2016)12-133-03

