抗心律失常药物对2-APB诱发大鼠心房异位活动的影响
解 岩,张婷婷
(哈尔滨医科大学大庆校区生理学教研室,黑龙江 大庆 163319)
抗心律失常药物对2-APB诱发大鼠心房异位活动的影响
解岩,张婷婷
(哈尔滨医科大学大庆校区生理学教研室,黑龙江 大庆163319)
摘要:目的研究抗心律失常药物对2-APB诱发的大鼠心房异位活动的抑制作用。方法通过连接多通道分析和获取数据的等长张力传感器测量2-APB诱发的异位活动。结果2-APB剂量依赖性增加左心房的异位活动,浓度分别为 1、5、10、20、50 μmol·L-1。抗心律失常药物,奎尼丁(10 μmol·L-1),利多卡因(10 μmol·L-1),维拉帕米(5 μmol·L-1)抑制2-APB诱发的异位活动。2-APB诱发的异位活动能被无钙液和Na+/Ca2+交换抑制剂所阻断,如3′,4′-dichlorobenzamil hydrochloride (DHC)和Ni2+,而不能被非选择性阳离子通道阻断剂 Gd3+所阻断。结论2-APB诱发的心房异位活动能被经典抗心律失常药物所抑制,如奎尼丁,利多卡因,维拉帕米和钠钙交换抑制剂。2-APB可用于筛选那些能够非选择性抑制钠通道,钙通道和钠钙交换体的抗心律失常药物。
关键词:钠钙交换体抑制剂DHC;抗心律失常药;利多卡因;奎尼丁;维拉帕米;大鼠,Wistar;2-APB
心血管疾病有着很高的致死率,其中心律失常占心血管疾病发病率的25%[1-2]。心肌细胞离子通道的结构和功能的改变所引起的离子流变化是心律失常发生机制中研究的焦点[3]。心肌细胞膜上存在多种离子通道,如钠通道、钾通道、钙通道等。这些通道表达和功能的彼此平衡是正常电生理的基础,一旦这种平衡被打破,就会出现心律失常[4-5]。
心律失常严重危害人类健康,筛选新的抗心律失常药物具有重要的意义。目前筛选抗心律失常候选药物的方法包括:膜片钳、电刺激模型、神经刺激模型、缺血性心律失常模型和利用一些化学药物诱发的心律失常模型如洋地黄、乌头碱等[6]。采用不同的方法和模型联合评价抗心律失常候选药的作用是目前研究的关注点。
2-APB(2-AminoethoxydiphenylBorate)是一种细胞膜通透性分子,能作用于多种细胞,产生广泛的作用。2-APB通常用于抑制IP3受体诱发的钙释放和抑制钙库操纵性钙通道。然而最近有报道证明2-APB在某些情况下,能加强钙离子的信号转导。Wolkowicz等证实了2-APB能够诱发离体大鼠左心房的异位活动,If电流,氯通道,钠钙交换体等可能加强了2-APB的作用[7-8]。本实验的目的在于阐明2-APB诱发心律失常的机制,验证候选的抗心律失常药物对2-APB的作用,为筛选抗心律失常药物提供新的方法。
1材料和方法
1.1材料Wistar大鼠,雄性,哈尔滨医科大学实验动物中心提供,合格证号医动字:0-9-2-1。2-APB、DHC、硫酸镍、氯化钆和奎尼丁购自Sigma-Aldrich,利多卡因、维拉帕米购自哈尔滨医科大学药学部,其余试剂均为分析纯。
1.2实验方法
1.2.1实验准备首先将Krebs-Henseleit(KH)液置于HW-400恒温平滑肌槽中加热,设定温度为37℃,打开超级恒温器,设定温度37℃,预热20~30 min。再将小浴槽用KH液冲洗3遍以上确保清洁,确保无药品残留。并用37 ℃的KH液13 mL注入小浴槽中,用95%O2+5%CO2混合气体进行氧饱和。用双蒸水(ddH2O)清洗实验中使用的器械。
1.2.2分离大鼠心房Wistar大鼠(200~240 g)用戊巴比妥钠(40 mg·kg-1)麻醉,从剑突处打开胸腔,暴露心脏,用手轻轻抓住心脏,迅速剪开主动脉,将心脏放在装有37℃的KH液的平皿中 ,用小剪刀和弯镊轻轻剪取心房,要注意保持心房的完整性,否则会影响心房的功能。
1.2.3悬挂心房用两个膜片夹将心房两端夹起固定在小浴槽中,分别挂在小浴槽下端的弯钩和等长张力传感器上,调节高度,使张力适中。整个实验过程中,小浴槽中的液体用95%O2+5%CO2混合气体进行氧饱和。
1.2.4输入信号将BL-420生物机能试验系统打开,选择心房所对应的通道,输入张力信号,调节指标为G=2000,T=0.1,F=30,开始记录实验数据。
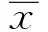
2结果
2.1大鼠左心房和右心房的自发性机械活动大鼠的右心房在实验条件下,能够产生自发的机械活动,频率为每分钟(253±32)次(n=6),左心房并不产生自发的机械活动(n=6),如图1。因此,为了排除右心房自发性机械活动对实验中2-APB诱发的心房异位活动的影响,在实验中我们使用的是大鼠左心房。
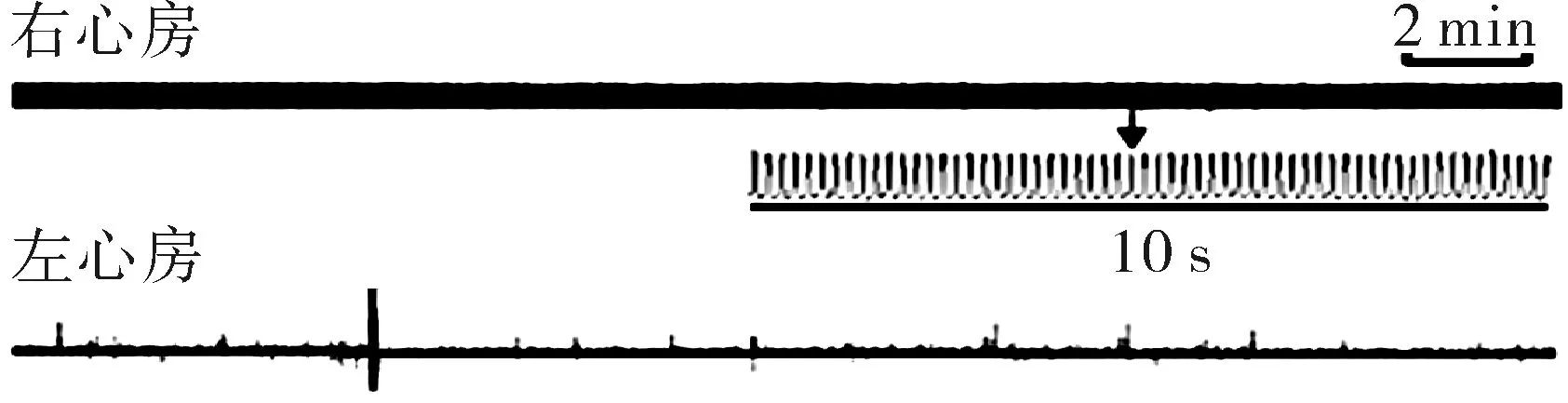
图1 大鼠左右心房的自发性机械活动(n=6)
2.2不同剂量的2-APB对大鼠左心房异位活动的作用本实验记录了1、5、10、20、50 μmol·L-1的2-APB对大鼠左心房异位活动的作用。1、5 μmol·L-1的2-APB对大鼠左心房的作用比较微弱。20 μmol·L-1的2-APB能够明显诱发大鼠左心房的异位活动,50 μmol·L-1的2-APB能够诱发大鼠左心房急剧快速的收缩活动,频率为每分钟(219±9)次(n=8),比20 μmol·L-1的2-APB的作用强烈。但是20 μmol·L-1的2-APB能够诱发大鼠左心房稳定的异位活动,而50 μmol·L-1的2-APB诱发的大鼠左心房的机械活动在观察时间内已经逐渐耗竭。结果提示:20 μmol·L-1为最适浓度。在以下的实验中2-APB的使用浓度为20 μmol·L-1。见图2。
注:ABC为不同剂量的2-APB诱发的大鼠左心房异位活动的代表图;D为2-APB诱发的大鼠左心房异位活动的统计数据。
图22-APB剂量依赖性增加大鼠左心房的异位活动
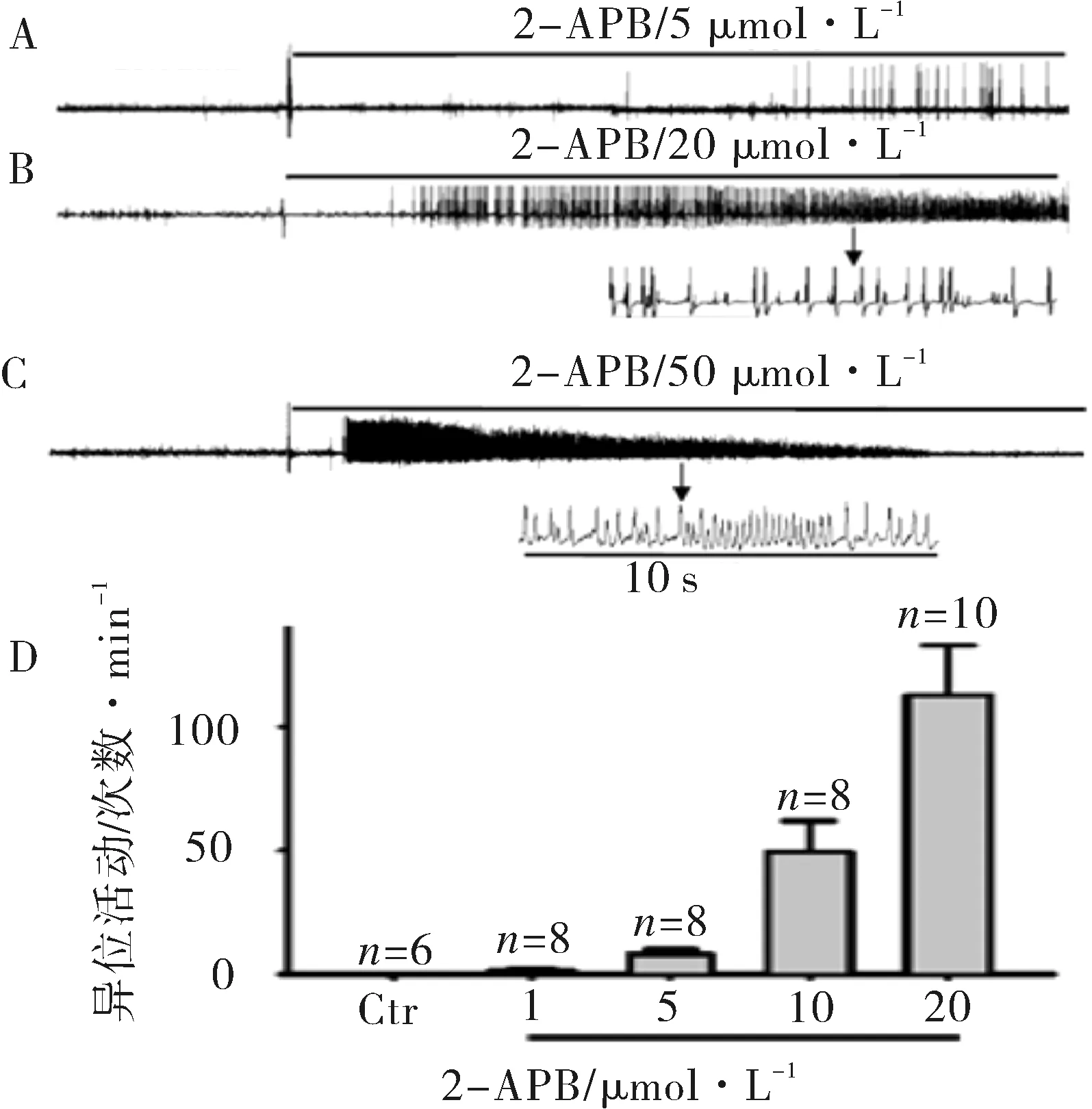
2.3钠通道和钙通道阻断剂预处理对2-APB诱发的大鼠左心房异位活动的作用本实验运用了两类抗心律失常药,钠通道阻断剂,利多卡因(10 μmol·L-1)和奎尼丁(10 μmol·L-1),电压依赖性L-型钙通道阻断剂维拉帕米(5 μmol·L-1)。用这三种药物预先孵育大鼠左心房10 min之后,给予20 μmol·L-1的2-APB。结果(图3):这三种药物都能明显抑制2-APB诱发的大鼠左心房的异位活动的频率,且实验中这三种药物的使用浓度与临床用药浓度基本相同。结果提示:2-APB诱发的大鼠左心房的异位活动可能有钠通道和电压依赖性L-型钙通道的参与。
注:和Ⅰ(仅2-APB 20 μmol·L-1)相比,aP<0.01。
图3奎尼丁,利多卡因和维拉帕米预处理抑制2-APB诱发的异位活动(n=10)
2.4钠通道和钙通道阻断剂后处理对2-APB诱发的大鼠左心房异位活动的作用2-APB作用于大鼠左心房5 min后,分别给予离子通道阻断剂利多卡因(10 μmol·L-1),奎尼丁(10 μmol·L-1)和维拉帕米(5 μmol·L-1)。观察发现:2-APB诱发的大鼠左心房的异位活动频率逐渐降低,高度也逐渐降低,最后直至完全消失,统计结果如图4所示。结果再次提示:2-APB诱发的大鼠心房的异位活动可能有钠通道和电压依赖性L-型钙通道的参与。
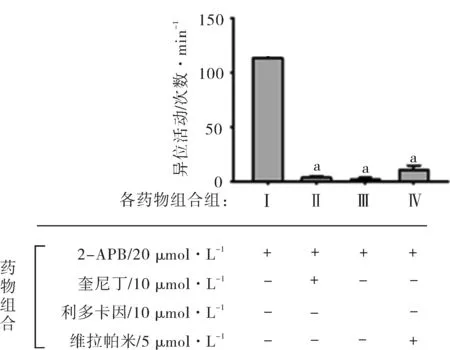
注:和Ⅰ(仅2-APB 20 μmol·L-1)相比,aP<0.01。
图4奎尼丁,利多卡因和维拉帕米预处理抑制2-APB诱发的异位活动(n=10)
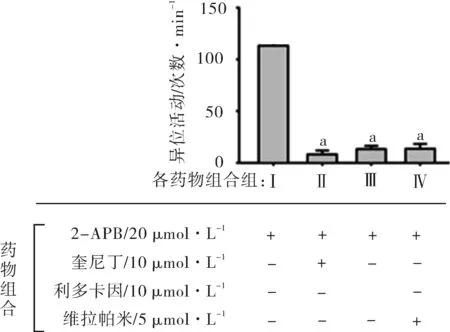
2.5钠钙交换抑制剂,非选择性阳离子通道抑制剂和无钙液对2-APB诱发的大鼠左心房异位活动的作用钠钙交换体抑制剂 DHC(20 μmol·L-1) 和Ni2+(5 μmol·L-1)均能抑制2-APB诱发的大鼠左心房的异位活动,非选择性阳离子通道剂Gd3+(100 μmol·L-1)不能抑制2-APB的作用,无钙的Krebs-Henseleit灌流液几乎能够完全阻断2-APB的作用(图5)。结果提示,2-APB诱发大鼠心肌细胞的钙超载是通过刺激内钙释放和外钙内流实现的,而且外钙的内流是通过电压依赖性L-型钙通道,而不是通过非选择性阳离子通道。2-APB作用的可能机制为:2-APB首先激活内钙的释放,内钙的增加驱动钠钙交换体,产生了净的内向电流,细胞膜去极化,钠通道和电压依赖性L-型钙通道开放,内流的钙离子增加,产生了心房的异位活动。
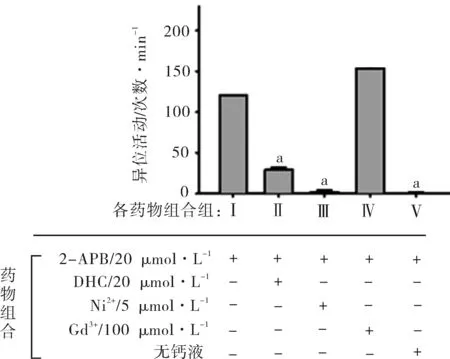
注:和Ⅰ(仅2-APB 20 μmol·L-1)相比,aP<0.01。
图52-APB诱发的异位活动能够被 DHC,Ni2+和无钙液所阻断,不能被Gd3+阻断(n=10)
3讨论
我们的实验证实2-APB能剂量依赖性的诱发大鼠心房的异位活动,并且该异位活动能够被钠通道阻滞剂,钙通道阻滞剂所阻断。我们假设2-APB为我们提供了另外一种方法用于筛选非选择性阻断钠通道,钙通道的抗心律失常药物。众所周知,细胞内钙离子的升高能够激活钠钙交换体,产生了瞬时内向的电流,细胞膜去极化,爆发动作电位。由此,结合我们目前的实验结果,2-APB诱发的心房异位活动的简略过程:2-APB引起细胞内钙的增加,钠钙交换体被激活,每将一个钙离子转移出细胞外就将三个钠离子转运进细胞内,从而产生了净的内向电流,细胞膜去极化,电压门控钠通道被激活,钠离子内流,细胞膜进一步去极化,电压依赖性L-型钙通道被激活,钙离子内流,细胞中钙离子的进一步增加诱发了大鼠左心房的异位活动。钠/钙交换,钠通道和钙通道是2-APB诱发心房异位活动中的三个关键步骤,阻止其中的任何一个都将抑制2-APB诱发的心房异位活动。
在本研究中,我们发现钠通道阻断剂,钙通道阻断剂或钠钙交换抑制剂能够完全抑制2-APB诱发的心房异位活动,并且实验中这些抗心律失常药物的使用浓度几乎与临床用药的浓度相同。
2-APB在体外能够明显诱发大鼠左心房的异位活动,但是体内注射却不能引起明显的心律失常。当致死剂量的2-APB被注射至大鼠体内,会产生窦性心动过缓和窦性停搏(数据没有显示)。2-APB能够作用于多种细胞产生广泛的作用,例如,抑制或激活钙离子信号转导[9],抑制TRPC通道[10],激活TRPV渠道[11],抑制电压门控的K+通道[12]。因为2-APB涉及不同的生理功能,因此我们不能简单地从2-APB的体外数据去推断出2-APB的体内作用。
经典的抗心律失常药物奎尼丁、利多卡因、维拉帕米能抑制2-APB诱发的大鼠左心房的异位活动。2-APB可用于筛选那些能非选择性抑制钠通道、钙通道和钠钙交换体的抗心律失常药物。
参考文献
[1]范婷婷,许邦龙.急性心肌梗死后新发房颤与继发恶性心律失常临床相关性分析[J].安徽医药,2015,19(3):515-517.
[2]黄家园,吴剑,杨丰华,等.房颤动物模型及其在细胞和分子疗法研究中的应用进展[J].中国实验动物学报,2015,23(2):205-208.
[3]蒋文平.新型抗心律失常药物[J].临床心电学杂志,2014,23(4):291-294.
[4]李超红,陈依春,翟旭雯,等.内向整流钾通道激动剂对大鼠异丙肾诱发心律失常的抑制作用[J].中国药理学通报,2015,31(8):1081-1085.
[5]欧贤红,曾晓荣.心房颤动治疗的心房选择性靶点[J].中国循环杂志,2014,29(11):943-945.
[6]杨宝峰,单宏利,周宇宏,等.一种筛选抗心律失常药物新模型的建立[J].中国药理学通报,2003,19(2):217-221.
[7]Wolkowicz PE,Wu HC,Urthaler F,et al.2-APB induces instability in rat left atrial mechanical activity[J].Cardiovasc Pharmacol,2007,49(5):325-335.
[8]Wolkowicz PE,Grenett HE,Huang J,et al.Apharmacological model for calciumoverload-induced tachycardia in isolated rat left atria[J].Eur Pharmacol,2007,576(1/2):122-131.
[9]Kapur N,Banach K.Inositol-1,4,5-trisphosphate-mediated spontaneous activity in mouse embryonic stem cell derived cardiomyocytes[J].Physiol,2007,581(Pt3):1113-1127.
[10] Rychkov G,Barritt GJ.TRPC1 Ca2+-permeable channels in animal cells[J].Handb Exp Pharmacol,2007,179:23-52.
[11] Chung MK,Lee H,Mizuno A,et al.2-aminoethoxydiphenyl borate activates and sensitizes the heatgatedion channel TRPV3[J].Neurosci,2004,24(22):5177-5182.
[12] Wang Y,Deshpande M,Payne R.2-aminoethoxydiphenyl borate inhibits phototransduction and blocks voltage-gated potassium channels in Limulus ventral photoreceptors[J].Cell Calcium,2002,32(4):209-216.
Inhibition of 2-aminoethoxydiphenyl-borate-induced rat atrial ectopic activity by antiarrhythmic drugs
XIE Yan,ZHANG Ting-ting
(DepartmentofPhysiology,DaqingCampusofHarbinMedicalUniversity,Daqing,Heilongjiang163319,China)
Abstract:ObjectiveTo explore the inhibition of 2-APB-induced rat atrial ectopic activity by antiarrhythmic drugs.Methods2-APB-induced ectopic activity was measured through an isometric force transducer connected to amultichannel acquisition and analysis system.Results2-APB dose-dependence increased the ectopic activity of left atria at 1,5,10,20,50 μmol·L-1.Anti-arrhythmic drugs,quinidine(10 μmol·L-1),lidocaine (10 μmol·L-1),verapamil (5 μmol·L-1) inhibited 2-APB-induced ectopic activity.2-APB-induced ectopic activity was inhibited by Ca2+-free bath,Na+/Ca2+exchanger blockers,3’,4’-dichlorobenzamil hydrochloride (DHC) and Ni2+,not by non-selective cation channel blocker Gd3+. Conclusions2-APB-induced atrial ectopic activity was inhibited by classic anti-arrhythmic drugs quinidine,lidocaine,verapamil,and Na+/Ca2+exchanger blockers.It can be used for testing agents able to affect any of Na+,Ca2+channel,Na+/Ca2+exchanger without selectivity.
Key words:Anti-Arrhythmia Agents;Lidocaine;Quinidine;Verapamil;Rats,Wistar;2-Aminoethoxydi pheny borate
doi:10.3969/j.issn.1009-6469.2016.05.005
(收稿日期:2016-01-11,修回日期:2016-03-11)

