Triton X-114用于去除内毒素的研究
吴中华
(安徽省生物研究所,安徽 合肥 230088)
Triton X-114用于去除内毒素的研究
吴中华
(安徽省生物研究所,安徽 合肥230088)
摘要:目的探讨规模化生产原核表达重组蛋白的Triton X-114去除细菌内毒素的方法与效果。方法以大肠杆菌表达的重组人干扰素α2b、重组人生长激素、重组葡激酶蛋白粗提液为原料,采用反复抽提相分离法,研究Triton X-114去除细菌内毒素的效果。结果经一次Triton X-114抽提,能够去除蛋白粗提液中95%的细菌内毒素,蛋白收率保持85%以上,蛋白性质不受影响。结论Triton X-114反复抽提相分离法能够有效地去除细菌内毒素,适合于规模化原核重组蛋白的生产。
关键词:洗涤剂;内毒素类;重组蛋白质类/分离和提纯
大肠杆菌因其遗传背景清晰、操作简便、表达量高,是大量制备结构简单、不需要糖基化的重组蛋白的首选表达系统[1]。在利用大肠杆菌系统生产治疗性重组蛋白时,在破碎细菌获得蛋白的同时细胞壁内的内毒素及生产操作产生的内毒素大量释放到蛋白溶液中[2-3],内毒素的去除是建立纯化工艺时必须考虑的关键问题。细菌内毒素的主要成分是脂多糖(LPS),呈弱酸性,其等电点在6.0左右,与很多种蛋白的等电点接近;而且脂多糖能够与某些碱性蛋白形成复合体,常规除去内毒素的方法有超滤、柱层析、离子交换分离技术[4-6],但由于内毒素固有的生物特性,使得这些方法具有一定的局限性。
1990 年,Aida 等[7]首次报道了用Triton X-114 液相分离法去除重组蛋白溶液中内毒素的方法,此后陆续有研究采用此方法来去除生物制品中的内毒素, Triton X-114在生物制品生产中具有潜在的应用前景[8-10]。
Triton X-114是一种非离子型表面活性剂,具有较低的临界胶束浓度,在4 ℃能和水溶液互溶,并与脂多糖分子结合,25 ℃以上能携带脂多糖分子从水相中析出。利用Triton X-114的这一性质,我们研究了适合于规模化重组蛋白生产的Triton X-114相分离去除细菌内毒素的方法和效果。
1材料与方法
1.1材料重组人干扰素α2b(rhIFNα2b)、重组人生长激素(rhGH)、重组葡激酶(rSak)的基因工程菌均由安徽安科生物工程(集团)公司研发中心保存。Triton X-114(纯度≥99%)购自SIGMA公司。发酵用蛋白胨和酵母提取物为OXOID产品。鲎试剂和内毒素检查用水均为湛江博康海洋生物有限公司产品(批号分别为1311260、1312050),鲎试剂灵敏度由安徽省食品药品检验所再标定,0.25 EU·mL-1;细菌内毒素标准品购自中国药品生物制品检定院(批号1306151)。其它化学试剂均为国产分析纯级。各种层析填料购自Pharmacia公司,α干扰素单克隆抗体亲和层析胶安徽安科公司研制制备。
1.2蛋白粗提液的制备菌体破碎前用生理盐水洗涤2次。rhIFNα2b为可溶性表达,200 g菌体用1 000 mL 20 mmol·L-1pH7.0 磷酸盐缓冲液悬浮后经高压匀浆法破碎,15 000 g离心15 min后,上清即为蛋白粗提液。
rhGH为胞周质分泌型表达,200 g菌体用500 mL 含10%蔗糖的20 mmol·L-1pH7.0 磷酸盐缓冲液悬浮30 min,6 000 g离心10 min菌体再用4 000 mL去离子水悬浮30 min,1 000 g连续流离心收集流出液,超滤浓缩至1 000 mL。
rSak为包含体方式表达,400 g菌体用600 mL 20 mmol·L-1pH7.0 磷酸盐缓冲液悬浮后经高压匀浆法破碎,15 000 g离心10 min,弃上清。沉淀分成两份,分别用600 mL含0.5% Triton X-110和0.5%Triton X-114的磷酸盐缓冲液充分悬浮洗涤,重复3次,得rSak包含体,比较两种洗涤方式对蛋白粗提液中内毒素含量的影响。包含体用8 000 mL 6 mol·L-1盐酸胍溶解后对20 mmol·L-1pH7.0 磷酸盐缓冲液充分透析,15 000 g离心15 min后,上清用pH7.0 磷酸盐缓冲液定容至1 000 mL,即为蛋白粗提液。
1.3Triton X-114抽提去除内毒素Triton X-114抽提去除内毒素的操作步骤为:在蛋白粗提液中加入1% Triton X-114,4 ℃磁力搅拌60 min,充分混溶;30 ℃水浴中放置40 min,不时搅拌;25 ℃ 15 000 g离心15 min,小心移出上层水相。Triton X-114抽提去除内毒素试验,进行两个循环;提取过程中所用的玻璃器皿250 ℃烘烤45 min以上,塑料离心管用0.5 mol·L-1的NaOH浸泡1 h然后用注射用水洗涮干净。
Triton X-114抽提去除内毒素工艺过程中,Triton X-114的加入量(1%)、4 ℃磁力搅拌时间(60 min)和30 ℃水浴时间(40 min)这一参数组合值,是以小量rhIFNα2b蛋白粗提液为样品,采用正交试验法测定这三种因子不同水平的组合对内毒素去除率(E%)、蛋白回收率(P%)的综合影响,而最终确定的。
1.4内毒素含量测定和蛋白定量及性质鉴定内毒素含量的测定按《中国药品检验标准操作规程》(2010版) 凝胶半定量法检测;蛋白定量采用Lowry法[11]。
抽提以后的蛋白粗提液进行纯化,注意观察目标蛋白在层析过程中的柱行为。最终的纯化样品,除测定内毒素含量以外,SDS-PAGE鉴定纯度,rhIFNα2b用细胞病变抑制法测定其抗病毒活性,rSak用平板溶圈法测定其纤维蛋白溶解活性,rhGH用高效液相色谱法测定保留时间[12]。
1.5Triton X-114对鲎试剂灵敏度的影响采用内毒素标准品,分别用内毒素检查用水配制成0.01%、0.1%的Triton X-114溶液,将内毒素标准品配制成1.0、0.9、0.8、0.7、0.6、0.5、0.4、0.3、0.2 EU·mL-1梯度溶液,内毒素标准品溶解后,在旋涡混合器上混合15 min,以后每一步稀释前最少混合30 s[13],各取0.1 mL加入含0.1 mL鲎试剂的反应管,混匀后37 ℃保温(60±2)min,倒置反应管观察凝固情况。
2结果
2.1Triton X-114和Triton X-110洗涤包含体对蛋白粗提液中内毒素含量的影响提取rSak包含体,分别采用含0.5% Triton X-110或0.5% Triton X-114的磷酸盐缓冲液洗涤包含体,复性以后蛋白粗提液中的内毒素含量分别为12 500~25 000 EU·mg-1和7 500~15 000 EU·mg-1, Triton X-114洗涤较Triton X-110洗涤内毒素下降明显,蛋白浓度分别为5.64和5.89 g·L-1,差异无统计学意义。
2.2Triton X-114的加入量、4℃磁力搅拌时间和30℃水浴时间对内毒素去除率、蛋白回收率的影响参考已有文献的数据,正交试验设计为:Triton X-114的加入量(V/V,%)设0.5%、1%和2%三个水平,4 ℃磁力搅拌时间设30、60和90 min,30℃水浴时间设20、40和60 min,对内毒素去除率(E)和蛋白回收率(P)的影响结果见表1。
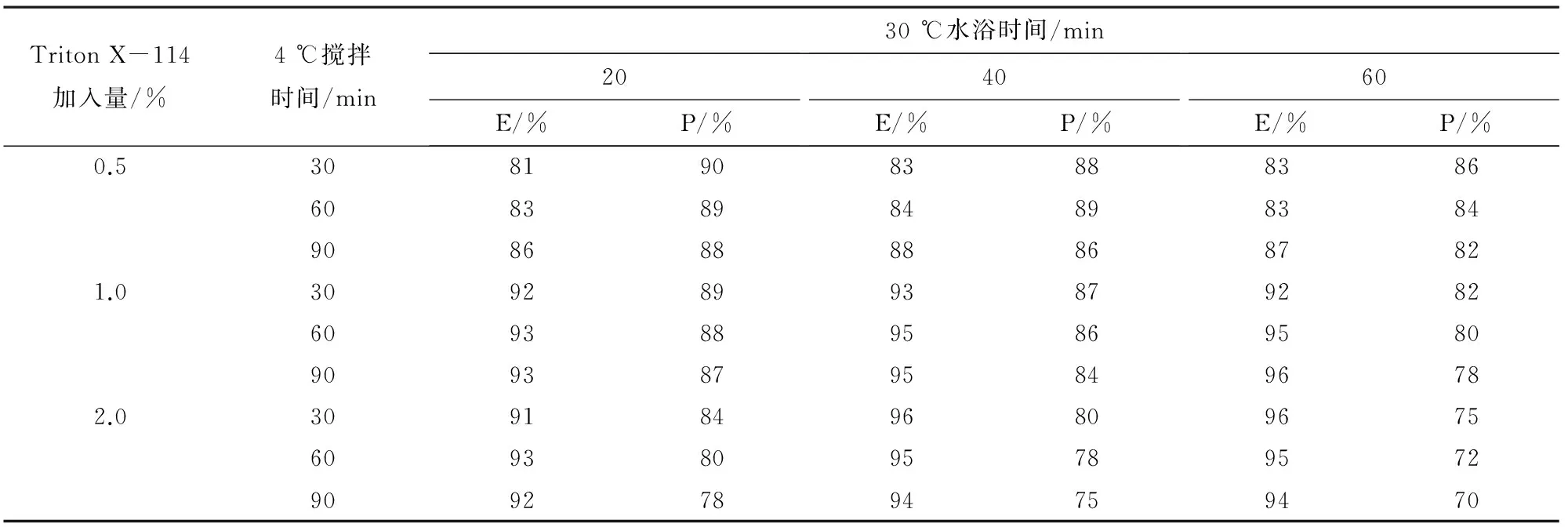
表1 Triton X-114加入量、4 ℃磁力搅拌时间和30 ℃水浴时间对内毒素去除率、蛋白回收率的影响
综合考虑内毒素去除率和蛋白回收率,确定Triton X-114加入量、4 ℃磁力搅拌时间和30 ℃水浴时间最佳水平组合为1%、60 min和40 min。
2.3Triton X-114相分离法去除细菌内毒素的效果蛋白粗提液经 Triton X-114反复抽提2次,rhIFNα2b、rhGH、rSak第一次抽提内毒素下降95%以上,第二次抽提内毒素下降98%以上,测定结果见表2。
2.4Triton X-114抽提对蛋白含量和性质的影响Triton X-114抽提前后,用Lowry法测定蛋白浓度,根据溶液体积及浓度的变化计算重组蛋白的回收率,rhIFNα2b、rhGH、rSak第一次抽提蛋白回收率85.5%以上,第二次抽提蛋白回收率85.6%以上,结果见表3。
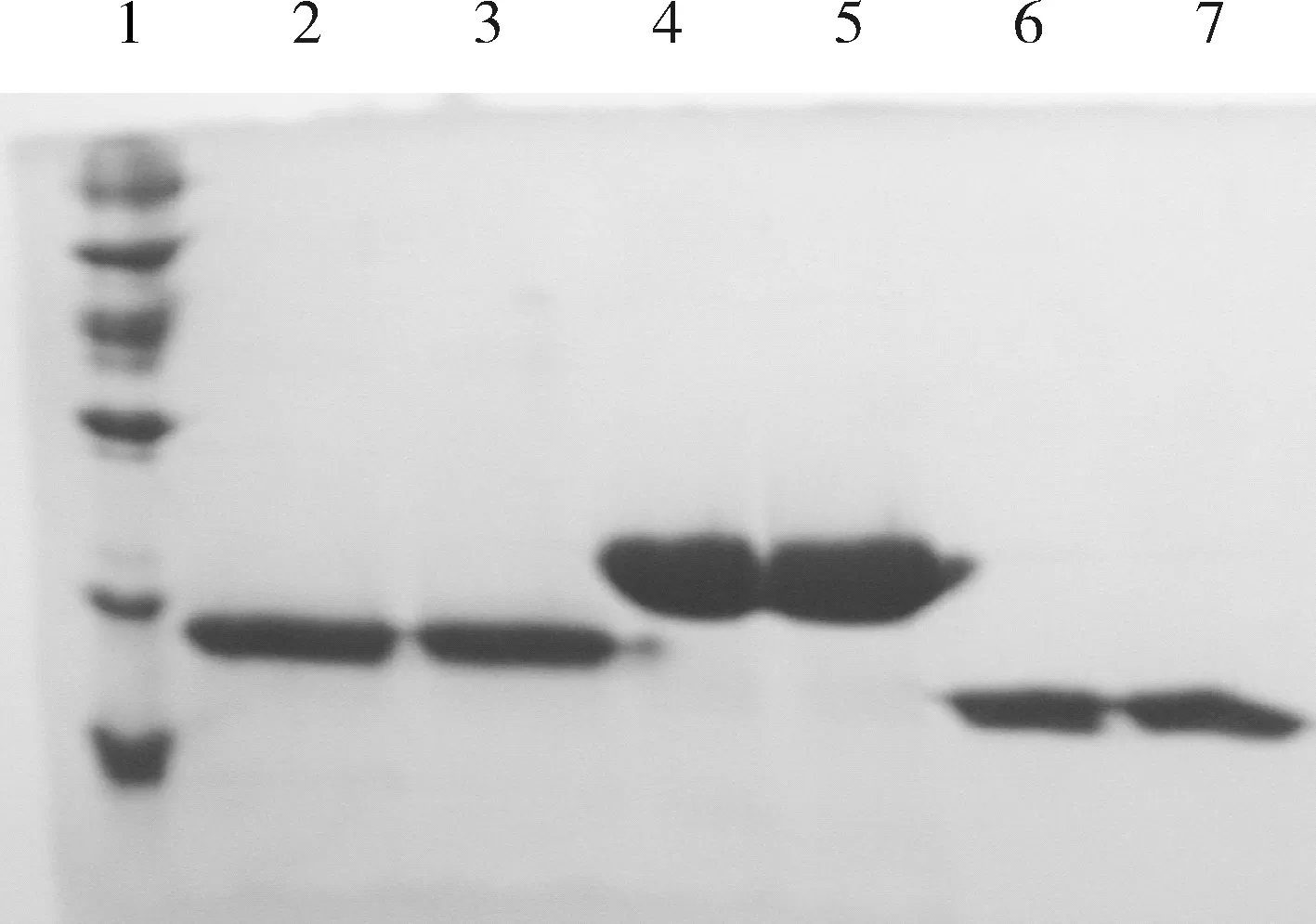
注:泳道1:分子量标记 ( 99.7ku,66.2 ku,45.0 ku,31.0 ku,20.5 ku,14.4 ku );泳道2:rhIFNα2b 粗提液经Triton X-114抽提后的纯化样品;泳道3:rhIFNα2b 粗提液经未经Triton X-114抽提后的纯化样品; 泳道4:rhGH粗提液经Triton X-114抽提后的纯化样品;泳道5:rhGH粗提液未经Triton X-114抽提后的纯化样品;泳道6:rSak粗提液经Triton X-114抽提后的纯化样品;泳道7:rSak粗提液未经Triton X-114抽提后的纯化样品。
图1纯化后重组蛋白电泳图
2.5蛋白性质鉴定Triton X-114抽提后,蛋白粗提液进行纯化,发现在层析过程中三种蛋白的柱行为没有任何变化,纯化后目标蛋白纯度(图1)、纯化过程中蛋白收率都与原工艺相当。纯化以后,三种重组蛋白的内毒素含量均低于0.125 EU·mg-1,与文献报道一致[14];rhIFNα2b抗病毒活性为1.2×108IU·mg-1, rSak的纤维蛋白溶解活性4.0×104RU·mg-1,与未经Triton X-114抽提的纯化样品相比较没有下降;rhGH RP-HPLC保留时间不变。
2.6Triton X-114对鲎试剂灵敏度的影响0.01% 和0.1% 的Triton X-114,使得鲎试剂的灵敏度从0.2~0.3 EU·mL-1分别下降至0.6~0.7 EU·mL-1和0.7~0.8 EU·mL-1。试验结果见表3。
3讨论
3.1Triton X-114洗涤包含体对蛋白粗提液中内毒素含量的影响包含体是大肠杆菌高效表达外源蛋白一种常见的形式。除重组蛋白外,包含体中还有核糖体蛋白和RNA、其它来源的杂蛋白以及内毒素组分脂多糖等。包含体提取过程中的洗涤步骤,是用含有非离子表面活性剂(最常用的则是Triton X-110)的溶液,尽可能地去除细胞碎片和附着在包含体颗粒表层的一些杂质。分别用含0.5%Triton X-110和0.5%Triton X-114洗涤液洗涤包含体,复性以后蛋白粗提液中的细菌内毒素含量虽然存在一定的差异(12 500~25 000 EU·mg-1vs7 500~15 000 EU·mg-1),但效果并不十分显著。这是因为包含体的结构十分致密,包裹于其内部的内毒素分子在洗涤过程中无法去除。
3.2Triton X-114相分离法去除细菌内毒素的效果本研究结果显示,采用Triton X-114相分离法,一次抽提就可以去除95%以上的细菌内毒素,显著降低重组蛋白溶液中的内毒素含量。仔细分析数据还可以发现,在rhIFNα2b和rhGH的第二轮抽提、rSak的两轮抽提过程中,内毒素含量降低的幅度都在98%以上。这一结果,与文献报道的基本一致[15]。Triton X-114相分离法去除内毒素的效果,显然与蛋白溶液中内毒素的含量、Triton X-114的加入量都有关系。实际上,在本研究进行的过程中,我们也实验证实了在一定的浓度范围内,Triton X-114 的加入量与内毒素的去除效果呈正相关(结果未显示)。我们选择1%的Triton X-114加入量,是基于内毒素去除效果和蛋白回收率两方面的综合考虑。因为在抽提过程中,蛋白溶液的浓度基本不会变化,但蛋白溶液的体积会减少,而且减少的幅度与Triton X-114的加入量成正比。本研究所采用的Triton X-114相分离抽提方法,蛋白收率在85%以上。抽提溶液离心以后,虽然下层有机相和上层水相之间界面清晰,但在移出上清溶液时为了确保下层Triton X-114不流出而导致污染,这一步骤样品损失明显。如果能在该步骤上做技术性改进,则整个抽提过程的蛋白回收率会大幅度提高。而蛋白收率的提高,才能使得反复抽提成为可能。
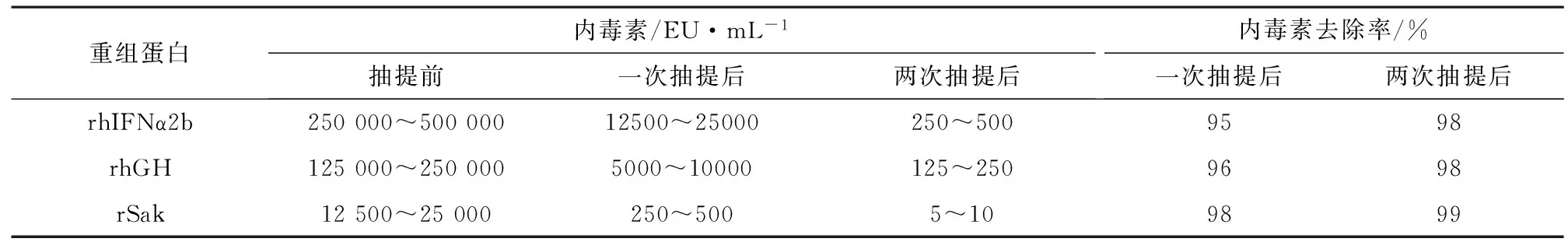
表2 Triton X-114抽提去除内毒素的效果

表3 Triton X-114抽提对蛋白含量的影响

表3 Triton X-114对鲎试剂灵敏度的影响
注:+:凝固(阳性)-:未凝固(阴性)。
Triton X-114本身为一种非离子性表面活性剂,不会对蛋白的性质产生影响,重组蛋白只要能耐受Triton X-114抽提过程中的温度条件,则都能适用于Triton X-114相分离技术以去除内毒素。
3.3Triton X-114对鲎试剂灵敏度的影响采用相分离法去除内毒素,上层水相蛋白溶液中总会残留有极少量或者微量的Triton X-114。这些Triton X-114残留,是否会严重地干扰鲎试剂法测定内毒素的试验结果?本研究设计了一项试验,验证Triton X-114对鲎试剂灵敏度的影响,结果表明,0.01% 和0.1% 的Triton X-114,使得鲎试剂的灵敏度降低,从0.2~0.3 EU·mL-1分别下降至0.6~0.7 EU·mL-1和0.7~0.8 EU·mL-1。
0.01% 和0.1%的 Triton X-114使鲎试剂的灵敏度降低了2~4倍, 而Triton X-114抽提前后内毒素水平则相差20~50倍(95%~98%);将内毒素的去除与重组蛋白的纯化工艺结合,初始浓度为1% Triton X-114,经提取、透析、层析或离子交换等处理,残留量可降至1 mg·L-1以下[14],其最终测定液中的Triton X-114浓度远远地低于0.01%。由此可以得出结论,最终纯化样品中 Triton X-114残留对鲎试剂的灵敏度基本无影响,但Triton X-114抽提去除细菌内毒素的效果是不容置疑的。
参考文献
[1]Rosano GL,Ceccarelli EA.Recombinant protein expression in Escherichia coli: advances and challenges[J].Front Microbiol,2014,17(5):172-176.
[2]Xing H,Huang Y,Li Y,et al.Effect of affinity medium and solution condition on endotoxin removal from protein solutions[J].Chin J Biotech,2010,26(11):1584-1594.
[3]李彦英,王珙,李凌瑞,等.单克隆抗体纯化过程中内毒素去除方法分析[J].生物技术通讯,2013,24(1):94-97.
[4]邢海新,黄永东,李岩,等.亲和介质及溶液条件对蛋白质溶液中内毒素去除的影响[J].生物工程学报,2010,26(11):1584-1594.
[5]王素红,韩金祥,王世立,等.离子交换色谱法去除rhO P-1蛋白溶液中内毒素的方法[J].医学分子生物学杂志,2008,5(3):244-246.
[6]朱晓丽,范代娣,马戎.阴离子交换法去除类人胶原蛋白中的内毒素[J].化学工程,2011,39(3):67-71.
[7]Aida Y,Pabst MJ.Removal of endotoxin from protein solutions by phase separation using Triton X-114[J].J Immunol Methods,1990,132(2):191-195.
[8]王雪薇,王建华.Triton X-114 萃取法去除脑膜炎球菌荚膜多糖中的内毒素[J].中国生物制品学杂志,2008,21(5):438-441.
[9]黄秋香,毕湖冰,张新文,等.T riton X-114 液相分离法去除流感单价病毒原液中内毒素的实验研究[J].重庆医学,2010,39(4):385-387.
[10] Zhang J,Zhu C, Fan D.Findotoxin removal from recombinant human-like collagen preparations by triton X-114 two-phase extraction[J].Biotechnology,2013,12(2):135-139.
[11] 中国药品生物制品检定所.中国药品检验标准操作规程[M].北京:中国医药科技出版社,2010:310-325.
[12] 国家药典委员会.中国药典(三部)[S].北京:中国医药科技出版社,2015:附录132-137.
[13] 尹立平.细菌内毒素检查法-动态浊度法[J].天津药学,2014,26(1):50.
[14] 肖兰艳,何颖,刘雪婷,等.重组大肠杆菌表达的Bere1纯化工艺中去除内毒素效果研究[J].热带医学杂志,2015,15(5):584-585.
[15] Lopes AM.Santos-Ebinuma VC LPS-protein aggregation influences protein partitioning in aqueous two-phase micellar systems[J].Appl Microbiol Microbiol,2013,97(14) :6201-6209.
Removal of endotoxin by Triton X-114 phase separation
WU Zhong-hua
(BiologicalResearchInstitute,Hefei,Anhui230088,China)
Abstract:ObjectiveTo evaluate an effective method to remove endotoxin with Triton X-114 phase separation for E.coli recombinant protein purifications.MethodsTriton X-114 phase separation was used to remove endotoxin from crude preparations of recombinant human interferon α2b,human growth hormone,and staphylokinase.ResultsThe reduction in endotoxin levels was greater than 95% with Triton X-114 phase separation,and recovery of the proteins after endotoxin removal was greater than 85%,meanwhile the characteristics of recombinant proteins did not change.ConclusionsTriton X-114 phase separation is a kind of effective method to remove endotoxin for large-scale E.coli recombinant protein purifications.
Key words:Detergents;Endotoxins;Recombinant Proteins/isolation & purification
doi:10.3969/j.issn.1009-6469.2016.05.009
(收稿日期:2015-12-15,修回日期:2016-03-08)

