单体牡蛎诱导变态的研究
陈 亨, 方 军, 滕爽爽, 肖国强, 张炯明, 柴雪良, (. 温州医科大学 生命科学院、检验医学院, 浙江 温州325035; 2. 浙江省海洋水产养殖研究所, 浙江 温州325005; 3. 浙江省近岸水域生物资源开发和保护重点实验室, 浙江 温州 325005; 4. 中国水产科学研究院海洋贝类工程技术研究中心, 浙江 温州 325005)
单体牡蛎诱导变态的研究
陈 亨1, 方 军2, 3, 4, 滕爽爽2, 3, 4, 肖国强2, 3, 4, 张炯明2, 3, 4, 柴雪良1, 2, 3, 4
(1. 温州医科大学 生命科学院、检验医学院, 浙江 温州325035; 2. 浙江省海洋水产养殖研究所, 浙江 温州325005; 3. 浙江省近岸水域生物资源开发和保护重点实验室, 浙江 温州 325005; 4. 中国水产科学研究院海洋贝类工程技术研究中心, 浙江 温州 325005)
为了得到壳型规则、大小均一的单体牡蛎, 作者以葡萄牙牡蛎(Crassostrea angulata)和长牡蛎(Crassostrea gigas)眼点幼虫为材料, 从肾上腺素(EPI)浓度梯度、处理时间梯度和眼点幼虫密度梯度3个因素诱导产生不固着变态的单体牡蛎。结果表明, 葡萄牙牡蛎用EPI处理24 h的最适浓度为5×10–4mol/L,不固着变态率为72.8%, 在该最适浓度下, 最佳处理时间为12 h, 不固着变态率为82.7%。长牡蛎用EPI处理6 h的最适浓度为5×10–5mol/L, 不固着变态率为53.2%, 在该最适浓度下, 最佳处理时间为8h, 不固着变态率为56.8%, 眼点幼虫密度在80个/mL以下EPI处理效果没有显著性差异。对长牡蛎幼虫进行后续生长测定, 结果显示EPI处理组幼虫的壳长、壳高和存活率要高于对照组, 表明EPI可能促进牡蛎幼虫变态长出次生壳并提高其生存能力。
葡萄牙牡蛎(Crassostrea angulata); 长牡蛎(Crassostrea gigas); 单体牡蛎; 不固着变态
[Foundation: Mariculture Technology Innovation Team Project III of Wen-Zhou City(C20120004-3); The test station of national shellfish-industry technology system (CARS-48); The operation service platform of aquatic germplasm resources(2014DKA30470); Scientific technology project of Zhejiang Province(2013F50016)]
牡蛎属于软体动物门(Mollusca)、瓣鳃纲(Lamellibranchia)、珍珠贝目(Pterioida)、牡蛎科(Ostreidae),是中国沿海最重要的经济型养殖贝类, 是世界上第一大养殖贝类, 其种类繁多, 分布广泛。全世界有100多种, 中国已发现20余种。据农业部统计, 2012年中国牡蛎养殖产量达394.8817万t, 占贝类养殖总产量的32.7%。尤其是福建和广东, 其牡蛎养殖产量占总产量的37.4%和26.0%[1]。
近几年来, 随着养殖规模的扩大, 牡蛎产量大大提高, 但牡蛎的养殖也存在很多问题, 如群聚的牡蛎受生长空间的限制, 大小相差悬殊, 壳形极不规则, 采用贝壳、橡皮条等做为固着基进行筏式养殖,因牡蛎壳形和固着基不规则, 在沿海地区常年的风浪冲击下极易脱落。由于养殖环境、品质等因素, 中国养殖的牡蛎价格十分低廉, 仅为国际市场价格20%左右[2]。目前, 国际上发达国家的牡蛎养殖主要采用单体牡蛎养殖的方式, 中国早在20世纪70年代后期就开始诱导单体牡蛎的生产, 目前国内也有单体牡蛎的筏式笼养[3-5], 但发展缓慢。单体牡蛎具有外形美观、大小均匀、易于加工和运输、便于控制养殖密度等优点, 能在一定程度上解决牡蛎品质不高、死亡率高等问题。其次, 单体牡蛎便于筏式笼养和管理,能提高抗风浪能力和单位面积产量, 经济价值较高。
浙江省乐清市是“贝类养殖发祥地”之一, 而乐清清江是“中国牡蛎之乡”, 地处乐清湾西岸, 葡萄牙牡蛎(Crassostrea angulata)已成为乐清湾的优势品种。葡萄牙牡蛎也称僧帽牡蛎(Ostrea cucullata), 主要分布于中国南方沿海, 原产于欧洲沿海, 具有个体大、适应力强、养殖周期短、味道鲜美等优点。长牡蛎(Crassostrea gigas), 也称太平洋牡蛎, 为沿海地区20世纪80年代从日本引进, 具有个体大、生长快、产量高等优点, 是中国牡蛎养殖的主要品种之一。国内有一些关于阳离子和化学物质诱导贝类幼虫附着和变态的报道[6-17], 国外也有一些关于神经递质诱导单体牡蛎的报道[18-20]。但关于单体牡蛎的研究甚少且未见诱导单体葡萄牙牡蛎的报道; 其次,同种牡蛎因地域、培养条件等差异导致最适EPI浓度差异, 杨爱国等[10]、Coon 等[11]诱导单体长牡蛎的最适EPI浓度为10–4mol/L,方琦等[12]诱导单体长牡蛎和僧帽牡蛎的最适EPI浓度是5×10–5mol/L, Beiras等[19]诱导单体长牡蛎的最适EPI浓度为10–4mol/L。作者从浓度、时间、幼虫密度梯度3个方面用EPI对葡萄牙牡蛎和长牡蛎进行不固着变态的诱导, 为乐清湾牡蛎人工单体育苗提供了科学理论和技术指导。
1 材料和方法
1.1 材料
实验于2014年4月25日和2014年5月21日在浙江省海洋水产养殖研究所清江基地进行, 试验材料分别为葡萄牙牡蛎和长牡蛎眼点幼虫, 葡萄牙牡蛎取自福建厦门, 长牡蛎取自山东威海, 平均壳长分别为(332 ± 18)μm和(320 ± 37)μm。通过人工解剖牡蛎亲贝获得卵子和精子, 洗卵, 人工受精, 获得受精卵, 于24℃海水中培养25 d得到眼点幼虫, EPI 来自SIGMA。
1.2 方法
1.2.1 葡萄牙牡蛎诱导实验
将葡萄牡蛎眼点幼虫放到1.5 L塑料杯中并充气,控制牡蛎幼虫的密度为10个/mL。将EPI配成5×10–4、1×10–4、5×10–5、1×10–5、5×10–6、1×10–6mol/L 的EPI 浓度梯度, 设3个平行组。将幼虫在不同的EPI浓度下处理24 h, 然后测定牡蛎幼虫的不固着变态率, 确定EPI诱导的最适浓度; 用最适浓度处理眼点幼虫0.5、1、2、4、10、12、24 h, 测定EPI诱导的最佳处理时间(诱导葡萄牙牡蛎不固着变态的最适浓度表示EPI处理24 h的最适浓度, 最佳时间表示5×10–4mol/L EPI处理的最佳时间)。
1.2.2 长牡蛎诱导实验
控制长牡蛎幼虫的密度为10个/mL, 将EPI配成0、5×10–4、1×10–4、5×10–5、1×10–5、5×10–6mol/L 的EPI浓度梯度, 设3个平行组。将幼虫在不同的EPI浓度下处理6 h, 药物过滤8 h后测定牡蛎幼虫的不固着变态率, 确定EPI诱导的最适浓度; 用最适浓度处理眼点幼虫0.5、1、2、4、8、12 h, 药物过滤8 h后测定EPI诱导的最佳处理时间; 用最适EPI浓度和最佳处理时间处理密度为5、10、20、50、80个/mL的牡蛎眼点幼虫, 药物过滤8 h后测定EPI诱导的最佳幼虫密度(诱导长牡蛎不固着变态的最适浓度表示EPI处理6 h的最适浓度, 最佳时间表示5×10–5mol/L EPI处理的最佳时间, 最佳幼虫密度表示5×10–5mol/L EPI处理8 h的最佳幼虫密度)。
继续对不同浓度、时间、密度梯度处理组进行培养, 每天喂料两次, 换水1次(换水量4/5), 每天测定牡蛎幼虫的壳长、壳高(30个)、存活率, 比较观察后续1周的生长情况差异。
1.2.3 测量
存活率测定方法: 取10 mL处理后的样液对幼虫总数及死亡数进行计数, 存活率/%=[(幼虫总数–死亡数)/幼虫总数]×100%。
变态率测定方法: 取10 mL样液, 将幼虫置于载玻片上, 轻轻摇晃使变态不游动的幼虫集中到载玻片中间, 以次生壳长出、鳃发达、面盘消失和足部退化为变态标志, 对变态幼虫进行计数, 再用碘酊处理, 对幼虫总数进行计数, 计算变态率。
幼虫壳长壳宽的测定方法: 取10 mL样液置于显微镜下拍照, 随机取30个牡蛎幼虫, 用ImageJ软件测定壳长、壳高, 乘以放大倍数得到实际壳长、壳高。
1.2.4 统计分析
用SPSS17.0对数据进行单因素方差分析, 并用Tukey和DunnettT3进行多重比较。不同字母代表差异显著性P<0.05。
2 结果
2.1 不同EPI浓度梯度诱导产生单体牡蛎
2.1.1 葡萄牙牡蛎
实验中分别用5×10–4、1×10–4、5×10–5、1×10–5、5×10–6、1×10–6mol/L肾上腺素(EPI)对葡萄牙牡蛎眼点幼虫进行诱导24 h。根据幼虫的变态情况发现5×10–4mol/L EPI处理效果最好, 不固着变态率为72.8%, 存活率为91.3%(图1)。
2.1.2 太平洋牡蛎
实验中分别用0、5×10–4、1×10–4、5×10–5、1×10–5、5×10–6mol/L肾上腺素(EPI)对长牡蛎眼点幼虫进行诱导6 h, 药物过滤后8 h测定。根据幼虫的变态情况发现1×10–4和5×10–5mol/L EPI 处理的不固着变态率较高, 分别为54.5% 和53.2%, 5×10–4mol/L EPI处理的不固着变态率仅为38.5%, 且对长牡蛎幼虫的活力有强烈的抑制作用(图2 a)。
对不同浓度梯度长牡蛎幼虫进行后续生长测定,测定幼虫的壳长、壳高和存活率。前3 d各处理组90%以上存活; 第四天5×10–4mol/L 处理组的幼虫大量死亡, 10%以下存活, 其余各处理组的幼虫少量死亡, 60%以上存活; 第五天5×10–4mol/L 处理组和对照组的幼虫基本死亡, 其余各处理组的幼虫存活率为10%且存活的均为有明显次生壳的大个体(图2 b)。幼虫壳长和壳高变化趋势相近, 前3 d变化不明显,第四天5×10–5mol/L EPI处理组的幼虫居首, 第五天1×10–4、5×10–5mol/L EPI 处理组的幼虫明显高于对照组和5×10–4mol/L 处理组(图3)。综合各因素, EPI处理的最适浓度为5×10–5mol/L。
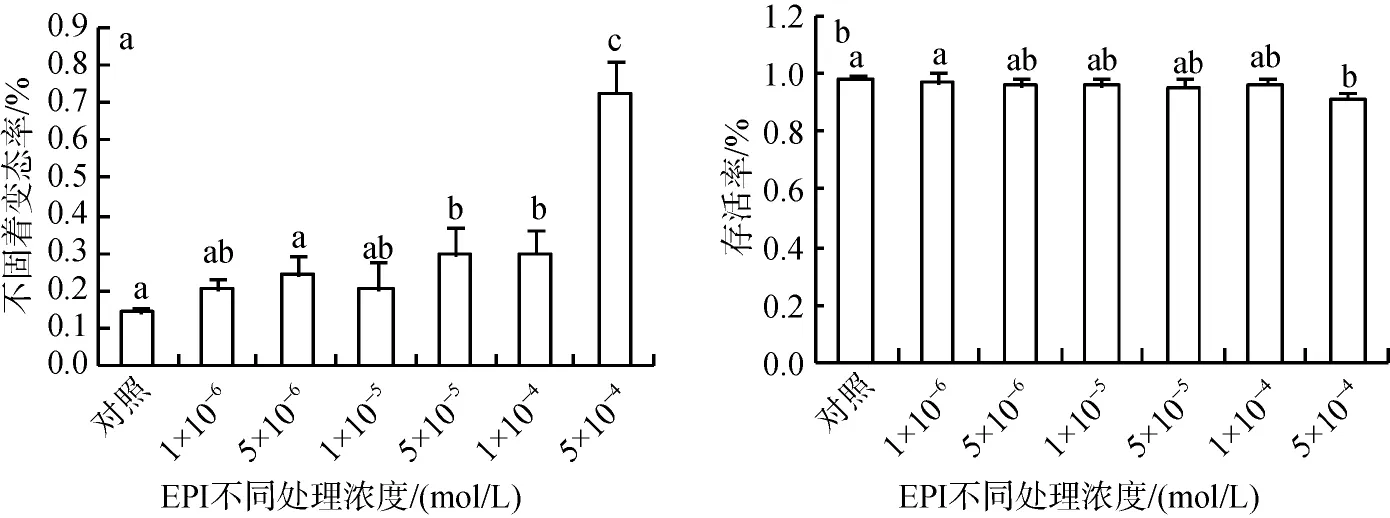
图1 不同EPI 浓度处理葡萄牙牡蛎眼点幼虫的不固着变态率(a)和存活率(b)Fig.1 Metamorphic (a) and survival (b) rates for Crassostrea angulata eyed-larvae exposed to different concentrations of epinephrine (EPI)
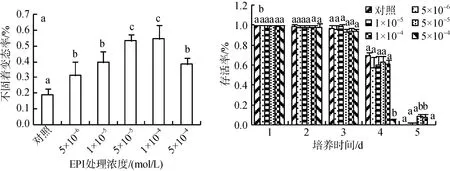
图2 不同的EPI 浓度处理长牡蛎眼点幼虫的不固着变态率(a)和存活率(b)Fig.2 Metamorphic (a) and survival (b) rates for Crassostrea gigas eyed-larvae exposed to different concentrations of epinephrine (EPI)
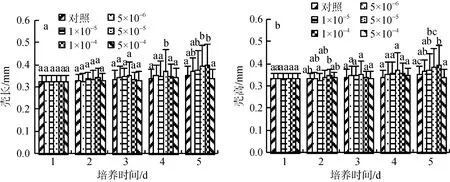
图3 不同EPI浓度处理的长牡蛎幼虫壳长(a)、壳高(b)变化Fig.3 Changes in the shell length (a) and shell height (b) of Crassostrea gigas larvae exposed to different concentrations of epinephrine (EPI)
2.2 不同时间梯度诱导产生单体牡蛎
2.2.1 葡萄牙牡蛎
本实验用5×10-4mol/L EPI 对葡萄牙牡蛎眼点幼虫分别处理0.5、1、2、4、10、12、24 h。根据幼虫的变态情况发现12 h EPI 处理效果最好, 变态率为82.7%, 存活率为89.8% (图4)。EPI处理24 h幼虫变态率为88.9%, 略高于处理12 h的变态率, 存活率为89.2%, 两者未见显著性差异, 可能需要进行后续生长跟踪, 但幼虫活力下降, 主要表现为伸缩能力下降。
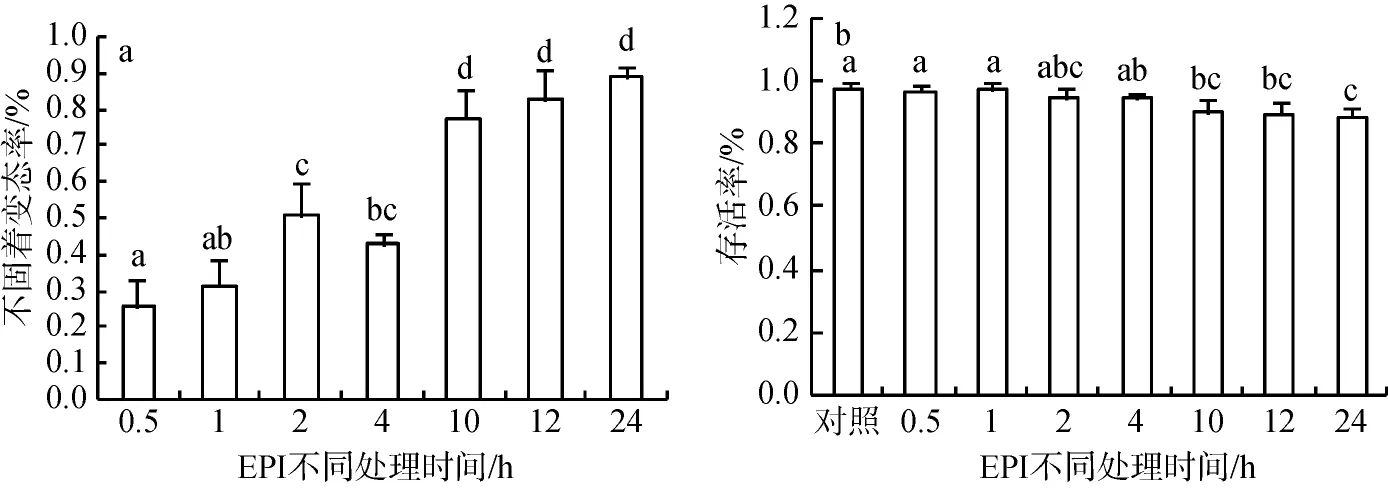
图4 葡萄牙牡蛎眼点幼虫经5×10–4mol/L EPI处理的不固着变态率(a)和存活率(b)Fig.4 Metamorphic (a) and survival (b) rates for Crassostrea angulata eyed-larvae exposed to 5 × 10−4mol/L epinephrine (EPI)
2.2.2 长牡蛎
本实验用5×10–5mol/L EPI 对长牡蛎眼点幼虫分别处理0.5、1、2、4、8、12 h, 药物过滤后8 h测定。根据幼虫的变态情况发现, EPI 处理后2 h内,幼虫变态率快速增加, 此后继续上升, 但上升的趋势减缓, 8 h处理组的变态率最高, 达到56.8%(图5 a)。
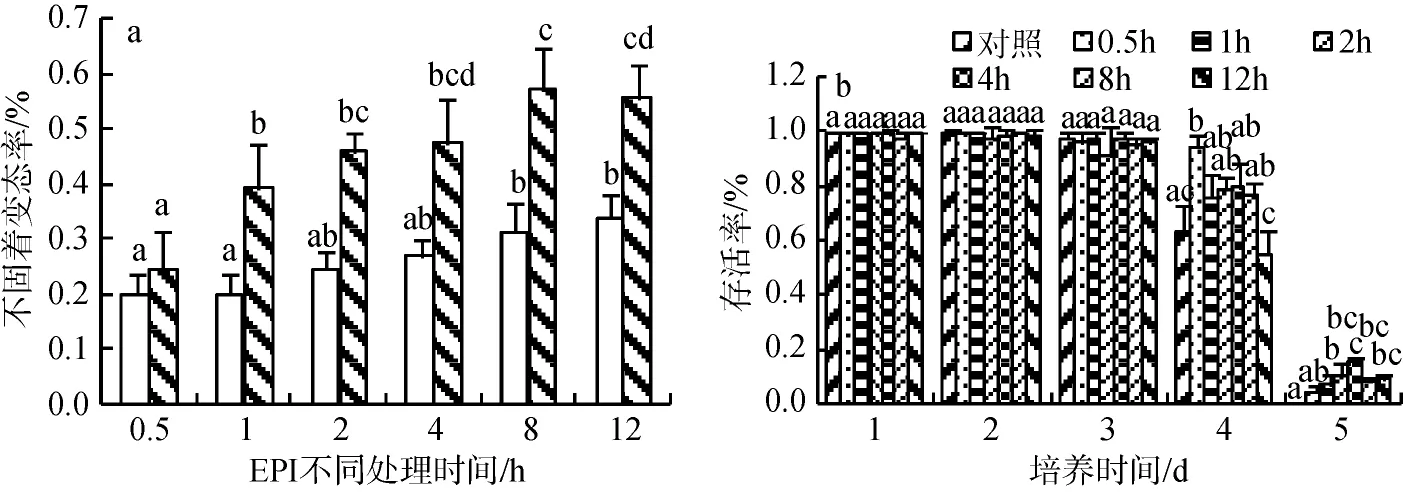
图5 长牡蛎眼点幼虫经5×10–5mol/L EPI处理的不固着变态率(a)和存活率(b)Fig.5 Metamorphic (a) and survival (b) rates for Crassostrea gigas eyed-larvae exposed to 5 × 10−5mol/L epinephrine (EPI)
对不同时间梯度长牡蛎幼虫进行后续生长测定,测定幼虫的壳长、壳高和存活率。前3 d各处理组90%以上存活; 第四天0.5 h处理组存活率最高, 90%以上存活, 12 h处理组和对照组50%以上存活, 其余各处理组70%以上存活; 第五天对照组的幼虫基本死亡, 2和4 h处理组15%以上存活, 其余各处理组10%以下存活且存活的都是有明显次生壳的大个体(图5 b)。幼虫的壳长、壳高前两天变化不明显, 第二天后, 药物处理组的壳长、壳高始终高于对照组,处理2 h后的壳长、壳高变化趋势不明显。综合各因素, EPI的最佳处理时间为8 h(图6)。
2.3 不同密度梯度诱导产生单体牡蛎
思维品质是指个体在思维活动中智力特征的表现,也就是人与人之间的思维活动上表现的差异。培养学生用英语思维是英语教学重要目标,在教学的同时优化思维品质也是教学任务之一,但思维品质的培养不能一蹴而就的,需要教师创造性的设计多样化的教学活动。开放性问题、智力游戏问题、探索性问题是别出心裁、创意新、情景实、思维价值高的一类新题型,它们具有开发智力、激活思维、增加创新能力的潜在功能。这类问题的出现,为学生创设了一个崭新的英语情景。给学生以再发现、再创造的思维空间。为此,课堂教学中,教师的提问,学生的练习,都要设计编拟一些思维活、立意新、探索性强的问题,促使学生思维开放。
本实验用5×10–5mol/L EPI 对5、10、20、50、80个/mL长牡蛎眼点幼虫处理8 h, 药物过滤后8 h测定。根据幼虫变态情况发现, 各密度梯度的幼虫变态率相差不明显, 20个/mL 处理组的变态率最高,达到52.1%(图7 a)。
对不同密度梯度长牡蛎幼虫进行后续生长测定,测定幼虫的壳长、壳高和存活率。前3 d各处理组90%以上存活; 第四天5和10个/mL处理组存活率最高, 50%以上存活, 20和50个/mL处理组20%以上存活, 80个/mL处理组基本死亡; 第五天80个/mL处理组的幼虫全部死亡, 20和50个/mL处理组5%以下存活, 5和10个/mL处理组10%以上存活且存活的都是有明显次生壳的大个体(图7 b)。幼虫的壳长、壳高前3 d变化不明显, 第四天, 5和10个/mL处理组的壳长、壳高明显高于其他组, 第五天, 5个/mL处理组的壳长、壳高最大。综合各因素, 幼虫密度在80个/mL以下EPI的处理效果无显著性差异, 但最适培养密度为5~10个/mL(图8)。

图6 不同时间处理梯度的长牡蛎幼虫壳长(a)、壳高(b)变化Fig.6 Changes in the shell length (a) and shell height (b) of Crassostrea gigas larvae exposed to epinephrine (EPI) for different lengths of time
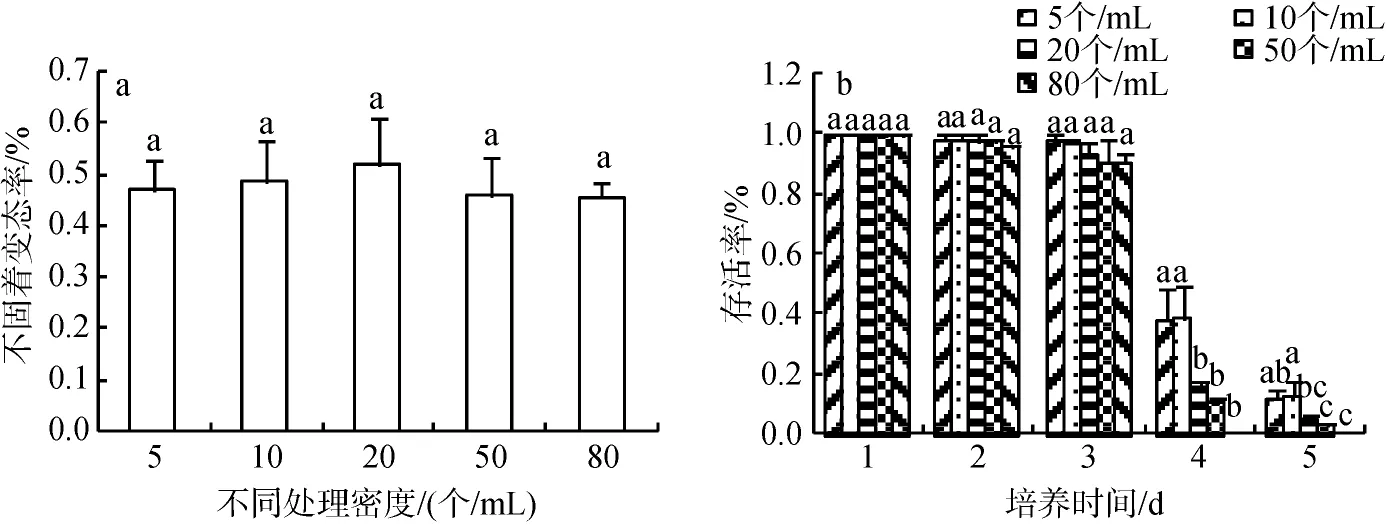
图7 长牡蛎不同幼虫密度经5×10–5mol/L EPI处理8h的不固着变态率(a)和存活率(b)Fig.7 Metamorphic (a) and survival (b) rates for Crassostrea angulata eyed-larvae maintained at different densities and exposed to 5 × 10–5mol/L epinephrine (EPI) for 8 h
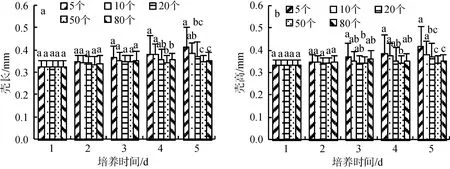
图8 不同幼虫密度梯度长牡蛎幼虫壳长(a)、壳高(b)变化Fig.8 Changes in the shell length (a) and shell height (b) of Crassostrea gigas larvae maintained at different densities
3 讨论
3.1 单体牡蛎诱导变态的EPI浓度、处理时间和幼虫密度结果分析
本文与当前国内外用EPI诱导产生单体牡蛎的研究结果比较见表1, 本文中的实验材料为葡萄牙牡蛎和长牡蛎眼点幼虫, Huvet等[21]认为葡萄牙牡蛎与长牡蛎形态相似, 但属于不同的亚种, 最新的16SrRNA研究表明葡萄牙牡蛎与僧帽牡蛎属于同一个种。本实验中葡萄牙牡蛎和长牡蛎最适EPI浓度差异显著, 其中葡萄牙牡蛎最适EPI浓度偏高,1×10–4mol/L EPI诱导的不固着变态率仅为30.1%;长牡蛎的最适EPI浓度偏低, 1×10–4和5×10–5mol/L EPI诱导的不固着变态率分别为54.5%和53.2%。可能的原因是幼虫的养殖环境和生长不同步的差异。可能葡萄牙牡蛎受EPI的诱导作用没有长牡蛎敏感,需要更高的浓度或者更长的诱导时间才能起到相同的作用, 可以通过多因素控制变量法更准确测定最佳EPI浓度和最佳EPI处理时间。其次, 尽管本实验用100目的筛绢进行多次筛选, 依旧难以保证幼虫处于同步生长阶段, 而EPI只能诱导即将变态的幼虫。此外, 盐度、幼虫密度以及阳离子浓度也可能影响牡蛎眼点幼虫的变态, 柯才焕等[16]发现僧帽牡蛎对低盐的适应能力强, 对高盐的适应能力弱,祁剑飞等[14]发现K+和Ca2+是葡萄牙牡蛎幼虫附着变态的有效诱导剂。李华琳等[22]发现6~8个/mL幼虫的生长速度快、同步性好, 10个/mL幼虫生长速度缓慢。
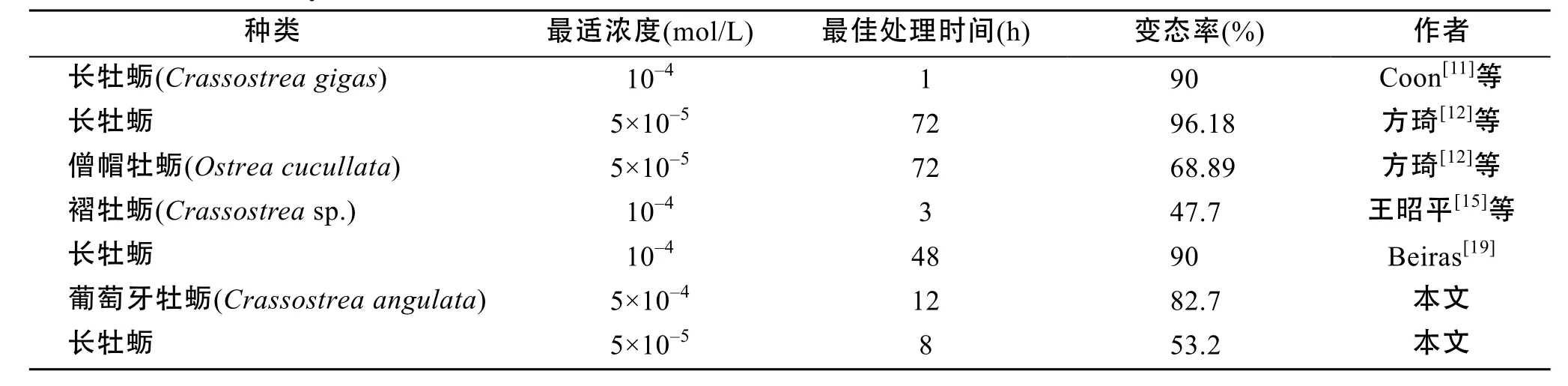
表1 用EPI诱导产生单体牡蛎的研究结果比较Tab.1 The effect of different concentrations and exposure times of epinephrine (EPI) on the induction of metamorphosis in cultchless oysters
密度梯度实验结果表明EPI对低于80个/mL幼虫密度的诱导效果差异不明显, 但不同幼虫密度的处理组后期壳长、壳高差异显著, 可能的原因是幼虫培养密度过大而限制了幼虫的生长。Coon等[11]提出即使幼虫密度在150个/mL以上也不影响EPI的诱导作用, 也验证了在一定范围内, EPI对于高幼虫密度和低幼虫密度的诱导效果无明显差异。因此, 在大批量处理时可以提高幼虫密度, 但在幼虫培养期间,要严格控制幼虫密度。
3.2 单体牡蛎诱导变态的后续生长测定结果分析
此外, 第五天不仅处理组的存活率高于对照组且存活的都是有明显次生壳的大个体, 处理组的壳长、壳高也明显高于对照组。可能原因是EPI除了能诱导牡蛎幼虫不固着变态外, 还能加速牡蛎幼虫变态长出次生壳, 有明显次生壳的个体的生存能力要强于无次生壳的个体。
3.3 单体牡蛎诱导变态方法的缺陷及改进
Coon 等[18]证实了幼虫附着和变态由两个独立的生理机制控制的, EPI能作用于α1-肾上腺素受体,只诱导幼虫发生变态, 对幼虫的附着行为无作用。经EPI作用后, 幼虫会快速沉到底部, 本实验对幼虫进行充气, 发现幼虫依旧沉到底部, 由于幼虫之间的相互挤压而限制彼此的运动, 对取样和不固着变态率的观察都造成一定的影响。其次, 药物经过滤除去后, 幼虫可能对诱导环境的变化有一定的滞后性, 需要适应一段时间才能恢复活力, 这些幼虫只是受到药物的影响而并未发生变态。因此, 鉴于葡萄牙牡蛎实验的不足, 作者在长牡蛎实验中进行了改进, 在过滤除去EPI 8h后再进行不固着变态率的测定。从不同时间梯度实验的对照组中发现,8h对未经EPI处理的幼虫不固着变态率的影响不显著。
[1] 农业部渔业局. 中国渔业年鉴[M]. 北京: 中国农业出版社, 2013. Ministry of Agriculture, Bureau of Fisheries. China fishry statistical yearbook[M]. Beijing: China Agriculture Press, 2013.
[2] FAO. Fishery and aquaculture statistics[M]. Fao Inter Departmental Wor: FAO Yearbook, 2012.
[3] 王华青, 张志杨, 梁和平. 单体葡萄牙牡蛎筏式笼养试验[J]. 中国水产, 2014, 2: 70-71. Wang Huaqing, Zhang Zhiyang, Liang Heping. Raft cage test of cultchless Crassostrea angulata[J]. China Fisheries, 2014, 2: 70-71.
[4] 於俊琦, 陈琛, 冀德伟, 等. 高效生态循环养殖系统中的葡萄牙牡蛎单体养殖试验[J]. 海水养殖, 2013:41-42. Yu Junqi, Chen chen, Ji Dewei, et al. Cultivated test of cultchless Crassostrea angulata under efficient ecological recirculating system[J]. Mariculture, 2013:41-42.
[5] 李石磊, 常亚青, 宋坚, 等. 北方海区单体牡蛎分段式养殖方法研究[J]. 水产科学, 2013, 32(4): 201-204. Li Shilei, Chang Yaqing, Song Jian, et al. Cultchless oyster culture by step in North China Sea[J]. Fisheries Science, 2013, 32(4): 201-204.
[6] 张涛, 阙华勇, 盖明礼, 等. 化学物质对墨西哥湾扇贝幼虫变态的诱导[J]. 动物学杂志, 2003, 38(4): 66-71. Zhang Tao, Que Huayong, Gai Mingli, et al. Induction of metamorphosis of the southern bay scallop Argopecten irradians concentricus larvae by chemical cues[J]. Chinese Journal of Zoology, 2003, 38(4):66-71.
[7] 张涛, 杨红生, 周毅, 等. 化学物质对硬壳蛤幼虫变态的诱导[J]. 海洋科学, 2005, 29(12): 59-67. Zhang Tao, Yang Hongsheng, Zhou Yi, et al. Induction of metamorphosis of the hard clam Mercenaria mercenaria larvae by chemical cues[J]. Marine Sciences,2005, 29(12): 59-67.
[8] 杨金龙, 李一峰, 沈和定, 等. 化学物质诱导变态后紫贻贝稚贝的生长及存活[J]. 海洋科学, 2009, 33(10):92-96. Yang Jinlong, Li Yifeng, Shen Heding, et al. Growth and survival of the mussel Mytilus galloprovincialis post-larvae metamorphosed using different chemical compounds as inducers[J]. Marine Sciences, 2009,33(10): 92-96.
[9] 杨爱国, 牛锡端, 沈决奋, 等. 太平洋单体苗种培育技术的研究[J]. 海洋科学, 1993, 17(2): 7-10. Yang Aiguo, Niu Xiduan, Shen Juefen, et al. Study on cultivated techniques of cultchless spat of pacific oyster Crassostrea gigas[J]. Marine Sciences, 1993, 17(2):7-10.
[10] 杨爱国, 牛锡端, 沈决奋, 等. 太平洋牡蛎单体苗种生产和养殖技术的研究[J]. 中国水产科学, 1995, 2(3):29-34. Yang Aiguo, Niu Xiduan, Shen Juefen, et al. Study on cultchless spat and culture techniques of pacific oyster Crassostrea gigas[J]. China Fisheries Science, 1995,2(3): 29-34.
[11] Coon S L , Bonar D B, Weiner R M. Chemical production of cultchless oyster spat using epinephrine and norepinephrine[J]. Aquaculture, 1986, 58: 255-262.
[12] 方琦, 林笔水, 方永强. 几种化学物质对两种牡蛎幼虫附着和变态的诱导[J]. 台湾海峡, 2001, 20(1):20-25. Fang Qi, Lin Bishui, Fang Yongqiang. Induction of larval settlement and metamorphosis of two oysters Crassostrea gigas and Ostrea cucullata by some chemicals[J]. Journal of Oceanograhpy In TaiWan Strait, 2001, 20(1): 20-25.
[13] 吕晓燕. 熊本牡蛎人工繁育与长牡蛎单体苗种培养技术研究[D].青岛: 中国海洋大学, 2013. Lü Xiaoyan. Studies on the techniques of artificial reproduction of the Crassostrea sikamae and cultivation of the cultchless spat of Crassostrea gigas[D]. Qingdao:Ocean University of China, 2013.
[14] 祁剑飞, 曾志南, 宋传福, 等. 几种阳离子对葡萄牙牡蛎幼虫附着和变态的影响[J]. 福建水产, 2013,35(1): 27-31. Qi Jianfei, Zeng Zhinan, Song Chuanfu, et al. Effect of positive ion on settlement and metamorphosis in Portuguese oyster (Crassostrea angulata) larvae [J]. Journal of Fujian Fisheries, 2013, 35(1): 27-31.
[15] 王昭萍, 王如才, 徐从先, 等. 单体褶牡蛎(Crassostrea sp.)的研究[J]. 青岛海洋大学学报, 1992, 22(2):125-132. Wang Zhaoping, Wang Rucai, Xu Congxian, et al. Studies on cultchless oyster, Crasssostrea sp. [J]. Journal Of Ocean University of Qingdao, 1992, 22(2):125-132.
[16] 柯才焕, 李少菁, 李复雪, 等. 僧帽牡蛎幼体附着和变态的诱导[J]. 水产学报, 2000, 24(3): 230-234. Ke Caihuan, Li Shaojing, Li Fuxue, et al. Induction of settlement and metamorphosis of Saccostrea cucullata larvae[J]. Journal of Fisheries of China, 2000, 24(3):230-234.
[17] 张涛, 阙华勇. 延迟变态对海洋无脊椎动物生长发育的影响[J]. 海洋科学, 2001, 26(5): 28-30. Zhang Tao, Que Huayong. The effects of delayed metamorphosis on growthed and development of invertebrates[J]. Marine Sciences, 2001, 26(5): 28-30.
[18] Coon S L, Walch M, Fitt W K, et al.Competence and delay of metamorphosis in the Pacific oyster Crassostrea gigas [J]. Marine Biology, 1990, 106: 379-387.
[19] Beiras R, Widdows J. Induction of metamorphosis in larvae of the oyster Crassostrea gigas using neuroactive compounds[J]. Marine Biology, 1995, 123: 327-334.
[20] Fitt W K , Coon S L, Walch M, et al.Settlement behavior and metamorphosis of oyster larvae (Crassostrea gigas) in response to bacterial supernatants[J]. Marine Biology, 1990, 106: 389-394.
[21] Huvet A, Lapegue S, Magoulas A, et al. Mitochondrial and nuclear DNA phylogeography of Crassostrea angulata, the Portuguese oyster endangered inEurope[J]. Conservation Genetics, 2000, 1: 251-262.
[22] 李华琳, 李文姬. 影响太平洋牡蛎浮游幼虫生长差异的原因浅析[J]. 水产科学, 2006, 25(1): 48-49. Li Hualin, Li Wenji. Primary reasons of growth variation of the planktonic larvae of oyster (Crassostrea gigas) [J]. Fisheries Science, 2006, 25(1): 48-49.
[23] 王昭萍, 王如才, 徐从先, 等. 长牡蛎幼虫固着习性的研究[M]. 青岛: 青岛海洋大学出版社, 1995: 121-126. Wang Zhaoping, Wang Rucai, Xu Congxian, et al. Studies on larval settlement of oyster Crassostrea gigas[M]. Qingdao: Qingdao Ocean University Press,1995: 121-126.
[24] 林志华, 柴雪良, 牟哲松, 等. 太平洋牡蛎三倍体苗种的生产技术[J]. 宁波大学学报, 2001, 14(2): 31-37. Lin Zhihua, Chai Xueliang, Mou Zhesong, et al. Study on seedling production of triploid oyster Crassostrea gigas[J]. Journal of Ningbo University, 2001, 14(2):31-37.
(本文编辑: 谭雪静)
The induction of metamorphosis in cultchless oysters (Crassostrea angulata and Crassostrea gigas)
CHEN Heng1, FANG Jun2, 3, 4, TENG Shuang-shuang2, 3, 4, XIAO Guo-qiang2, 3, 4,ZHANG Jiong-ming2, 3, 4, CHAI Xue-liang1, 2, 3, 4
(1. School of Laboratory Medicine and Life Science, WenZhou Medical University, Wenzhou 325035, China;2. Zhejiang Mariculture Research Institute, Wenzhou 325005, China; 3. Zhejiang Key Laboratory of Exploitation and Preservation of Coastal Bio-resource, Wenzhou 325005, China; 4. Engineering Research Center for Marine Bivalves, Chinese Academy of Fishery Sciences, Wenzhou 325005, China)
Aug., 3, 2014
Crassostrea angulata; Crassostrea gigas; cultchless oyster; metamorphosis without settlement
To obtain cultchless oysters with a regular shell shape and uniform size, epinephrine (EPI) was applied to Crassostrea angulata and Crassostrea gigas eye-larvae to induce cultchless metamorphosis. We examined the effect of larval density, concentration of EPI, and length of exposure to EPI to determine optimum levels for each species. For C. angulata, we found that the optimum concentration of EPI was 5×10−4mol/L for a 24 h treatment (metamorphic rate = 72.8%) and the optimum treatment time at this concentration was 12 h (metamorphic rate = 82.7%). In contrast, in C. gigas, the optimum concentration of EPI was 5×10−5mol/L over 6 h (metamorphic rate = 53.2%), and the optimum treatment time at this concentration was 8 h (maximum metamorphic rate = 56.8%). However, there was no significant difference between EPI treatments at larval densities < 80 individuals/mL. The growth of C. gigas was also determined over the following days, which showed that shell length, shell height, and larval survival rate was higher in the treated groups than those in the control groups. Therefore, EPI can facilitate larval metamorphosis and improve their survival ability.
S968. 3
A
1000-3096(2016)01-0010-08
10.11759//hykx20140803003
2014-08-03;
2015-03-06
温州市水产增养殖技术创新团队项目(C20120004-3); 国家贝类产业技术体系试验站项目(CARS-48); 水产种质资源平台运行服务项目(2014DKA30470); 浙江省科技计划项目(2013F50016)
陈亨(1990-), 男, 浙江温州人, 主要从事贝类遗传育种研究, 电话: 13575448171, E-mail: chenheng0530@163.com; 柴雪良, 通信作者, 电话: 13587969015, E-mail: cxl-5888@163.com

