高致病性猪蓝耳病自然病例血清致炎因子IL-1、IL-6和TNF-α含量的测定与分析
李建臻,杨 苗,徐 刚(.成都农业科技职业学院,四川成都 630;.四川出入境检验检疫局,四川成都 630)
高致病性猪蓝耳病自然病例血清致炎因子IL-1、IL-6和TNF-α含量的测定与分析
李建臻1,杨 苗2,徐 刚1
(1.成都农业科技职业学院,四川成都 611130;2.四川出入境检验检疫局,四川成都 611130)
摘 要:本试验旨在探究高致病性蓝耳病(HP-PRRS)自然病例中致炎因子IL-1、IL-6和TNF-α含量,进而阐述HP-PRRS的致病机理,为养殖生产中的HP-PRRS防控提供理论基础。在成都地区4个发病猪场采集具有临床症状的猪血清(含5头濒死猪)35份与无临床症状猪血清23份,利用RT-PCR分别检测出HP-PRRSV阳性血清25份和11份。将检测出阳性表现症状的25份血清、检测阳性无临床症状的11份血清及检测阴性的12份血清分成3组,分别标注为病猪组、隐性感染组和健康对照组,运用ELISA方法进行IL-1、IL-6和TNF-α含量测定。结果显示,IL-1含量在三组中差异极显著(P<0.01),病猪组极显著高于隐性感染组与健康组(P<0.01),隐性感染组与健康对照组差异不显著(P>0.05);IL-6含量在三组中差异显著(P<0.05),病猪组显著高于隐性感染组与健康对照组(P<0.05),隐性感染组与健康对照组差异不显著(P>0.05);TNF-α含量在三组之间无显著差异(P>0.05)。该结果表明IL-1与IL-6在HP-PRRS感染致病中具有重要作用。
关键词:高致病性蓝耳病;自然病例;IL-1;IL-6;TNF-α
蓝耳病是猪繁殖与呼吸综合征(PRRS)的俗称。1996年郭宝清等首次从国内发病猪群中分离出猪蓝耳病病毒(PRRSV)。2006年我国很多地区暴发了“无名高热”病,经中国农业科学院哈尔滨兽医研究所分离和鉴定,证实其病原主要是高致病性蓝耳病变异株(HP-PRRSV)。HP-PRRSV的出现给我国养猪业带来了非常大的损失,已成为当今猪场危害最大的病原之一[1-3]。已有资料表明,PRRSV所造成的病理学特点主要是弥漫性肺泡损害,表现为以肺泡和肺间质巨噬细胞明显增多为主的肺部病变、免疫器官损伤、全身性血管炎与继发感染等。急性呼吸窘迫综合征(acuterespiratory distress syndrome,ARDS)是导致病猪死亡的主要原因,其中致炎因子是很重要的因素。IL-1、IL-6 与TNF-α等致炎细胞因子,在感染条件下,如果过量表达,就会引起生物体某些组织器官的损伤[4]。为探索猪血清中IL-1、IL-6与TNF-α含量与自然感染PRRSV的关系,在成都地区的4个自然发病猪场开展了猪血清中致炎因子含量测定试验,期望为PRRSV致病机制研究提供理论材料,以帮助寻求有效控制炎症反应、减轻PRRS临床危害的方法。
1 试验材料
1.1试验样本
本研究所用实验样本来自2014年3月至2015 年3月的4个猪场,共58份,其中有明显临床症状的35份,无明显临床症状的23份。
1.2试剂与药品
Pig-TNF-α检测试剂盒(批号:15-01)、Pig-IL-1检测试剂盒(批号:15-02)、Pig-IL-6检测试剂盒(批号:15-01)均购自成都丹凤生物科技有限公司;TRIZOL购自上海生工;TaKaRa RNA PCR Kit(AMV))Ver. 3.0购自大连宝生物公司。
1.3引物
诊断高致病性蓝耳病与低致病性蓝耳病RTPCR引物:参考涂长春教授惠赠设计(扩增片段高致病性蓝耳病180 bp;低致病性蓝耳病270 bp)。
1.4主要仪器
DKB-501 A型 凝 胶 成 像 系 统(Alpha Innotech);DNP-9163型稳压稳流电泳仪(北京六一);电热恒温培养箱(上海精宏);C1000普通梯度PCR仪器(Bio-Rad);微量移液器(德国Eppendorf);MILLI-Q超纯水纯化系统(Milliproe);680型酶标仪(BIORAD)。
2 试验方法
2.1RNA的提取与PRRSV抗原检测。
RT-PCR反应体系及条件参照西南大学荣昌校区生物技术中心实验室介绍方法[5]。反应结束后取5 uL PCR 产物在1.5%的琼脂糖凝胶上电泳,在凝胶成像系统上观察结果。
2.2IL-1、IL-6和TNF-α含量测定
选取HP-PRRSV抗原检测阳性的血清25份、隐性感染HP-PRRSV(无临床症状,但RT-PCR检测阳性)的血清11份和健康猪血清12份,运用ELISA方法进行IL-1、IL-6和TNF-α含量测定。检测方法按照试剂盒说明进行,在450 nm波长测定OD值,绘制标准曲线并使用标准曲线计算各细胞因子含量。
2.3试验数据分析
采用Excel 2007软件进行数据整理,采用SPSS 16.0软件对IL-1、IL-6和TNF-α含量测定数据运用统计学方法进行方差分析。
3 结果
3.1病原检测结果
高致病性蓝耳病病原检测结果见表1,样品PCR产物在琼脂糖凝胶上的电泳图见图1。
由表1和图1并结合临床症状与病例解剖结果可知,4个养猪场均暴发了高致病性蓝耳病疫情,病毒感染阳性率均超过50%,并存在隐性感染、不表现临床症状的猪。
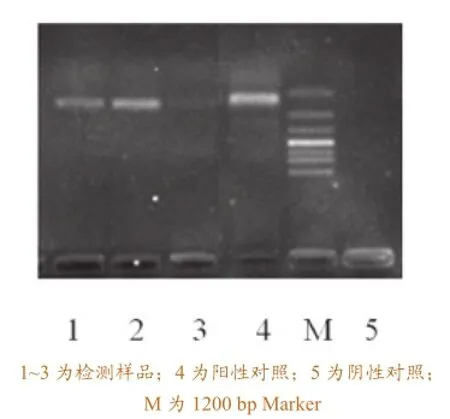
图1 部分HP-PRRSV RT-PCR产物在琼脂糖凝胶上的电泳图
3.2IL-1、IL-6与TNF-α标准曲线
按照TNF-α ELISA试剂盒说明书操作,标准样品浓度为640 pg/mL,倍比稀释后,测定A450OD值(表2),绘制出标准曲线(图2)。计算TNF-α浓度与A450OD值,相关公式为:y=817.4x-14.20;计算IL-1浓度与A450OD值,相关公式为:y=729.3x-52.76;计算IL-6浓度与A450OD值,相关公式为:y=827.5x-21.33。
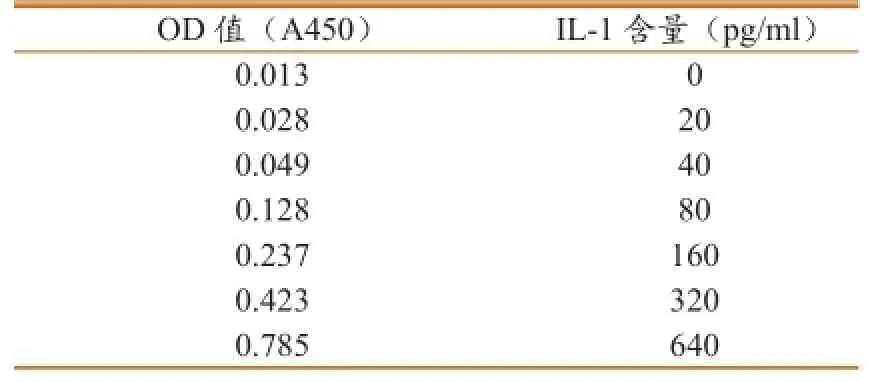
表2 ELISA检测猪TNF-α标准样品结果
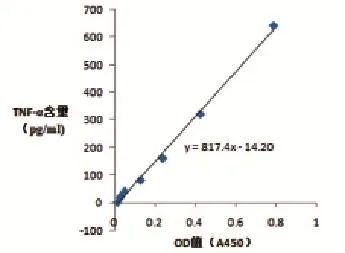
图2 TNF-α浓度测定标准曲线
3.3IL-1、IL-6与TNF-α检测结果
将临床发病组、隐性感染组、健康组的血清分别使用检测试剂盒测出OD值带入分别标准公式测得每组平均数值(表3)。
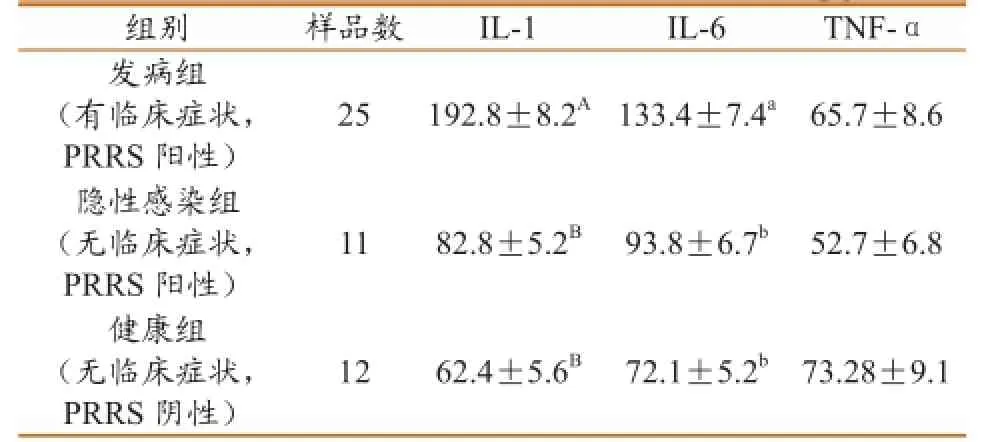
表3 IL-1、IL-6与TNF-α检测含量结果统计(pg/ml)
发病组、隐性感染组、健康组的IL-1含量差异极显著(P<0.01),多重比较显示发病组极显著高于健康组与隐性感染组(P<0.01),而健康组与隐性感染组之间差异不显著(P>0.05);发病组、隐性感染组、健康组IL-6含量差异显著(P<0.05),多重比较显示,发病组显著高于健康组与隐性感染组(P<0.05),而发病组与隐性感染组之间差异不显著(P>0.05);TNF-α含量检测三组差异不显著(P>0.05),数值显示健康组略高于发病组与隐性感染组。
4 分析与讨论
4.1病原检测结果的分析与讨论
高致病性蓝耳病是目前养猪生产中危害严重的传染病之一,给我国养猪业造成了巨大的经济损失。本试验选择的4个自然发病猪场的HPPRRSV感染率均在50%以上,表明该地区主要流行变异PRRSV,但在疑似阳性血清中的检出率低于80%,说明PRRSV感染后的临床症状、病理变化复杂多变。
4.2IL-1、IL-6与TNF-α检测结果的分析与讨论
据文献报道,促炎性细胞因子具有两面性:正常条件下可以促使白细胞数量增加、诱发免疫反应以及减少病毒复制,但在某些感染条件下的过量表达,会引起生物体某些组织器官的损伤[6](血管渗透性增加,导致肺水肿和支气管收缩)。研究显示感染猪体内的细胞因子(包括γ-IFN、IL-1、IL-6、IL-10、IL-12、TNF-α)含量均升高[7-13]。《猪病学》第九版指出,PRRSV感染后,致炎因子(IL-1、IL-6、TNF-α)能促进白细胞聚集和活化,增加毛细血管的渗透性(肺水肿)并诱导发热、厌食和精神沉郁等系统反应,引起支气管高反应性和收缩等哮喘样症状[14]。
本实验运用ELISA方法直接检测猪体外周血清中炎性细胞因子IL-1、IL-6与TNF-α含量,与以上学者研究方法不同,该方法更能反应三种炎性细胞因子在猪体内的真实水平。试验表明,表现临床症状的病猪血清中IL-1与IL-6含量明显高于隐性感染猪与健康猪,这是因为PRRS病例在病毒侵染协助下,猪体内IL-1与IL-6表达增高。试验中隐性感染组血清IL-1与IL-6含量与健康猪血清含量差异不显著,试验者认为隐性感染猪可能处于感染早期,并未达到最高水平,因此未引起致炎因子升高,从而未能表现出临床症状。
TNF-α含量在本次试验中差异不显著,分析原因可能是:研究方法不同,本试验直接检测血清中TNF-α含量;检测时间不同,本试验采集样本全部为自然发病病例,HP-PRRS感染具体时间难以确定,而TNF-α在体内含量随时间而变化[15]..
5 结论
本试验发现猪感染HP-PRRSV后,其体内的IL-1与IL-6含量会显著增高,提示其过量表达在造成肺部病变、免疫器官损伤、全身性血管炎和继发感染中扮演重要角色。
参考文献:
[1]杨汉春,管山红,尹晓敏,等. 猪繁殖与呼吸综合征病毒的分离与初步鉴定[J].中国兽医杂志,1997,23(10): 9-l0.
[2]杨汉春. 我国新发猪病的流行现状与防控的科学问题[C]//中国畜牧兽医学会2011年学术年会.中国畜牧兽医学会2011年学术年会论文集. 成都:中国畜牧兽医学会2011年学术年会,2011:69.
[3]陆桂丽,张天舒,成进,等. 猪繁殖与呼吸综合征母源抗体监测与消长水平分析[J].中国动物检疫,2014,31(6):65-67.
[4]Thanawongnuwech R,Rungsipipat A,Disatian S,et al.Immunohistochemical staining of IFN -gam- Ma positive cells in porcine reproductive and respiratorys yndromevirus infectedlungs[J]. Vethnmunol Immunopatho1,2003,91(1):73-77.
[5] 李建臻,黄伟,王顺平. 四川某规模化猪场病原与抗体检测及分析[J].中国动物检疫,2009(7):58-61.
[6]Wu W H,Fang Y,Farwell R.,et al. A 10-Ku structural protein of porcine reproductive and respiratory syndrome virusencoded-by ORF2b[J]. Virology,2001,287:183-191.
[7]Choi C,Chae C. Expression of tumour necrosis factor-alpha is associated with apoptosis in Lun -gs of pigs experimentally inoculated with porcine reproductive and respiratory syn -drome virus [J]. ResVet Sci,2002a,72(1):45-49.
[8]Lopez F L,Campos E,Domenech N,et al. Porcine reproductive and respiratory syndrom -evirus down-modulates TNF-αlpha production in infected macrophages[J].Virus Res,2000,69(1):41-46.
[9]Aasted B,Bach P,Nielsen J,et al.Cytokine profiles in peripheral blood mononuclear cells And lymph node cells from piglets infected in utero with porcine reproductive and respiratory syndro-me evirus[J].Clin Diagn Lab Immuno1,2002,9 (6):1229-1234.
[10]Van G S,Van R K,Pensaert M. Interaction between porcine reproductive and respiratory syndrome virus and bacterial endotoxin in the lungs of pigs potentiation of cytokine production And respiratory disease[J],J Clin Microbiol,2003,41(3):960-966.
[11]Van reeth K,Labapque G,Nauwynck H,et al.Differential of proinflammatory cytokines in the pig lung during different respiratory virus infections:correlations with pathogenicity[J]. Res VetSie,1999,67(1):47-52.
[12]Labapque G,Van G S,Nauwynck H,et al. Apoptosia in the lungs of pigs infected with por -cine reproductive and respiratory syndrome virus and associations with the production of Apopto -genic cytokines[J]. Vet Res,2003,34(3):249-260.
[13]梅林. PRRSV免疫与实验感染猪血清细胞因子变化规律的研究[D]. 长春:吉林大学,2012.
[14]Straw B E,Zimmerman J J,Allaire S D,et al. 猪病学[M].赵德明,张仲秋,沈建忠,等译. 第九版. 北京:中国农业大学出版社,2008:429-431.
[15]施开创,杨汉春,郭鑫. 猪繁殖与呼吸综合征病毒和猪圆环病毒2 型共感染对外周血单个核细胞促炎细胞因子mRNA表达的影响[J]. 畜牧兽医学报,2009,40(3):363-370.
(责任编辑:朱迪国)
中图分类号:S851.3
文献标识码:B
文章编号:1005-944X(2016)01-0067-04
通讯作者:杨 苗
Detection and Analysis of IL-1、IL-6 and TNF-α in Sera of Natural HP-PRRS Infected Pigs
Li Jianzhen1,Yang Miao2,Xu Gang1
(1. Chengdu Agricultural Science and Technology Vocational College,Chengdu,Sichuan 611130;2. Sichuan Entry Exit Inspection and Quarantine Bureau,Chengdu,Sichuan 611130)
Abstract:To fi nd the relationship among IL-1、IL-6、TNF-α content in blood sera of HP-PRRSV infected pigs,so to explain the pathogenesis of HP-PRRS,and to provide a theoretical basis for the prevention and control of HP-PRRS,48 blood sera samples from 4 farms in Chengdu were sampled and tested by ELISA,including 25 RT-PCR positive samples with clinical symptoms and 11 positive samples without clinical symptoms and 12 negative samples. The results showed that the difference of IL-1 in positive pigs was signifi cant(P<0.01) compared with the other two groups,and the differences of IL-1 between the other two groups were not signifi cant (P>0.01) . The differences of IL-6 levels among the three groups were signifi cant(P<0.05),and IL-6 in positive samples with clinical symptoms were higher(P<0.05)than the other two groups. The differences of of IL-6 in the other two groups with negative results were not signifi cant(P >0.05). The differences of TNF-α among the three groups were not signifi cant(P>0.05). These results showed that IL-1and IL-6 increased in blood serum when pigs were infected by HP-PRRSV and played important role in infection,while TNF-α has little change.
Key words:HP-PRRS;natural infection;IL-1;IL-6;TNF-α

