不同磷源对米氏凯伦藻生长和碱性磷酸酶活性的影响
庞 勇,聂 瑞,吕颂辉
(1. 海南省海洋与渔业科学院,海口 海南 570125; 2. 海南省海洋监测预报中心,海口 海南 570206; 3. 暨南大学 赤潮与海洋生物学研究中心,广州 广东 510632)
不同磷源对米氏凯伦藻生长和碱性磷酸酶活性的影响
庞 勇1,3,聂 瑞2,3,吕颂辉3
(1. 海南省海洋与渔业科学院,海口 海南 570125; 2. 海南省海洋监测预报中心,海口 海南 570206; 3. 暨南大学 赤潮与海洋生物学研究中心,广州 广东 510632)
摘要:为了解米氏凯伦藻(Karenia mikimotoi)赤潮形成的磷营养机理,作者研究了不同磷源[三磷酸腺苷二钠盐(Adenosine disodium triphosphate,ATP)、甘油磷酸钠(sodium glycerophosphate,G-P)、卵磷脂(lecthin,LEC)和NaH2PO4·2H2O]对其生长和藻细胞碱性磷酸酶活性(alkaline phosphatase activity ,APA)的影响。结果表明: (1)米氏凯伦藻可以有效利用无机磷(NaH2PO4·2H2O),对有机磷源如三磷酸腺苷二钠盐(ATP)、甘油磷酸钠(G-P)也能有效利用,但不能有效利用卵磷脂(LEC); (2)米氏凯伦藻碱性磷酸酶的检测中,在起始阶段,不同磷源(ATP,G-P,LEC和NaH2PO4·2H2O)的米氏凯伦藻APA达到最大值,米氏凯伦藻的APA分别为 6.0,10.5,8.0和0.4 pmol/(个·h)。随培养时间的持续,各有机磷培养基中米氏凯伦藻的 APA均表现出先逐渐减小,而后增强,最后在最大值维持的趋势,而以 NaH2PO4·2H2O为磷源的米氏凯伦藻的APA没有明显的增加; (3)单个细胞的米氏凯伦藻的APA位点分布明显,大致位于细胞表面。通过研究发现,米氏凯伦藻在外界环境无机磷限制的条件下,能够较好地吸收利用有机磷维持生长,印证了近年来米氏凯伦藻赤潮频繁地发生在磷限制海域的事实。
关键词:米氏凯伦藻(Karenia mikimotoi Hansen); 有机磷; 碱性磷酸酶
米氏凯伦藻(Karenia mikimotoi Hansen)属于裸甲藻目(Gymnodiniales),凯伦藻属(Kerenia),能分泌溶血性毒素和鱼毒素,有溶解鱼类鳃组织细胞的作用。中毒鱼鳃出现鳃小叶上皮细胞增生、邻近鳃小叶黏连、上皮细胞脱落、鳃血管破裂、血细胞渗出等组织病理现象。鳃小叶作为鱼类呼吸系统的重要组成部位,一旦发生上述病变,必将影响到鳃的呼吸、分泌、排泄等功能,最终造成鱼类的死亡。米氏凯伦藻分布广泛,是近年来常见的赤潮生物,并且已经在澳大利亚、北欧各国、日本、新西兰、南美、北非、中国香港等地引发过赤潮灾害,造成了严重的渔业经济损失[1-2]。1998年3~4月份,中国大鹏湾、深圳湾、珠江口及内伶仃岛一带海域和香港海域发生的大规模米氏凯伦藻赤潮,导致深圳经济损失超过千万人民币,香港渔农损失超过 3亿港元[3-4]。可见,研究米氏凯伦藻的营养生理、了解米氏凯伦藻赤潮的形成规律,对于减少水产养殖业损失、保护海洋生态环境,有着重要的现实意义。
碱性磷酸酶(alkaline phosphatase,AP) 是参与藻细胞磷代谢和信号肽转导的一种胞外磷酸酶,也是目前研究最多、最重要的一种酶,其通过诱导方式产生,作用的底物范围很广,能水解以单磷酸脂为主的各式有机磷复合物。唐洪杰[5]等摸索了微藻中碱性磷酸酶活性的测定方法,为后来在微藻中碱性磷酸酶的研究提供了一定技术基础。而碱性磷酸酶活性的表达也会受环境介质的影响, 比如pH、金属离子等[6-7]。王丹[8]等对旋链角毛藻(Chaetoceros curvisetus)碱性磷酸酶的研究发现该藻能利用细胞内源磷库以补偿外源磷的降低对细胞生长的影响,在无机磷匮乏而有机磷丰富的环境内可以通过诱导碱性磷酸酶分解溶解态非活性磷获得生长所需的磷。欧林坚[9]等研究赤潮藻对无机磷源的竞争生长中发现,碱性磷酸酶在磷胁迫条件下大量表达,能够水解水体中的溶解态有机磷(DOP),可以有效利用代谢产生的有机磷源。
藻类对不同形态的有机磷源的利用率存在差异,
[Foundation: National Natural Science Foundation of China,No. U0733006;National Keystone Basic Research Program(973),No. 2010CB428702]
1 材料与方法
1.1 藻种来源及培养
实验所用米氏凯伦藻来至大亚湾海域,分离纯化后保存于暨南大学藻种库。
藻种采用f/2培养基,光照强度为5 000 lx,光暗比为12 h︰12 h,培养所用海水来至大亚湾,盐度为29.3。正式实验前需对米氏凯伦藻进行营养条件驯化,取生长指数期的藻种接种于低营养的培养基(NaH2PO4·2H2O为4 μmol/L的f/2培养基,其余组分及其浓度保持不变)中,每天检测培养基中的溶解性无机磷及藻细胞数目。当培养基中的溶解性无机磷的浓度低于仪器检出限,且藻细胞停止生长 3 d后,即认为该藻种已达到磷饥饿状态。
1.2 实验设置
以f/2培养基为基础,设计4个实验组,每个实验组准备容积为1 L的锥形瓶14个,添加的磷源分别为: 甘油磷酸钠(sodium glycerophosphate,G-P)、三磷酸腺苷(adenosine triphosphate,ATP)、卵磷脂(lecthin,LEC)以及无机态的正磷酸盐(NaH2PO4·2H2O)。起始磷源浓度大致为5.4 μmol/L,取不添加藻液的含有不同溶解有机磷源的培养瓶作为空白对照,检测实验过程中有机磷源的自然降解。分别接种驯化后处于磷饥饿条件下的米氏凯伦藻细胞于新的培养基中,隔天取样分析,检测各组磷源含量及AP活性和细胞数目,实验进行两个重复。
1.3 细胞计数和分析
藻细胞采用浮游植物计数框计数。自接种当天起,每2 d计数1次,得到单位培养液中的细胞数值。细胞的比生长速率(μ,d-1)根据公式μ = ( ln Nt- lnN0)/( t- t0)计算获得。其中N0、Nt分别表示单位水体藻类细胞的起始数量和经t天后的细胞数量,单位为个/mL。
1.4 磷源吸收测定
溶解态无机磷(dissolved inorganic phosphorus,DIP)采取磷钼蓝显色法在分光光度计下进行检测(Spectrum,722E)[11]。总溶解态磷(total dissolved phosphorus,TDP)与细胞颗粒磷(particulate phosphorus,PP)依据 Jeffries[12]的方法采用酸性过硫酸钾(K2S2O8)氧化法进行测定。样品在 115℃高压水解60~90 min,然后以DIP的方式进行处理。溶解态有机磷DOP=TDP-DIP。
1.5 碱性磷酸酶的提取及活性测定
Bulk-AP的提取采用荧光模拟底物测胞外酶,通过外加荧光模拟底物(FMS,即荧光显色团和酶的作用底物以共价键结合的化合物)的方法,活性的测定采用荧光分光光度计(Hitachi,F-4600PC)检测[13],Ex= 365 nm,Em= 455 nm,以4-甲基伞形酮磷酸酯(4-methyllumbelliferyl,4-MUP,Sigma)为水解底物荧光测定,以 4-甲基伞形酮(4-methyllumbelliferon,Sigma)制作标准曲线。在本实验中,采用滤膜过滤游离态APA(free APA,<0.22 μm)。将APA(pmol/ (L·h))数值除以单位水体的细胞数目,获得单位生物量的APA(pmol/(个·h))。
单个细胞的碱性磷酸酶活性的反应底物为酶标记荧光底物2-(5'-chloro-2'-phosphoryloxyphenyl-6-chloro-4-(3H) -quinazolinone),也叫做CPPCQ或ELF底物(Molecular Probes,Inc.,OR)。未反应的ELF底物为溶解态的并且不具有高荧光物质,当它与 AP酶反应时,释放出一个磷酸,并在酶活性的反应位点形成不溶性的黄绿色沉淀。准备无菌过滤海水,尽量轻柔地将细胞收集于微离心管中,并离心2 min(2 000~3 000 r/min),弃去上清液,向藻液加入1 mL 70%乙醇(若藻液较少,可减少加入量)[14]。在黑暗4℃下培养30 min,离心1 min,弃去上清液,向浓缩的藻液加入100 μL 的ELF反应液(5 μL母液+95 μL无菌海水),轻柔地混合均匀,在暗冷条件下培养1 h,离心1 min,弃去上清液,加入100 μL无菌海水。重复该步骤2~3次。将藻液最终收集于尽可能少的无菌过滤海水中,4℃冷藏、待用,取一定体积(约25 μL)的藻液于长波可通过的 DAPI滤光装置(Ex=365 nm±8 nm,Em>420 nm,紫光)观察细胞[15-16]。
2 结果与讨论
2.1 不同磷源下米氏凯伦藻的生长特征
与培养在无机磷源NaH2PO4·2H2O中作为对照的米氏凯伦藻生长相比较,在以 G-P、ATP有机物质为磷源的培养基中,米氏凯伦藻的生长状况良好(图1)。在NaH2PO4·2H2O的培养基中,米氏凯伦藻在实验的第 8天即基本进入稳定期,细胞数目最大可达9.005×103个/mL。在G-P和ATP的培养基中,米氏凯伦藻在第 9天进入稳定期,细胞最大数目分别可达到10.3×103和9.07×103个/mL。而在以LEC为磷源的培养基中,米氏凯伦藻细胞生长明显受到抑制,在实验后期死亡,说明该藻无法利用大分子的有机磷LEC维持生长。米氏凯伦藻的比生长速率变化见表1,采用NaH2PO4·2H2O、G-P、ATP为磷源培养的米氏凯伦藻的最大比生长率分别可达到0.55、0.56、0.68/d,平均比生长率分别为0.23、0.24、0.26/d,LEC细胞最后基本死亡,比生长率为负数。比较不同磷源对米氏凯伦藻生长的影响,发现以NaH2PO4·2H2O、G-P、ATP为磷源培养的米氏凯伦藻的细胞数目基本一致,且显著高于以LEC为磷源培养的情况(P<0.05),说明该藻对小分子有机磷和无机磷源的吸收利用效率相当,且显著高于大分子有机磷源。

图1 米氏凯伦藻在不同磷源培养下的细胞数目变化Fig. 1 Cell numbers of Karenia mikimotoi in batch culture with different phosphorus compounds

表1 米氏凯伦藻在不同磷源培养下的比生长速率Tab. 1 Specific growth rates of Karenia mikimotoi in batch culture with different phosphorus compounds
2.2 米氏凯伦藻对不同磷源的可利用性
在培养的前期,ATP、G-P和LEC的细胞颗粒磷的含量均较高,但是随着细胞数的变化,细胞颗粒磷有了新的变化,ATP和G-P随着细胞数的增加,从高浓度的细胞颗粒磷逐步减小,最后随着细胞数的稳定,细胞颗粒磷的浓度也趋于稳定,在 NaH2PO4·2H2O的培养中初期的细胞颗粒磷较低,随着细胞数的增加,细胞颗粒磷增加,说明在 NaH2PO4·2H2O培养中,外界无机磷源充足时,细胞内磷含量很高,而相应其他 3种有机磷培养液中细胞内的磷含量较低。
LEC培养的细胞颗粒磷先是增加,其后由于细胞数的死亡,细胞颗粒磷变为零,其他有机磷源(ATP、G-P)培养的细胞颗粒磷呈下降趋势,直到细胞数进入稳定期,才趋于平稳。
研究结果表明,米氏凯伦藻能够有效利用NaH2PO4·2H2O、ATP和G-P(图2a,2b)。实验起始阶段,GP培养基中因DOP水解使DIP含量有所增加,随后因被米氏凯伦藻大量摄取,DIP处于相对平缓的趋势,溶解性无机磷含量略高于 LEC培养的含量,LEC培养液中,无机磷几乎为零。而在ATP培养中,由于ATP容易水解,ATP的两个高能磷酸键的其中一个断裂,形成磷酸盐和二磷酸腺苷(ADP),见图2a,ATP培养中的DIP明显高于LEC和GP。NaH2PO4·2H2O培养的培养基中无机磷初始时明显高,为 5.4 μmol/L,随时间的持续逐步减少。实验进入第8天,除LEC培养米氏凯伦藻外,其他磷源培养的米氏凯伦藻进入稳定期,此后,培养基中DOP和DIP的浓度基本保持相对平缓状态,NaH2PO4·2H2O培养液的有机磷含量最少,变化趋势基本平行于坐标轴,LEC属于高分子,不能被直接利用或水解,浓度变化基本不变; G-P减少的幅度较小,部分被水解或直接被藻细胞利用; ATP培养液的有机磷含量最高,其原因为ADP中有两个磷酸基,在ADP消解后形成两分子的磷酸盐,ATP中的有机磷浓度几乎为其初始浓度的2倍。
在环境磷酸盐丰富的情况下,有些藻类具有过量摄取磷并储备磷库的能力,在磷胁迫的情况下,这些藻类能迅速利用内部的磷库维持生长,米氏凯伦藻也具备这种能力。起始接种时细胞颗粒磷的含量为 0.22 pmol/个,接种后 NaH2PO4·2H2O、LEC、G-P及 ATP培养基中细胞颗粒磷分别达到最大值0.718、0.220、0.594、0.991 pmol/个(图2c)。接种后,ATP和 G-P培养的培养液中,无机磷源稀缺,随着DOP被水解,细胞颗粒磷迅速增加,米氏凯伦藻细胞的生长也进入稳定期,环境中DIP及DOP含量变化减缓,米氏凯伦藻同时利用细胞内磷库和外界磷源维持生长,细胞颗粒磷随之降低,达到一个平缓的稳定期。而LEC培养的培养液中,LEC不能被水解成小分子有机磷或无机磷,因此,随着培养的持续,细胞颗粒磷较少,直到藻细胞死亡,细胞颗粒磷为磷。以NaH2PO4·2H2O培养基中,在培养前期无机磷源充足,细胞颗粒磷受外界充足磷源影响,细胞对环境的响应较慢,藻细胞数量增加,磷源摄取量较少,细胞颗粒磷变化趋势较为平缓,还略有降低;培养中期,藻细胞进入稳定期,摄取磷源较多,细胞颗粒磷升至最大值; 后期,环境中的无机磷源有所降低,米氏凯伦藻同时利用细胞内磷库和外界磷源维持生长,导致细胞颗粒磷降低,在随后几天,细胞死亡、代谢重新释放了一定量的磷源进入培养液中,米氏凯伦藻又能迅速摄取磷,细胞颗粒磷含量有所回升,如图2c所示。

图2 米氏凯伦藻批量培养实验中溶解无机磷(a)、溶解有机磷(b)和颗粒磷(c)的浓度变化Fig. 2 Variation in phosphorous concentration in the batch culture of Karenia mikimotoi,dissolved inorganic phosphorus (a),dissolved organic phosphorus (b),cellular particulate phosphorus (c)
2.3 米氏凯伦藻碱性磷酸酶活性的变化
2.3.1 米氏凯伦藻Bulk-APA的变化特性
受起始接种时米氏凯伦藻的磷胁迫生理状态影响,各培养基中起始总APA为5.86 pmol/(个·h)。在随后几天,不同磷源培养基中米氏凯伦藻的APA变化趋势见图3。在无机磷组中,因磷源一直充足,所以APA表达一直较低较稳定。在有机磷组中,大分子的LEC不被米氏凯伦藻吸收利用,APA从一开始就高,直到藻细胞死亡后变为零; 而另两组(ATP和GP),开始环境中缺磷,APA也较高,随着有机磷分解,提供了藻需要的磷源,APA降低。在培养初期,LEC培养的藻液初期表现出高浓度的碱性磷酸酶,达到 10.5 pmol/(个·h),但是很快迅速降低,基本为零,充分说明 LEC不能被米氏凯伦藻所利用,导致最后米氏凯伦藻全部死亡。其他两种有机磷均是在培养初期表现出较高的APA浓度,但随着时间的变化,碱性磷酸酶的含量不断降低。对于NaH2PO4·2H2O培养来说,刚接种培养时,藻类对环境的不适应性使其表现出较高的APA,但是随之立即进入低APA阶段,随着磷浓度的减少,APA略有升高的趋势。
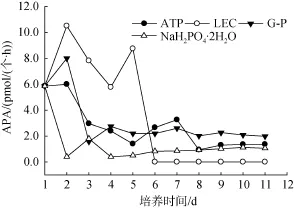
图3 米氏凯伦藻在不同磷源培养实验中碱性磷酸酶活性的变化Fig. 3 Variation in specific alkaline phosphatase in different phosphorus compounds in a culture of Karenia mikimotoi
以NaH2PO4·2H2O、G-P和ATP为磷源培养的米氏凯伦藻的 APA,后期最大值分别为 1.80、8.00和6.00 pmol/(个·h)。结果表明,溶解态无机磷NaH2PO4·2H2O和小分子溶解态有机磷G-P、ATP的存在抑制了APA的表达,培养基中G-P和ATP部分被水解为无机磷源,AP含量高于NaH2PO4·2H2O培养液中的含量,而在 NaH2PO4·2H2O4培养中的 AP,由于环境中的无机磷源充足,AP表达情况较弱。
在表达较强的ATP和G-P培养中,前期APA表达较强,有机磷水解释放出无机磷源,供米氏凯伦藻生长,其后 APA表达逐渐减弱,随着水解的无机磷的消耗,APA值有所回升。在后期藻细胞生长进入稳定期,米氏凯伦藻APA的表达也趋于稳定。
2.3.2 单个米氏凯伦藻细胞碱性磷酸酶活性的变化特性
对单个米氏凯伦藻细胞进行APA特性观察分析,如图4,单个细胞表现出黄绿色的荧光沉淀(DAPI滤光装置,Ex=365 nm±8 nm,Em>420 nm,紫光)。在无机磷培养下的米氏凯伦藻APA表达较弱,ATP和GP培养的藻细胞APA表达强度和概率均高于无机磷培养的藻细胞。在不同生长时期藻细胞的APA荧光强弱有一定的差异,变化趋势基本上与Bulk-APA含量变化一致。LEC培养的米氏凯伦藻细胞在生长前期有很强的荧光特性表达,到培养的中后期藻细胞的荧光特性消失; ATP和G-P培养的藻细胞在生长前期也有较强的荧光特性,到生长后期藻细胞进入稳定期后,碱性磷酸酶减少,产生的黄绿色荧光沉淀的表达也相应减弱。

图4 米氏凯伦藻ELF标记单细胞碱性磷酸酶情况Fig. 4 Result of Karenia mikimotoi labeled with ELF
3 结论
米氏凯伦藻能够有效利用无机磷源(NaH2PO4·2H2O),对小分子有机磷源如甘油磷酸钠(G-P)和三磷酸腺苷(ATP)也能够有效利用,但不能利用大分子有机磷源卵磷脂(LEC)。
米氏凯伦藻能够在磷源充足时摄取大量的磷储存在体内,在外界环境磷源缺乏时,能够迅速通过酶作用有效利用体内的磷库维持生长; 米氏凯伦藻环境无机磷源充足时,几乎没有碱性磷酸酶的表达,环境无机磷源缺乏时,能诱导产生碱性磷酸酶水解有机磷和颗粒磷来维持自身的生长。
米氏凯伦藻不仅有较高的 Bulk-APA,对于single-APA 也有较强的表现,在单个米氏凯伦藻细胞中,能够清晰地在细胞的表面看见由 ELF标记留下黄绿色的荧光沉淀。
参考文献:
[1] 王朝晖,尹伊伟,齐雨藻,等. 珠海桂山岛米氏裸甲藻赤潮对鱼鳃损伤的病理学组织观察[J]. 海洋学报,2001,23(1): 133-138. Wang Zhaohui,Yin Yiwei,Qi Yuzao,et al. Histopathological changes in fish gills during Gymnodinium mikimotoi red tide in Guishan Island area,the South China Sea[J]. Acta Oceanologica Sinica,2001,23(1):133-138.
[2] Yang Z B,Hodgkiss I J. Hong kong’s worst “red tide”:causative factors reflected in a phytoplankton study at Port Shelter station in 1998[J]. Harmful Algae,2004,3: 149-161.
[3] 张冬鹏,杨二俐,黄毅华. 近年来深圳海域的赤潮及发展趋势[J]. 中国环境监测,2002,18(5): 24-27. Zhang Dongpeng,Yang Erli,Huang Yihua. Status and tendency of harmful algal blooms in Shenzhang waters near years[J]. Environmental Monitoring in China,2002,18(5): 24-27.
[4] Lu S H,Hodgkiss I J. Harmful algal bloom causative collected from Hong Kong waters[J]. Hydrobiologia,2004,512: 231-238.
[5] 唐洪杰,杨茹君,张传松等. 几种海洋微藻的碱性磷酸酶性质初步研究[J]. 海洋科学,2006,30(10): 62-64. Tang Hongjie,Yang Rujun,Zhang Chuansong,et al. Characterization of alkaline phosphatase in several marine microalgaes[J]. Marine Sciences,2006,30(10): 62-64.
[6] 宋福行,焦念志,等. 锌离子对肽酶和碱性磷酸酶活性影响的初步研究[J]. 海洋科学,2003,27(3): 64-65. Song Fuhang,Jiao Nianzhi. Preliminary study on the effect of Zn2+on the activities of peptidase and alkaline phosphatase[J]. Marine Sciences,2003,27(3): 64-65.
[7] 余群,王重刚,陈荣,等. 硒对华贵栉孔扇贝碱性磷酸酶的酶动力学及理化性质研究[J]. 海洋科学,2008,32(10): 56-61. Yu Qun,Wang Chonggang,Chen Rong,et al. The kinetics and physical & chemical characteristics of alkaline phosphatase from the scallope Chlamys nobilis(Reeve) effected by trace Selenium[J]. Marine Sciences,2008,32(10): 56-61.
[8] 王丹,黄春秀,黄邦钦,等. 黄海两种典型硅藻的磷胁迫生理研究[J]. 海洋科学,2008,32(5): 22-27. Wang Dan,Huang Chunxiu,Huang Bangqin,et al. Physiological responses of two typical species of diatoms to phosphorus stress in Yellow Sea[J]. Marine Sciences,2008,32(5): 22-27.
[9] 欧林坚,黄邦钦,齐雨藻,等. 混合培养条件下几种赤潮藻对无机磷源的竞争生长研究[J]. 海洋科学,2009,33(6): 41-45. OU Linjian,Huang Bangqin,Qi Yuzao,et al. Research on competiting growth of some harmful algae to phosphate in co-exist bath incubation[J]. Marine Sciences,2009,33(6): 41-45.
[10] Hoppe H G. Phosphatase activity in the sea[J]. Hydrobiologia,2003,493: 187-200.
[11] Murphy J,Riley J. A modified single solution method for determination of phosphate in natural waters[J]. Anal Chim Acta,1962,27: 31-36.
[12] Jeffies D S,Dieken F P,Jones D E. Performance of the autoclave digestion method for total phosphorus analysis[J]. Water Res,1979,13: 275-279.
[13] Hoppe H G. Significance of exoenzymatic activities in the ecology of brackish water: measurements by means of methylumbelliferyl-substrates[J]. Mar Ecol Prog Ser,1983,11: 299-308.
[14] Dyhrman S D,Palenik B.Phosphate stress in cultures and filed populations of dinoflagellate Prorocentrum minimum detected by a single-cell alkaline phosphatase assay[J]. Appl Environ Microbiol,1999,65(7):3205-3212.
[15] Huang B Q,OU L J,et al. Alkaline phosphatase activity of phytoplankton in East China Sea coastal waters with frequent harmful algal bloom occurrences[J]. Aquatic Microbial Ecology,2007,49: 195-206.
[16] Nicfolson D,Dyhrman S. Alkaline phosphatase activity in the phytoplankton communities of Monterey Bay and San Francisco Bay[J]. Limnology and Oceanography,2006,51: 874-883.
(本文编辑: 谭雪静)
中图分类号:X173
文献标识码:A
文章编号:1000-3096(2016)04-0059-06
doi:10.11759//hykx20140805001
收稿日期:2014-08-05; 修回日期: 2015-08-31
基金项目:国家自然科学基金(U0733006); 国家重点基础研究发展计划(973)项目(2010CB428702)
作者简介:庞勇(1983-),男,四川江油人,硕士,助理研究员,主要从事海洋生态环境学研究,E-mail: yongpang520@163.com一般来说,利用率取决于有机磷的分子量大小。对大分子而言,分子量太大,藻类对其利用率可能很低,而小分子的有机磷源则可能会有很高的利用率。在无机磷耗尽的寡营养海区,AP对浮游植物再利用溶解态有机磷维持生长具有重要意义,不同种类浮游植物利用 AP降解溶解性有机磷的能力甚至关系着种群的存亡[10]。本研究选用广东沿海常见的赤潮藻种,选取了 3种有机磷源 ATP、LEC、G-P和一种无机磷源 NaH2PO4·2H2O,研究米氏凯伦藻对不同磷源的吸收利用特征,揭示和补充米氏凯伦藻赤潮形成的磷营养机理。所以在不同磷源下对米氏凯伦藻的生长和碱性磷酸酶活性进行研究,显得非常有意义。
Effects of the different kinds of phosphorus sources on growth and alkaline phosphatase activity (APA) of Karenia mikimotoi Hansen
PANG Yong1,3,NIE Rui2,3,LYU Song-hui3
(1. Hainan Academy of Oceanographic and Fishery Sciences,Haikou 570125,China; 2. Marine Monitoring and Forecasting Center of Hainan Province,Haikou 570206,China; 3. Research Center for Harmful Algae and Marine Biology,Jinan University,Guangzhou 510632,China)
Received: Aug. 5,2014
Key words:Karenia mikimotoi; organic phosphorus; alkaline phosphatase
Abstract:To understand the mechanisms of phosphorus nutrition in blooms of Karenia mikimotoi,the studies of the growth and alkaline phosphatase activity (APA) of K. mikimotoi were undertaken using different phosphorus sources [adenosine triphosphate disodium salt (adenosine disodium triphosphate,and ATP),glycerophosphate (sodium glycerophosphate and G-P),lecithin (lecthin and LEC) and NaH2PO4·2H2O]. The results revealed the following (1) K. mikimotoi could utilize PO4-P,sodium glycerophosphate (G-P),sodium glycerophosphate (G-P),and adenosine triphosphate (ATP) as phosphorus sources,but it could not utilize lecithin (LEC); (2) when the APA of K. mikimotoi was assayed at the initial stage,the maximum APA in the different phosphorus sources,ATP,G-P,LEC and NaH2PO4·2H2O,of K. mikimotoi were 6.0,10.5,8.0 and 0.4 pmol/(cell·h),respectively. As the incubation time was increased,the APA decreased and then increased and maintained the maximum level. The phosphorus source of NaH2PO4·2H2O,the APA of K. mikimotoi did not increase significantly; (3) the APA site of a single K. mikimotoi cell was widely distributed,largely on the cell surface In this research,it was found that K. mikimotoi could better absorb and utilize organic phosphorus to maintain growth in the external environment under inorganic phosphorus-limited conditions,which confirmed that the bloom of K. mikimotoi frequently occurred in phosphorus-restricted areas in recent years.

