甲壳素酰化改性的研究进展
施文涛,陈鹏(中国科学院宁波材料技术与工程研究所,中国科学院海洋新材料与应用技术重点实验室,浙江省海洋材料与防护技术重点实验室,宁波市高分子材料重点实验室,浙江 宁波 315201)
综述与专论
甲壳素酰化改性的研究进展
施文涛,陈鹏
(中国科学院宁波材料技术与工程研究所,中国科学院海洋新材料与应用技术重点实验室,浙江省海洋材料与防护技术重点实验室,宁波市高分子材料重点实验室,浙江 宁波 315201)
摘要:甲壳素作为一种来源广泛的生物质材料,具有良好的生物相容性和抑菌性,可用于药物缓释、伤口包覆、组织植入、生物分离、重金属吸附等高附加值领域,但强烈的氢键作用使其不熔难溶,需经改性以促进其加工和应用。本文简要回顾了甲壳素酰化改性的发展历程,重点介绍均相条件下甲壳素的各种酰化方法,如在甲磺酸、氯化锂/二甲基乙酰胺、离子液体、三氟乙酸酐中进行反应,以及在非均相条件下提高酰化效率的各种方法,如优选催化剂、结构活化等,比较了各种方法的优缺点,并简述了甲壳素酰化产物的性能特点和应用。目前甲壳素非均相酰化工艺较成熟,已实现工业化,但仍有一定的局限性和缺点。最后展望了均相和非均相酰化可能的改进方向。
关键词:甲壳素;酰化;均相;非均相
甲壳素是产量仅次于纤维素的天然生物质材料。目前甲壳素主要取自食品加工业产生的虾、蟹等甲壳。甲壳素及其衍生物具有良好的生物相容性、抑菌性和促进伤口愈合等功能,广泛用于药物缓释、伤口包覆、组织植入、生物分离、重金属吸附等高附加值领域[1]。但甲壳素富含氢键且高度结晶,导致不熔难溶、加工困难等难题,必须加以改性。目前主流的改性方法均以削弱氢键为要旨,如酰化、烷基化、醚化、酯化(无机酸酯化)、接枝等[2-4]。
传统上甲壳素酰化多采用甲磺酸或高氯酸催化,或将碱甲壳素酰化[5],存在反应效率低、产物均一性差等不足。近年来,甲壳素酰化改性研究出现新的趋势:一是开发均相酰化体系以提高反应效率和产物均一性,二是探索新的活化方法以提高非均相酰化效率。就均相酰化而言,已筛选出多个体系,如氯化锂/二甲基乙酰胺(LiCl/DMAc)、六氟异丙醇、离子液体等。最近报道[6-7]的三氟乙酸酐催化羧酸酰化甲壳素,使反应时间大幅缩短,凸显了均相酰化的优势。
文献[8-9]已对酸催化甲壳素酰化进行了专门的综述。本文侧重介绍和对比均相、非均相条件下甲壳素酰化的主要方法和产物种类、结构等,以期对甲壳素的改性、加工和应用提供参考。
1 甲壳素的结构和酰化因素
根据甲壳素的单元结构(图1,C2处含少量未被乙酰化的氨基)和酰化位置不同,其酰化可分为N酰化(C2残留氨基酰化及其二酰化)和O酰化(C3、C6羟基)。N酰化较难进行,在总酰化度较高时才发生;而O酰化较易进行,此时由于空间位阻效应,C6比C3上的羟基更易酰化。羟基的完全酰化需在苛刻条件下进行,如较高摩尔倍率的酰化剂、高效的催化剂和较长的反应时间等。酰化剂一般为酸酐、酰氯或羧酸。当取代基相同时,酰化效率排序为羧酸<酸酐<酰氯。随酰化剂含量增加和反应时间延长,酰化程度上升,但有极限值。

图1 甲壳素单元结构
根据在晶格中的分子排列不同,原生甲壳素主要有α和β型(图2)。其中,α型甲壳素分子间氢键作用强,只能溶于强酸、LiCl/DMAc、含氟极性溶剂、二水氯化钙/甲醇、浓碱、离子液体等[10-11],而后方可酰化;β型甲壳素无分子间氢键,更易溶胀和酰化。有趣的是,β型甲壳素可在酸、碱条件下转变为α型甲壳素[12-13],而α、β型甲壳素在适当的条件下可再生为半α型甲壳素(图2)[14],这也为甲壳素改性提供了可能的调控途径,但目前这方面的研究尚不多见。
以下分均相和非均相体系详述各种因素(酰化体系、酰化剂、催化剂、时间、温度等)对甲壳素酰化的影响。
2 均相体系
所谓“均相”,是指甲壳素或其酰化产物在反应前或反应中溶解形成均相体系。此时,体系分散均匀,酰化度高,产物均一性好。但均相反应的发生和效率取决于溶剂和溶解性,目前多见于实验研究。
均相酰化可分两类:①甲壳素反应前不溶解,但随酰化反应的进行,酰化产物逐渐溶解形成均相,如在甲磺酸中;②甲壳素反应前即溶解,如在LiCl/DMAc和离子液体中。表1总结了多个均相体系的反应条件与产物。

图2 α、β甲壳素溶解再生中的转变[14]
2.1 甲磺酸体系
甲磺酸催化酸酐酰化是常用的甲壳素均相酰化体系,其中甲磺酸兼作溶剂和催化剂[5,10]。典型体系如表1所示,将甲壳素、甲磺酸和乙酸酐按比例混合,反应后静置过夜,可达到均相[5]。此反应要严格控制温度,以免反应温度过高导致甲壳素过度降解(图3)[15]。

图3 甲壳素溶解在甲磺酸中的增比黏度变化[15]
相同酰化度下,酰化插入的基团越大,对甲壳素致密结构的破坏程度越大,使其结晶度降低、溶解性提升。但随着酰化基团增大,其插入难度也增加,需选用更强的酰化剂(如酰氯)。KAIFU等[16]将甲壳素溶于甲磺酸,与酰氯反应分别生成了己酰化、癸酰化和十二烷基酰化甲壳素。
羧酸也可用于甲磺酸催化酰化甲壳素,但其酰化效率低于酰氯和酸酐,且随加入量增大所能达到的酰化度极值也偏低[15](表1)。
2.2 氯化锂/二甲基乙酰胺(LiCl/DMAc)体系
甲壳素溶解在LiCl/DMAc中基本无降解,分子量可保持数周不变,在其中进行酰化时聚合度的降低幅度较小(表1)。但由于溶液黏度较高,酰化反应通常在较低的浓度下进行。
用酰氯作酰化剂时,反应生成 HCl,诱发甲壳素降解,需添加三乙基胺、吡啶等进行中和。三乙基胺与HCl成盐而沉淀析出[17],吡啶除作为中和剂外,还有催化作用[18]。由于溶液中的 Li+对吡啶的亲核效应产生屏蔽,需加入过量吡啶,中和 Li+后方可发挥催化作用。反应要在低温进行,防止发生氯化,此外还可控制低酰化度时的反应选择性,利于在C6上的酰化反应[17]。
酰氯酰化效率高,在均相条件下很容易达到完全酰化。SUGIMOTO等[19]使用C2~C6的脂肪族酰氯酰化甲壳素(表1),产物酰化度极值可超过2.0,说明发生了N酰化,使C2氨基上的乙酰基个数大于1。
此外,也可用羧酸在吡啶、对甲苯磺酰氯催化下对甲壳素进行均相酰化[20]。
2.3 离子液体体系

表1 均相体系甲壳素酰化的反应条件与产物性质
甲壳素在离子液体中的溶解性较优,质量分数可达2%~10%,但溶解和酰化均需较长时间。可用的离子液体大多含 N,N′-二烷基咪唑型阳离子,如1-烯丙基-3-甲基咪唑溴盐[Amim][Br][21-24]、1-丁基-3-甲基咪唑乙酸盐[Bmim][Ac][14,25]、1-烯丙基-3-甲基咪唑乙酸盐[Amim][Ac][26]等。MINE等[21]研究了[Amim][Br]中甲壳素的酰化反应(表1),产物可溶于二甲基亚砜。
2.4 三氟乙酸酐体系
2.4.1 纯三氟乙酸酐体系
与其他均相体系相比,纯三氟乙酸酐体系中甲壳素的溶解和酰化更快,且酰化度高(表1)。该反应中温度和三氟乙酸酐含量尤为重要:若温度过低,则反应时间延长;三氟乙酸酐含量不足时反应不充分。
YANG等[6]在三氟乙酸酐体系中进行了甲壳素的脂肪族酰化,酰化度可高达2.3(表1),部分酰化发生在原甲壳素C2的氨基上,使氨基上的酰基个数大于 1,其产物可根据溶解性差异而分离成不同相对分子质量(4万~20万)的组分(表1),均可溶于二甲基甲酰胺。BHATT等[7]也用该方法进行了甲壳素的环烷酰化,产物可溶于二甲基甲酰胺、甲醇、乙醇和四氢呋喃。
2.4.2 三氟乙酸酐/磷酸体系
也可在三氟乙酸酐/磷酸体系中对甲壳素进行芳香族和脂肪族酰化。相比纯三氟乙酸酐体系,磷酸可减少酰化剂羧酸和催化剂三氟乙酸酐的用量[27]。
KANKANALA等[28]最先采用此体系来酰化芳香族化合物。BHATT等将该方法用于甲壳素,分别生成丁酰化[27]和苯甲酰化甲壳素[29],产物可溶于二甲基亚砜、二甲基甲酰胺等溶剂。如图4所示,反应中酰化剂羧酸下先后和三氟乙酸酐、磷酸生成酯类,该酯类再与甲壳素的羟基反应生成酰化产物[27,29]。
3 非均相体系
传统上甲壳素酰化多在非均相体系中进行,一般为固-液反应。与均相酰化相比,非均相酰化较易导致原料降解,酰化度较低,均一性较差[17,20]。如甲壳素被高氯酸催化丁酰化时,其相对分子质量从45.5万降至13.2万[30]。但非均相体系成本低、反应量大,为工业界所采用。
3.1 催化剂
固-液非均相酰化多使用高氯酸等强酸催化剂[8-9],其成本较低,已实现工业化。除了强酸,还可采用吡啶、二烷基氨基吡啶等作为催化剂。其中,4-二甲氨基吡啶(DMAP)催化效率高,可提高产物的酰化程度,使其完全酰化[31]。
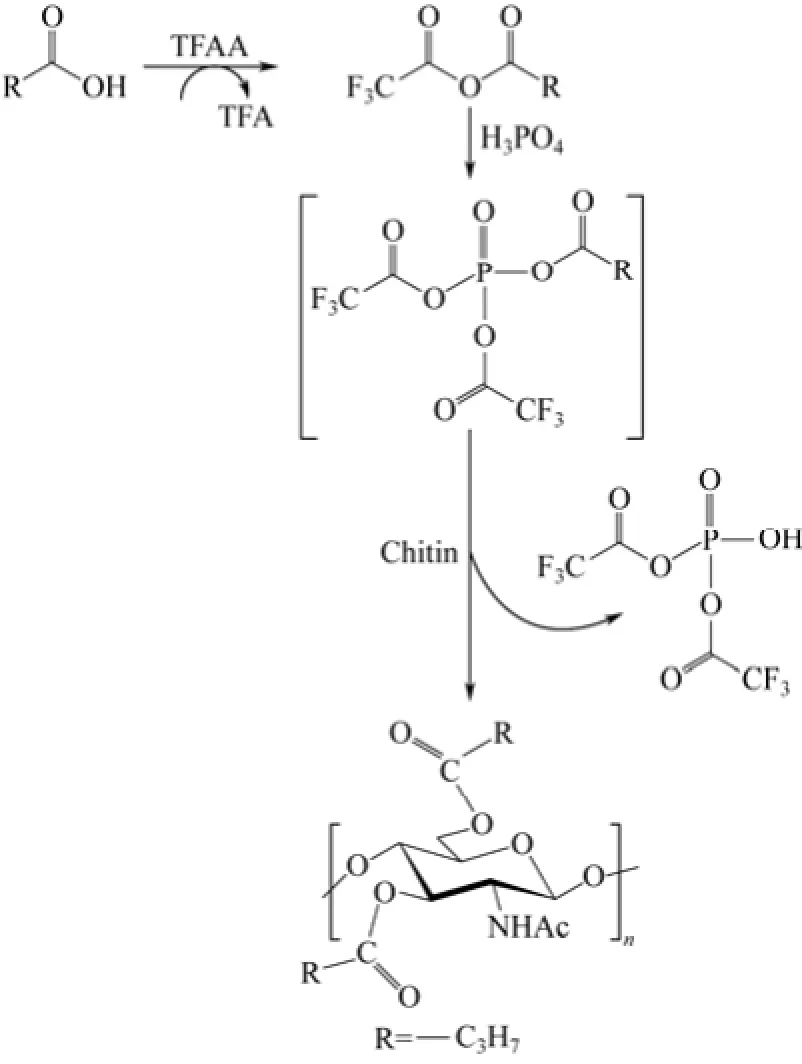
图4 甲壳素在三氟乙酸酐/磷酸催化下的酰化示意图[27]
3.2 活化
通过对甲壳素原料进行活化以提高非均相体系的酰化效率具有重要的应用价值,近年来广受关注。VASNEV 等[18]将甲壳素、酰氯溶于六氟异丙醇(HFIP),再蒸去HFIP,得到疏松多孔、比表面积增大的活化甲壳素,继而添加过量吡啶作为酰氯的溶剂,并催化酰化反应,使酰化温度由80℃降至室温、时间由6h缩短到2h、酰化度由0.10提高到0.22。显然,该方法需使用挥发性溶剂如HFIP。但HFIP价格较高,且甲壳素分子量较高时溶解性差,限制了该方法的应用。
β型甲壳素无分子链间氢键,小分子较易插入从而形成插层复合物。YOSHIFUJI等[32]根据该原理对甲壳素进行活化,将β型甲壳素依次在水、二甲基亚砜、乙酸酐中浸泡,使β型甲壳素依次与相应试剂形成插层复合物,再与过量乙酸酐发生酰化反应。与直接酰化相比,该方法不使用催化剂,酰化时间缩短,酰化度提升,唯一缺点是复合物的形成需额外时间。
3.3 碱化处理
碱化甲壳素可直接与酸酐反应,但酰化度达到0.3~0.4后不再随酸酐加入量的增加而上升[5,15]。采用酰氯可有效提高酰化效率,KURITA等[33]先将甲壳素加入氢氧化钠水溶液,反应生成碱化甲壳素并溶解,再将含对甲苯磺酰氯的氯仿加入,在氢氧化钠水溶液和氯仿两种互不相溶的液体之间进行液-液界面反应,使酰化度提高到0.95。
相对于常见的固-液反应、液-液界面反应所得产物均一性较好。但酰氯酰化时界面反应剧烈,尤其是酰氯量较大时可能引起温度飙升,使实验重现性较差、产物酰化度较低[33]。
4 酰化产物种类
甲壳素酰化产物主要包括脂肪族、环烷族和芳香族等,对应于不同的加工工艺性和应用性能。
4.1 脂肪族
TERAMOTO等[20]研究了C4~C20的脂肪族酰化甲壳素。在LiCl/DMAc中,采用吡啶、对甲苯磺酰氯为催化剂、羧酸为酰化剂,制得具有半刚性主链、柔性侧链的脂肪族酰化甲壳素(如图5)。随着取代基碳个数的增加,柔性侧链变长,直至足够长时互相交错[如图 5(b)],使得玻璃化程度增强。当取代基碳个数大于12后,在DSC曲线上出现玻璃化转变。
甲壳素在甲、乙酰化后可溶于LiCl/DMAc、甲酸、三氯乙酸等溶剂,进而加工成各种制品,应用于医疗等领域。例如:甲、乙酰化甲壳素可促进伤口愈合[10],而二乙酰化甲壳素具有抗凝血性[15]。
随着脂肪族酰化基团增大和酰化度增加,产物溶解性进一步提升,至二丁酰化甲壳素时出现显著变化,其虽不溶于水性溶剂,但溶于大部分有机溶剂[34]。二丁酰化甲壳素被广泛用于湿法[30,35-38]、干法纺丝[38],所得纤维在碱液中水解还原即可得到甲壳素纤维。如图6所示,水解150min后得到的还原甲壳素纤维的结晶性与不经酰化直接制得的纤维类似,而二丁酰化甲壳素的高溶解性使其加工工艺性更优[37-38]。
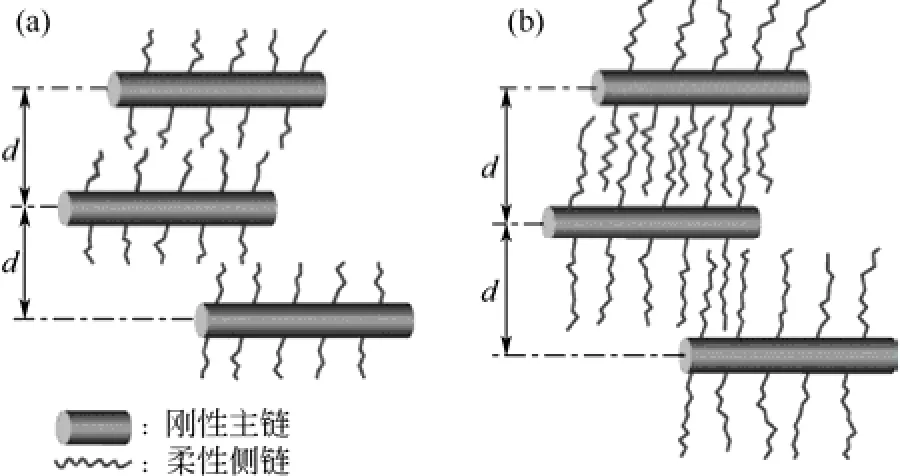
图5 酰化甲壳素结构示意图[20]
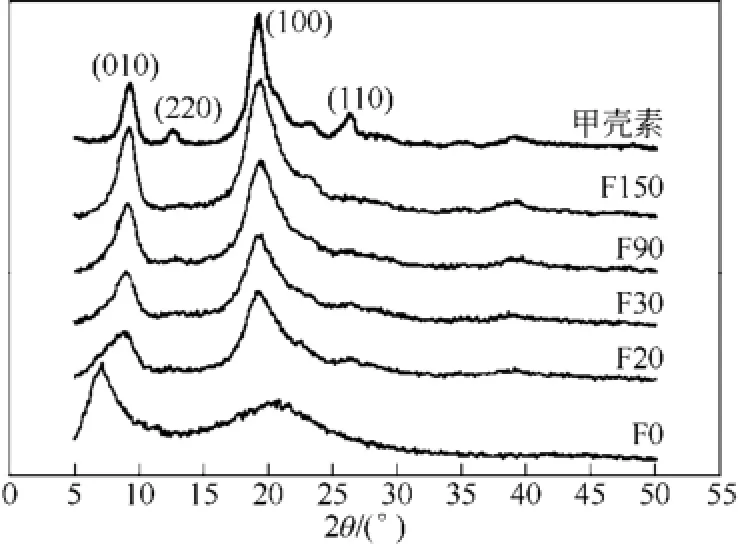
图6 甲壳素、二丁酰化甲壳素纤维(F0)和被碱水解的二丁酰化甲壳素纤维[37]
二丁酰化甲壳素已用于伤口敷料,可促进伤口愈合[30]。本文作者所在课题组采用类似方法对甲壳素进行酰化改性和湿法纺丝,通过在纺丝液中添加适量的碳纳米管、石墨烯等纳米填料,发现在纳米填料和酰化甲壳素之间可发生特定相互作用,促进纺丝液浓度提高和纤维性能改善,并保持其良好的抗菌等功能,相关机理正在深入研究中。
更多碳个数的脂肪族酰化甲壳素可直接溶于苯、四氢呋喃、二氯甲烷等有机溶剂[16]。随着脂肪族酰化碳个数的增长,产物开始具有较长的疏水链,其亲水性减弱。
4.2 环烷族
环烷族酰化通常采用三氟乙酸酐催化羧酸酰化甲壳素。随着插入环的增大,对甲壳素致密结构的破坏随之增大,使其表面从密实变为疏松(图7),结晶度更低,溶解性更好[7]。
4.3 芳香族
由于芳香基团体积庞大,反应较为困难,须采用强酰化剂如酰氯。芳香族酰化使甲壳素分子间氢键显著减弱,从而溶解性更优。例如:苯甲酰化产物可溶于苯甲醇、二甲基亚砜、二甲基甲酰胺、甲酸等溶剂[39];甲苯磺酰化时,酰化度0.4以上的产物可溶于二甲基亚砜、二甲基乙酰胺、甲基吡咯烷酮等溶剂,是一种良好的反应中间体[33]。
5 结 语
甲壳素经酰化改性可有效削弱其氢键和结晶,从而获得良好的溶解性和加工性。目前广泛使用的甲磺酸或高氯酸催化酰化法仍有一定的局限性和缺点,如需要较长的反应时间,并在冰浴中反应以避免降解。酰化方法的改进大致可分为均相和非均相两方面。对于均相体系,需进一步提高溶液浓度和反应规模,离子液体是值得进一步研究的溶剂。三氟乙酸酐体系在保证产物酰化度的同时可大幅缩短反应时间,且反应条件温和、产物均一性较好,可作为一种方便快捷的实验级酰化方法。非均相反应则在研究新的活化方法方面仍有较大提升空间。
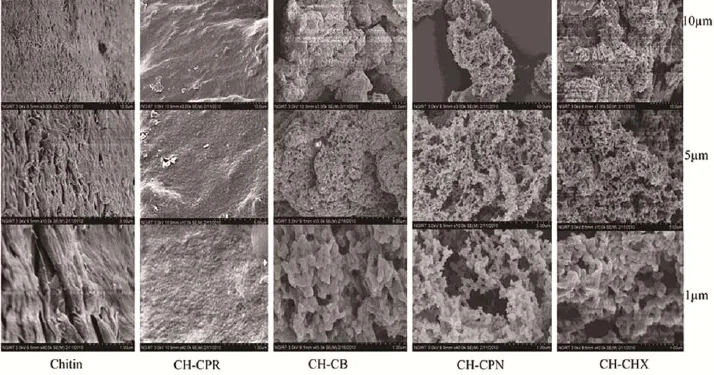
图7 甲壳素和环烷基酰化甲壳素扫描电镜图[7]
参考文献
[1] FELSE PA,PANDA T.Studies on applications of chitin and its derivatives[J].Bioprocess Engineering,1999,20(6):505-512.
[2] 马宁,汪琴,孙胜玲,等.甲壳素和壳聚糖化学改性研究进展[J].化学进展,2004(4):643-653.
[3] 杨安乐,陈长春,孙康,等.甲壳素的改性研究及其在功能材料上的应用[J].现代化工,1999(4):52-54.
[4] 汪玉庭,刘玉红,张淑琴.甲壳素、壳聚糖的化学改性及其衍生物应用研究进展[J].功能高分子学报,2002(1):107-114.
[5] NISHI N,NOGUCHI J,TOKURA S,et al.Studies on chitin.1.Acetylation of chitin[J].Polymer Journal,1979,11(1):27-32.
[6] YANG B Y,DING Q,MONTGOMERY R.Preparation and physical properties of chitin fatty acids esters[J].Carbohydrate Research,2009,344(3):336-342.
[7] BHATT L R,KIM B M,AN C Y,et al.Synthesis of chitin cycloalkyl ester derivatives and their physical properties[J].Carbohydrate Research,2010,345(14):2102-2106.
[8] 吴文忠.用酸催化法制备乙酰化甲壳质的研究进展[J].合成技术及应用,1999(2):29-31.
[9] 陈长春,吴人洁,孙康.甲壳素的酰基化及其在生物材料上的应用[J].功能高分子学报,1997(2):148-152.
[10] 王爱勤.甲壳素化学[M].北京:科学出版社,2008:221-226.
[11] PILLAI C K S,PAUL W,SHARMA C P.Chitin and chitosan polymers:chemistry,solubility and fiber formation[J].Progress in Polymer Science,2009,34(7):641-678.
[12] SAITO Y,PUTAUX JL,OKANO T,et al.Structural aspects of the swelling of beta chitin in HCl and its conversion into alpha chitin[J].Macromolecules,1997,30(13):3867-3873.
[13] NOISHIKI Y,TAKAMI H,NISHIYAMA Y,et al.Alkali-induced conversion of beta-chitin to alpha-chitin[J].Biomacromolecules,2003,4(4):896-899.
[14] WU Y,SASAKI T,IRIE S,et al.A novel biomass-ionic liquid platform for the utilization of native chitin[J].Polymer,2008,49(9):2321-2327.
[15] KAIFU K,NISHI N,KOMAI T,et al.Studies on chitin.5.formylation,propionylation,and butyrylation of chitin[J].Polymer Journal,1981,13(3):241-245.
[16] KAIFU K,NISHI N,KOMAI T.Preparation of hexanoyl,decanoyl,and dodecanoylchitin[J].Journal of Polymer Science,Part A:Polymer Chemistry,1981,19(9):2361-2363.
[17] ZOU YQ,KHOR E.Preparation of c-6 substituted chitin derivatives under homogeneous conditions[J].Biomacromolecules,2005,6(1):80-87.
[18] VASNEV V A,TARASOV A I,MARKOVA G D,et al.Synthesis and properties of acylated chitin and chitosan derivatives[J].Carbohydrate Polymers,2006,64(2):184-189.
[19] SUGIMOTO M,KAWAHARA M,TERAMOTO Y,et al.Synthesis of acyl chitin derivatives and miscibility characterization of their blends with poly(epsilon-caprolactone)[J].Carbohydrate Polymers,2010,79(4):948-954.
[20] TERAMOTO Y,MIYATA T,NISHIO Y.Mesomorphic assemblage of chitin normal acylates and rapid enthalpy relaxation of their side chains[J].Biomacromolecules,2006,7(1):190-198.
[21] MINE S,IZAWA H,KANEKO Y,et al.Acetylation of alpha-chitinin ionic liquids[J].Carbohydrate Research,2009,344(16):2263-2265.
[22] PRASAD K,MURAKAMI M,KANEKO Y,et al.Weak gel of chitin with ionic liquid, 1-allyl-3-methylimidazolium bromide[J].International Journal of Biological Macromolecules,2009,45(3):221-225.
[23] YAMAZAKI S,TAKEGAWA A,KANEKO Y,et al.An acidic cellulose-chitin hybrid gel as novel electrolyte for an electric double layer capacitor[J].Electrochemistry Communications,2009,11(1):68-70.
[24] TAKEGAWA A,MURAKAMI M,KANEKO Y,et al.Preparation of chitin/cellulose composite gels and films with ionic liquids[J].Carbohydrate Polymers,2010,79(1):85-90.
[25] SETOYAMA M,KATO T,YAMAMOTO K,et al.Preparation of chitin/cellulose films compatibilized with polymeric ionic liquids[J].Journal of Polymers and the Environment,2013,21(3):795-801.
[26] WANG W-T,ZHU J,WANG X-L,et al.Dissolution behavior of chitin in ionic liquids[J].Journal of Macromolecular Science,Part B:Physics,2010,49(3):528-541.
[27] BHATT LR,KIM BM,HYUN K,et al.Preparation of chitin butyrate by using phosphoryl mixed anhydride system[J].Carbohydrate Research,2011,346(5):691-694.
[28] KANKANALA K,REDDY VR,MUKKANTI K,et al.A TFAA-H3PO4-mediated direct,metal-free and high-speed synthesis of aryl carboxylate esters from phenols[J].Journal of Fluorine Chemistry,2009,130(5):505-508.
[29] BHATT LR,KIM BM,HYUN K,et al.Preparation and characterization of chitin benzoic acid esters[J].Molecules,2011,16 (4):3029-3036.
[30] CHILARSKI A,KRUCINSKA I,KIEKENS P,et al.Novel dressing materials accelerating wound healing made from dibutyrylchitin[J].Fibres & Textiles In Eastern Europe,2007,15(4):77-81.
[31] 李英.介绍一类高效酰化催化剂——二烷基氨基吡啶[J].化学试剂,1982(2):88-94,129.
[32] YOSHIFUJI A,NOISHIKI Y,WADA M,et al.Esterification of beta-chitin via intercalation by carboxylic anhydrides[J].Biomacromolecules,2006,7(10):2878-2881.
[33] KURITA K,YOSHINO H,YOKOTA K,et al.Preparation of tosylchitins as precursors for facile chemical modifications of chitin[J].Macromolecules,1992,25(14):3786-3790.
[34] 马健岩,许峰,冷兵.丁酰甲壳素的制备及表征[J].辽宁化工,2008 (6):365-368.
[35] MUZZARELLI RAA,GUERRIERI M,GOTERI G,et al.The biocompatibility of dibutyryl chitin in the context of wound dressings[J].Biomaterials,2005,26(29):5844-5854.
[36] WAWRO D,STEPLEWSKI W,CIECHANSKA D,et al.The effect of solvent type on the mechanical properties of dibutyrylchitin (DBC) fibres[J].Fibres & Textiles In Eastern Europe,2007,15(3):14-18.[37] WLOCHOWICZ A,SZOSLAND L,BINIAS D,et al.Crystalline structure and mechanical properties of wet-spun dibutyrylchitin fibers and products of their alkaline treatment[J].Journal of Applied Polymer Science,2004,94(5):1861-1868.
[38] SZOSLAND L,骆为林.甲壳质和二丁酰甲壳质纤维[J].国外纺织技术,1999(6):9-10.
[39] SOMORIN O,NISHI N,TOKURA S,et al.Studies on chitin 2.Preparation of benzyl and benzoylchitins[J].Polymer Journal,1979,11(5):391-396.
第一作者:施文涛(1983—),男,工程师,从事甲壳素改性及其湿法纺丝研究。E-mail swt596@163.com。联系人:陈鹏,研究员,从事高分子改性与加工工艺研究。E-mail pchen@nimte.ac.cn。
中图分类号:O 636.1
文献标志码:A
文章编号:1000-6613(2016)07-2166-07
DOI:10.16085/j.issn.1000-6613.2016.07.033
收稿日期:2015-09-09;修改稿日期:2016-03-04。
基金项目:国家自然科学基金(51273207)及宁波市国际科技合作项目(2013D10002)。
Advances in acylation of chitin
SHI Wentao,CHEN Peng
(Ningbo Institute of Materials Technology and Engineering,Chinese academy of Sciences,Key Laboratory of Marine Materials and Related Technologies,Zhejiang Key Laboratory of Marine Materials and Protective Technologies,Ningbo Key Laboratory of Polymer Materials,Ningbo 315201,Zhejiang,China)
Abstract:As one of the major bio-based materials,chitin shows excellent bio-compatibility and anti-bacterial properties and finds applications in many high value-added areas,such as drug release,wound healing,tissue implantation,bio-separation engineering and heavy metal absorption,etc.However,chitin is featured by extensive hydrogen bonding,making it unable to melt and difficult to be dissolved.Therefore,modification is important to facilitate the processing and application of chitin.In this article,the current state of acylation of chitin is reviewed by comparing different acylation methods under both homogeneous and heterogeneous conditions.Focus is on the homogeneous reactions in methanesulfonic acid,lithium chloride/dimethylacetamide,ionic liquids and trifluoroacetic anhydride.Methods for improving acylation efficiency under heterogeneous conditions are described,such as optimizing the catalyst and structural activation.The properties and applications of acylated chitin are also introduced.Although the acylation of chitin under heterogeneous conditions has been well developed,there are still some limits and shortcomings.This paper highlights the significant advantages of trifluoroacetic anhydride method under homogeneous conditions,as well as strategies for improving the heterogeneous acylation of chitin.
Key words:chitin;acylation;homogeneous;heterogeneous

