Bacillus细菌的分离及其芽孢漆酶对染料脱色的影响
汪春蕾,李凡姝,孙海琼,赵敏,苏秋钰,亓旭辉
(东北林业大学生命科学学院,黑龙江 哈尔滨150040)
Bacillus细菌的分离及其芽孢漆酶对染料脱色的影响
汪春蕾,李凡姝,孙海琼,赵敏,苏秋钰,亓旭辉
(东北林业大学生命科学学院,黑龙江 哈尔滨150040)
摘 要:利用含铜离子的富集培养基,从东北林业大学实验林场蒙古栎林下的土壤中筛选出具有较高漆酶活性的1株细菌,采用形态学、生理生化反应以及16S rDNA序列同源性分析等方法,鉴定其为芽孢杆菌属细菌,命名为Bacillus sp. 5`MS。以丁香醛连氮为底物,以芽孢干重计算,其芽孢漆酶的活性高达56.73 U/g。菌株5`MS芽孢漆酶的最适pH值为6.6,最适反应温度为70 ℃。在100 ℃条件下,该芽孢漆酶反应活性仍可达最适条件下的34.61%。当染料脱色体系中添加介体乙酰丁香酮时,菌株5`MS芽孢漆酶1 h内对活性黑、靛红及结晶紫的脱色率均达92%以上,4 h内对活性蓝的脱色率达82.8%。
关 键 词:芽孢杆菌属;芽孢漆酶;染料脱色
投稿网址:http://xb.ijournal.cn
漆酶(benzenediol: oxygen oxidoreductases, EC1. 10.3.2)是一类含铜的多酚氧化酶,能够利用分子氧氧化各种芳香族和非芳香族化合物,并能同时完成多种底物的单电子转移,分子氧被还原为水[1]。漆酶广泛分布于真菌、植物和动物中[2],近年来也发现漆酶广泛存在于细菌中[3-4]。细菌漆酶具有独特的性质,如在碱性条件下具有较好的活性及稳定性[4]。细菌漆酶具有高耐热性[5],而真菌漆酶在高温及高pH值条件下通常会迅速地失去活性[6]。芽孢杆菌属细菌漆酶比真菌漆酶更适合对其基因进行操作和重组[7-8]。漆酶作用的底物范围广泛,在造纸、食品、降解工业染料和生物检测等领域具有较好的应用前景[9]。近年来,合成染料广泛应用于纺织工业、医药、化妆品和食品等行业。全球每年生产 10万多种染料(质量超过80万t[10])。染料一般以显色基团进行划分,目前被广泛使用的是偶氮、蒽醌、靛蓝以及三苯甲烷这4种染料[11]。传统上采用物理法和化学法降解染料。近年来,生物治理法的安全性
1 材料与方法
1.1 材料
1.1.1 样品
供试样品为东北林业大学实验林场蒙古栎林下的土壤。
1.1.2 主要试剂
Taq DNA polymerase、RNase A、琼脂糖凝胶回收试剂盒、溶菌酶、dNTP(2.5 mmol/L)为北京TIANGEN公司产品;pMD18-T Simple载体为TaKaRa公司产品;Tryptone、Yeast Extract为Oxoid公司产品;EDTA、IPTG为 Amresco公司产品;X-Gal 2,2-连氮-二(3-乙基苯并噻唑-6-磺酸)(ABTS)、丁香醛连氮(Syringaldazine,SGZ)、活性亮蓝(Remazol Brilliant Blue R,RBBR)、靛红(Indigo Carmine, IC)和活性黑(Reactive Black 5,RB5)为Sigma公司产品;结晶紫(Crystal Violet, CV)为国药集团化学试剂有限公司产品;其他试剂均为国产,分析纯。
1.1.3 主要培养基
LB固体培养基组成(w/v):1% Tryptone,0.5% Yeast Extract,1% NaCl,1.5%琼脂。培养基pH为7.0。
1.2 方法
1.2.1 高产漆酶菌株的筛选及分离纯化
称取东北林业大学实验林场蒙古栎林下的土壤10 g为样品。样品加入到120 mL M9培养基[17],充分振荡混合,180 r/min、37 ℃下培养2 d,连续继代培养,将稀释后的培养液均匀涂布在 0.2 mmol/L Cu2+的LB固体培养基上,37 ℃下培养3 d。用1 mmol/L丁香醛连氮溶液对上述培养基上的菌落进行鉴定。挑选对丁香醛连氮显现粉红色的单菌落接种于含0.4 mmol/L Cu2+的LB培养基上,重复操作3次,得到具有高漆酶活性的菌株5`MS。
1.2.2 高产漆酶菌株的形态学及生理生化特性指标测定
对菌株5`MS进行革兰氏染色,并通过生理生化反应试验观测氧化酶、过氧化氢酶和糖类发酵等特性,试验方法参照文献[18]。
1.2.3 产漆酶菌株16S rDNA序列的测定及系统发育树构建
参考文献[19]的方法提取菌株 5`MS 的总DNA。以此为模板,利用16S rDNA的通用引物[20]27F和1492R对模板进行PCR扩增。反应体系为2 μL 10×Taq Reaction Buffer,0.4 μL dNTP,27F和1492R 各0.3 μL,0.2 μL Taq DNA polymerase(3 U/μL),1 μL DNA模板,8.4 μL ddH2O。反应条件:94 ℃预变性5 min,94 ℃变性30 s,58 ℃复性45 s,72 ℃延伸90 s,循环30次,72 ℃延伸10 min。PCR扩增产物经0.8%琼脂糖凝胶电泳分离,用DNA琼脂糖凝胶回收试剂盒回收目的片段。将回收的PCR产物与pMD18-T过夜连接,再转化到E. coli JM109感受态细胞中,将菌落PCR鉴定到的阳性转化子送深圳华大基因科技服务有限公司进行测序。
将所得序列利用 NCBI(National Center for Biotechnology Information,http://www.ncbi.nlm.nih. gov)的BLAST工具进行分析比对,利用Clustal软件进行多序列比对以及 Phylip-3.69软件中的最大简约法构建该菌株的系统发育树。
1.2.4 菌株5`MS芽孢漆酶活性的测定
由于该菌株的漆酶活性来源于其芽孢外壁蛋白,所以其芽孢悬液即为芽孢漆酶液。在含有 0.2 mmol/L Cu2+的固体LB平板上接种菌株5`MS,37℃恒温培养4 d,参照文献[21]中的方法制备芽孢漆酶粗酶液。
以丁香醛连氮(syringaldazine,SGZ)作为底物,检测菌株5`MS芽孢漆酶的活性。反应体系包括缓冲液(0.2 mol/L磷酸氢二钠与0.1 mol/L柠檬酸的混合液,pH 6.0),0.1 mol/L的丁香醛连氮以及一定体积的粗酶液。将反应混合液在37 ℃水浴3 min,测定其在525 nm处的吸光值。测定3次。将每1 min氧化1 μmol 底物为产物所需的漆酶量定义为一个酶活力单位。
1.2.5 pH和温度对芽孢漆酶活性的影响试验
采用0.2 mol/L 磷酸氢二钠- 0.1 mol/L柠檬酸缓冲液(pH 3.0~8.1),以 ABTS(2,2’-azino-bis-(3-ethylbenzothiazoline-6-sulfonic acid))和 SGZ为底物测定不同pH条件下的漆酶活性。测定3次。
在最适pH的磷酸氢二钠-柠檬酸缓冲液中,以SGZ为底物,依次测量该芽孢漆酶在30~100 ℃条件下的酶活。测定3次。
1.2.6 菌株5`MS芽孢漆酶对染料脱色影响的试验
选取活性亮蓝、活性黑、靛红以及结晶紫4种染料,其最终质量浓度分别为100、40、25、5 mg/L,其最大吸收波长分别为591、597、610、583 nm,研究添加介体乙酰丁香酮(ACE)时该粗酶液对染料脱色率的影响。芽孢粗酶液的浓度计算方法和脱色体系参考文献[17]。40 ℃水浴锅中振荡,定时取样,12 000 r/min 离心3 min后测定不同染料最大吸收波长下的OD值。测定3次。
2 结果与分析
2.1 菌株5`MS的筛选及分离纯化
将土壤样品利用含铜离子的LB培养基培养,以丁香醛连氮为底物对产漆酶的菌株进行筛选,并在固体培养基上对菌种进行划线分离培养,选取1株对丁香醛连氮显现为较深红色的单克隆菌株为研究对象,并将其编号为5`MS。
2.2 菌株5`MS的形态和生理生化特性
菌株5`MS呈杆状,菌体大小为(0.1~0.15) μm× (0.5~0.6) μm。革兰氏染色结果为蓝紫色,表明菌株为革兰氏阳性细菌(图1)。该菌株在LB固体培养基上37 ℃培养24 h,菌落为圆形,白色,半透明,光滑湿润,稍隆起。菌株5`MS可以分解葡萄糖、蔗糖、麦芽糖和甘露糖。菌株5`MS马尿酸盐、甲基红、硝酸盐还原、丙二酸盐、明胶液化、西蒙氏枸橼酸盐、氧化酶和硫化氢测定结果均为阴性。
图1 菌株5`MS革兰氏染色结果(×1 000)Fig.1 Gram staining micrograph of strain 5`MS
2.3 菌株5`MS的16S rDNA序列分析
图2中目的条带清晰明亮。将16S rDNA 的PCR产物与E.coli DH5α 感受态细胞连接培养后,挑取转化成功的菌落进行PCR,结果(图3)表明,条带单一、明亮,且无特异性条带,其长度约为1.4 kb。

图2 菌株5`MS的总DNA电泳结果Fig.2 Electrophoresis result from total DNA of strain 5`MS
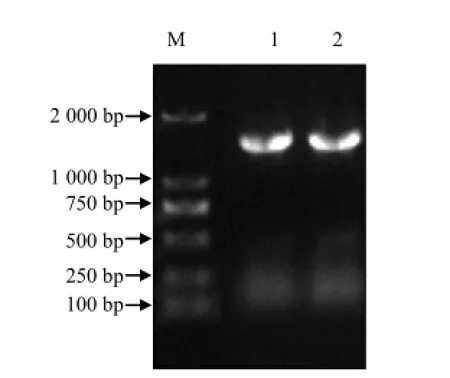
图3 菌株5`MS的16S rDNA PCR电泳结果Fig.3 PCR result of 16S rDNA from strain 5`MS
经测序分析,菌株5`MS的序列长度为1 422 bp。将其序列与GenBank中细菌的16S rDNA序列进行比对,用 Lasergene软件包中的 Editseq和Phylip-3.69构建的系统发育树见图4。该序列与芽孢杆菌属(Bacillus)的亲缘关系最为接近,保守区相似性为99%。结合菌体形态特征和生理生化特性,确定该菌株为芽孢杆菌属(Bacillus)的新菌株,并将其命名为芽孢杆菌5`MS (Bacillus sp. 5`MS)。

图4 根据16S rDNA 序列构建的系统发育树Fig.4 Phylogenetic tree from 16S rDNA sequences
2.4 pH和温度对菌株5`MS芽孢漆酶活性的影响
在30 ℃条件下,通过调节0.1 mol/L柠檬酸和0.2 mol/L磷酸氢二钠的比例来配置不同 pH缓冲液。如图5所示,以ABTS为底物时,pH 3.0条件下芽孢漆酶的活性最强;pH为3.0~6.0时芽孢漆酶的活性呈下降趋势。以SGZ为底物时,以pH达6.6时芽孢漆酶的活性最强,因此,菌株5`MS芽孢漆酶对ABTS的最适反应pH为3.0,对SGZ的最适pH为6.6。在最适pH条件下,由图6可知,该芽孢漆酶在30~70 ℃均具有良好的活性,其中70℃左右漆酶活性达最大值;当温度升高到100 ℃时,该酶仍具有34.61%的活性。可见,菌株5`MS的芽孢漆酶具有良好的耐热性。
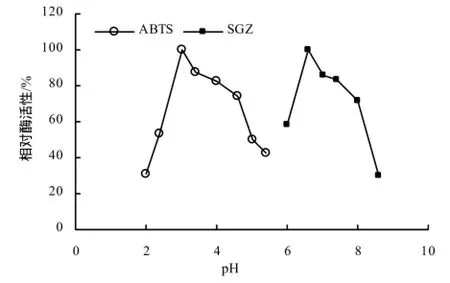
图5 不同pH下菌株5`MS芽孢漆酶的相对酶活性Fig.5 Relative enzyme activity of spore laccase in strain 5`MS under different pH
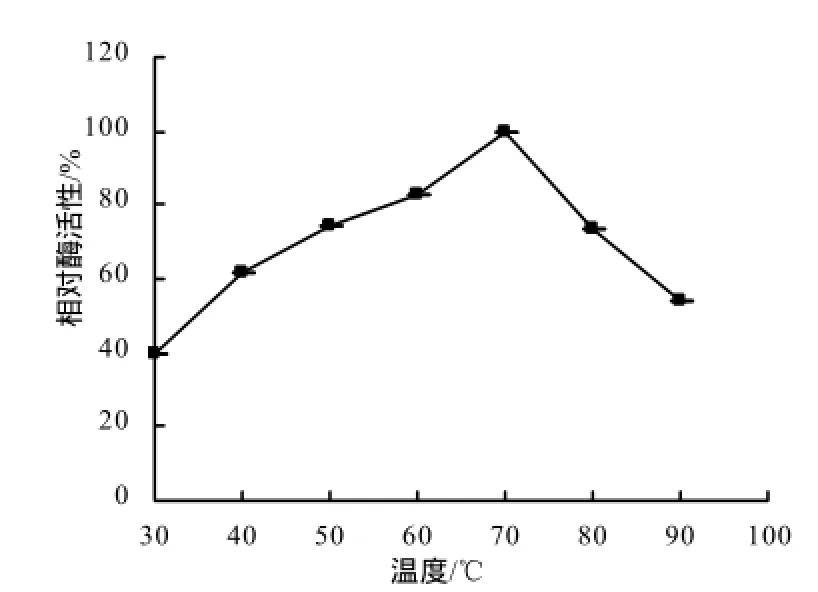
图6 不同温度下菌株5`MS芽孢漆酶的相对酶活性Fig.6 Relative enzyme activity of spore laccase in strain 5`MS under different temperatures
2.5 菌株5`MS芽孢漆酶对染料脱色的影响
当不含介体ACE时,菌株5`MS芽孢漆酶仅对结晶紫(CV)有脱色效果,1 h后脱色率为63.06%,对染料活性亮蓝(RBBR)、活性黑(RB5)和靛红(IC)均无脱色作用。当在脱色体系中加入0.1 mmol/L 介体ACE、pH为6.0的情况下,菌株5`MS的芽孢漆酶对活性亮蓝、活性黑、靛红及结晶紫均有脱色作用,在1 h内对活性黑、靛红和结晶紫的脱色率达92%以上(图7),而菌株Bacillus sp.CLb在4 h内对靛红和活性黑的脱色率仅为81%和85.3%[17]。经过4 h,菌株5`MS芽孢漆酶对RBBR的脱色率达80%以上(图8)。
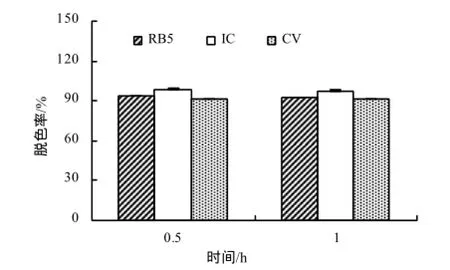
图7 菌株5`MS对3种染料的脱色率Fig.7 Decolorization rate of three dyes by bacterial strain 5`MS
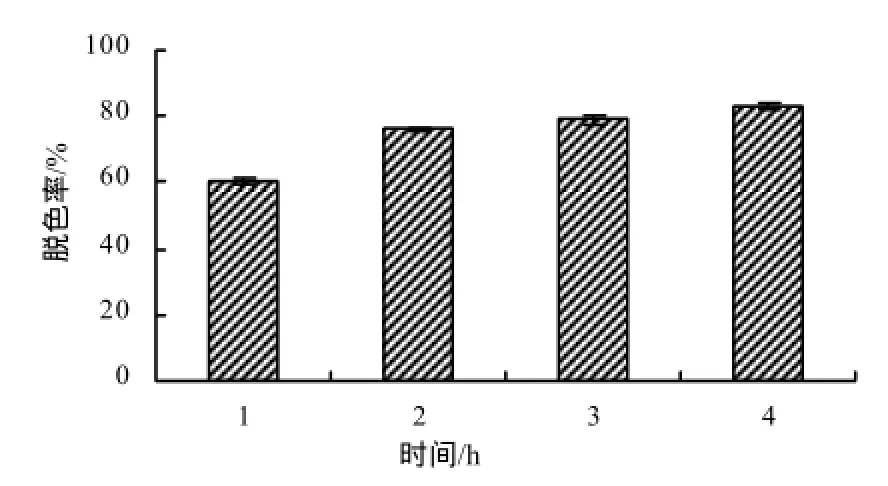
图8 菌株5`MS对活性亮蓝的脱色率Fig.8 Decolorization rate of RBBR by bacterial strain 5`MS
3 结论与讨论
利用含铜离子的富集培养基筛选出漆酶活性较高的细菌菌株,并测定了菌株的形态学及生理生化特征,分析了菌株的16S rDNA序列,初步确定该株细菌在分类上属于芽孢杆菌属(Bacillus)。该菌株的漆酶活性较高,并对蒽醌(活性亮蓝)、偶氮(活性黑)、靛蓝(靛红)以及三氯甲烷(结晶紫)类染料具有明显的脱色效果。
细菌漆酶的耐热性比真菌漆酶强,能适应碱性条件,稳定性好,而大多数真菌漆酶的最适pH为酸性范围[22],例如双孢蘑菇(Agarigusbisporus)漆酶的最适反应 pH 值为 5.0,在碱性条件下漆酶迅速失活[23]。王祎宁[24]发现丝孢菌(Monodictys asperospera)漆酶的最适反应pH为6.6,当pH 8.0时酶活下降53.06%;当pH 9.0 时几乎没有漆酶活性。本研究中筛选的细菌5`MS芽孢漆酶可在碱性条件下催化底物丁香醛连氮,在pH 8.0时漆酶活性仍保留71.26%。大多数工业废水和染料废水的pH值一般在碱性范围内,菌株5`MS芽孢漆酶在碱性环境以及高温环境下较为稳定,因此,该菌株在处理碱性工业废水上具有较好的应用前景。将介体加入漆酶脱色体系可以极大地扩大其作用的底物范围,同时促进更多难氧化有机物的氧化分解,在环境污染治理上具有重要用途[25]。解淀粉芽孢杆菌LC03 (Bacillus amyloliquefaciens LC03)在pH为6.8]的条件下,当脱色体系中含有乙酰丁香酮(ACE)时,该漆酶对这4种染料的脱色率为60%以上[26-27]。本研究中选取蒽醌(活性亮蓝)、偶氮(活性黑)、靛蓝(靛红)以及三氯甲烷(结晶紫)等4种类型染料,在介体乙酰丁香酮(ACE)的参与下,菌株 5`MS的芽孢漆酶均对活性黑,靛红和结晶紫脱色有明显的效果,在1 h内的脱色率均高达92%以上。可见,该芽孢漆酶在工业染料废水的处理上具有较好的应用潜能。
[1] Widstein P,Kandelbauer A.Laccase application in the forest products industry:a review[J].Enzyme and Microbiol Technol,2008,42:293-307.
[2] Hoegger P J,Kilaru S,James T Y,et al.Phylogenetic comparison and classification of laccase and related multicopper oxidase protein sequences[J].FEBS,2006,273:2308-2326.
[3] Alexandre G,Zhulin IB.Laccases are widespread in bacteria[J].Trends in Biotechnology,2000,18:41-42.
[4] Sharma P,Goel R,Capalash N.Bacterial laccases[J]. Microbiol Biotechnol,2007,23:823-832.
[5] Martins L O,Soares C M,Pereira M M,et al.Molecular and biochemical characterization of a highly stable bacterial laccase that occurs as a structural component of the Bacillus subtilis endospore coat[J].Biol Chem,2002,277(21):18849-18859.
[6] Baldrian P.Fungal laccases-occurrence and properties[J]. FEMS Microbiol,2006,30(2):215-242.
[7] Koschorreck K,Richter S M,Ene A B,et al.Cloning and characterization of a new laccase from Bacillus licheniformis catalyzing dimerization of phenolic acids[J]. Microbiol Biotechnol,2008,79(2):217-224.
[8] Koschorreck K,Schmid R D,Urlacher V B.Improving the functional expression of a Bacillus licheniformis laccase by random and site-directed mutagenesis[J]. BMC Biotechnol,2009,9(12):3-6.
[9] Desai SS,Nityanand C.Microbial laccases and their applications:a review[J].Biotechnol,2011,3(2):98-124.
[10] Husain Q.Potential applications of the oxidoreductive enzymes in the decolorization and detoxification of textile and other synthetic dyes from polluted water:areview[J].Critical Reviews in Biotechnol,2006,26 (4):201-221.
[11] 许玫英,郭俊,岑英华,等.染料的生物降解研究[J].微生物学通报,2006,33(1):138-143.
[12] Saratale G,Kalme S,Bhosale S,et al.Biodegradation of kerosene by Aspergillus ochraceus NCIM-1146[J].J Basic Microbiol,2007,47(5):400-405.
[13] Kandelbauer A,Gübitz G M.Bioremediation for the decolorization of textile dyes-A review[J]. Environmental Chemistry,2005:269-288.
[14] Itoh K,Yatome C,Ogawa T.Biodegradation of anthraquinone dyes by Bacillus subtilis[J].Bulletin of Environmental Contamination and Toxicology,1993,50:522-527.
[15] Suzuki Y,Yoda T,Ruhul A,et al.Molecular cloning and characterization of the gene encoding azoreductase from Bacillus sp.OY 1-2 isolated from soil[J].Journal of Biological Chemistry,2001,246:9059-9065.
[16] Yatome C,Ogawa T,Matsui M.Degradation of Crystal violet by Bacillus subtilis[J].Environmental Science and Health,1991,26:75-87.
[17] 李凡姝,刘海洋,戴绍军,等.高产漆酶菌株Bacillus sp.CLb的筛选及其对染料脱色的研究[J].安徽农业科学,2014,42(15):4569-4572.
[18] 东秀珠,蔡妙英.常见细菌系统鉴定手册[K].北京:科学出版社,2001:364-399.
[19] 赵斌,何绍江.微生物学实验[M].北京:科学出版社,2002:172-173.
[20] 李淑彬,陈振军,丘李莉,等.蜡状芽抱杆菌菌株Jp-A的分离鉴定及其降解酚特性[J].应用生态学报,2006,17(5):920-924.
[21] Goldman R C,Tipper D J.Bacillus subtilis spore coats:complexity and purification of an unique polypeptide component[J].Biotechnol,1978,135(3):1091-1106.
[22] 焦振泉,刘秀梅,孟昭赫.16S rRNA序列同源性分析与细菌系统分类鉴定[J].国外医学卫生学分册,1998,25:12-18.
[23] Baldrian P.Fungal laccases-occurrence and properties[J]. FEMS Microbiol,2006,30(2):215-242.
[24] 刘新颖,朱启忠,赵春媛,等.双孢菇漆酶酶学性质及染料脱色初探[J].北方园艺,2010(14):182-183.
[25] 王祎宁.高产漆酶丝孢菌的筛选及漆酶酶学性质的初步研究[D].北京:北京林业大学,2009:20-24.
[26] Majeau J A,Brar S K,Tyagi R D.Laccases for removal of recalcitrant and emerging pollutants[J].Bioresour Technol,2010,101(7):2331-2350.
[27] 栗君,李国富.解淀粉芽孢杆菌芽孢漆酶在染料脱色中的应用[J].北京林业大学学报,2013,35(2):125-129.
责任编辑:王赛群
英文编辑:王 库
中图分类号:X172
文献标志码:A
文章编号:1007-1032(2016)01-0085-06
收稿日期:2015-03-07 修回日期:2015-11-23
基金项目:国家自然科学基金项目(31170553);国家林业局“948”项目(2012-04-03);黑龙江省博士后资助项目(LBH-Z11254)
作者简介:汪春蕾(1972—),女,黑龙江省肇东市人,博士研究生,副教授,主要从事环境微生物学研究,wcls-1972@163.com和高效性越来越受到人们的关注。生物处理法主要是利用漆酶等微生物转化酶,通过吸附或降解去除废水中的染料[12]。漆酶和漆酶-介体体系能广泛降解芳香族化合物[13],是治理染料废水最有潜力的物质之一。虽然已有关于细菌菌株能使蒽醌[14]、偶氮[15]和三苯甲烷[16]类染料脱色的报道,但关于能够同时使3种染料脱色的细菌菌株鲜见报道。笔者从东北林业大学实验林场蒙古栎林下的土壤中筛选出具有漆酶活性的菌株 5`MS,通过鉴定,确定其为芽孢杆菌属新菌株,并就该菌株芽孢漆酶对常用染料的脱色效果进行了研究,现将结果报道如下。
Isolation of strain Bacillus and the effects of its spore laccase on dye decoloration and degradation
Wang Chunlei, Li Fanshu, Sun Haiqiong, Zhao Min, Su Qiuyu, Qi Xuhui
(College of Life Sciences, Northeast Forestry University, Heilongjiang 150040, China)
Abstract:Enrichment medium added with copper ions was used to screen and isolate bacteria with laccase activity from soil at Quercus mongolica forest in northeast forestry university. The strain was identified as Bacillus sp. 5`MS judged from morphological, physiological and biochemical characteristics as well as from 16S rDNA sequence analysis. Its spore laccase activity was 56.73 U/g calculated by dry weight in syringaldazine as substrate. The optimum pH for its activity was 6.6 and the optimum reaction temperature was 70 ℃. Even though the temperature was enhanced to 100 ℃, the spore laccase activity of strain 5`MS could remain 34.61% of that in the optimal condition. The spore laccase could decolorize more than 92% of reactive black 5(RB5), indigo carmine (IC) and crystal violet (CV) in 1 hour,and 82.8% of reactive brilliant blue R in 4 hours at the condition of acetosyringone as the mediator.
Keywords:Bacillus; spore laccase; dye decolorization

