坎地沙坦酯片的溶出度测定
谢万清(海南美兰史克制药有限公司 海口 570216)
坎地沙坦酯片的溶出度测定
谢万清(海南美兰史克制药有限公司海口570216)
摘要:目的:建立坎地沙坦酯片的溶出度试验方法。方法:采用C18色谱柱,乙腈-水-醋酸(68∶32∶1)为流动相,检测波长为254nm。结果:坎地沙坦酯在5.0~15.0μg/mL浓度范围内线性关系良好(r=0.9999),片剂的平均回收率为99.4%(RSD 0.8%)。
关键词:坎地沙坦酯 溶出度 高效液相色谱法
坎地沙坦酯(Candesartan Cilexetil)是一种血管紧张素II受体(AT)拮抗剂(ARBs),是继血管紧张素转化酶抑制剂(ACEI)后又一类新型降压药。该药可阻滞产生于血管紧张素II(AngII)的有害作用,适应症包括充血性心力衰竭(CHF)、动脉粥样硬化(AS)、心肌梗死、左心室肥厚(LVH)、糖尿病肾病、代谢综合征以及ACEI引起咳嗽的高血压。
坎地沙坦酯在水中不溶,在强酸、强碱条件下发生酯水解,故制剂的溶出度成为药物吸收、发挥疗效的限制因素。本文对坎地沙坦酯片的溶出度从各方面进行考察并验证,建立准确的溶出度测定方法,保证其用药安全有效。
1仪器及试药
RCZ-8型药物溶出度仪(黄海药检仪器有限公司);LC-20AT型高效液相色谱仪(岛津公司)。
坎地沙坦酯工作对照品(批号:D20100813,含量99.69%);坎地沙坦酯片(商品名:必洛斯,规格8mg,批号:020A)由天津武田药品有限公司提供;坎地沙坦酯片(规格8mg,批号:20101004、20101005、20101006)由海南美兰史克制药有限公司提供。
2测定方法与结果
2.1色谱条件:参考坎地沙坦酯片JX20000248质量标准中的溶出度测定条件:色谱柱C18(4.6mm×150mm,5μm),乙腈-水-醋酸(68∶32∶1),流速:1mL/min,检测波长254nm,理论板数按坎地沙坦酯峰计算不低于3000。
2.2溶出度测定方法:参考坎地沙坦酯片JX20000248质量标准中的溶出度测定条件,分别进行溶出介质的选择、转速的选择和时间的选择等试验后初步确立本品的溶出度测定方法:照溶出度测定法第二法,以1%聚山梨酯20溶液900mL为溶剂,转速为每分钟50转,依法操作,经45min,取溶液10mL,离心,取上清液作为供试品溶液。另精密称取坎地沙坦酯对照品约50mg,置50mL量瓶中,加乙腈溶解并稀释至刻度,摇匀;精密量取此溶液5mL,置50mL量瓶中,加乙腈稀释至刻度,摇匀;再精密量取此溶液5mL,置100mL量瓶中,用1%聚山梨酯20溶液稀释至刻度,摇匀,作为对照品溶液。取上述两种溶液各10μL,照含量测定项下规定的色谱条件进行测定,按外标法以峰面积计算出每片的溶出量。限度为标示量的75%,应符合规定。
3分析方法的验证与结果
3.1系统适用性:依法制备成对照品溶液,依法操作,取10μL注入液相色谱仪,连续进样5次,结果理论板数大于3000,分离度大于1.5,重复性的RSD值<2.0%,本色谱条件的系统适用性较好,能满足溶出度测定的要求。
3.2专属性试验:取处方量空白辅料适量及20101004批样品,照溶出度测定方法依法操作,结果空白辅料在主峰位置处无吸收,对坎地沙坦酯的溶出度测定不产生干扰,本检测方法的专属性较好。3.3线性试验:精密称取坎地沙坦酯工作对照品约50mg,置50mL量瓶中,加乙腈溶解并稀释至刻度,摇匀;精密量取此溶液5mL,置50mL量瓶中,加乙腈稀释至刻度,摇匀,滤过,作为贮备液;再分别精密量取此溶液2.5mL、4.0mL、5.0mL、6.0mL、7.5mL,分别置50mL量瓶中,用1%聚山梨酯20溶液稀释至刻度,摇匀。依法进行测定,并以浓度C为横坐标,以峰面积A为纵坐标进行线性回归,得方程A=21697.17C-1516.52,r=0.9999。表明坎地沙坦酯在5.0~15.0μg/mL浓度范围内时,峰面积A与浓度C线性关系良好。
3.4精密度试验:取线性试验中的10.0μg/mL的对照品溶液,重复进样6次,6次峰面积的RSD为0.3%。
3.5重复性试验:分别精密称取坎地沙坦酯工作对照品6份,每份约50mg,置50mL量瓶中,加乙腈溶解并稀释至刻度,摇匀;精密量取此溶液5mL,置50mL量瓶中,加乙腈稀释至刻度,摇匀;再精密量取此溶液5mL,置50mL量瓶中,用1%聚山梨酯20溶液稀释至刻度,摇匀。依法进行测定,结果6份样品其A/M 的RSD为0.5%。
3.6溶液稳定性试验:取20101004批溶出度测定项下的供试品溶液1份,室温下放置,分别于0、1、2、4、6、8、10、12h取样,依法进行测定,结果峰面积基本无变化,其峰面积的RSD为0.8%。3.7回收率试验:按处方量50%、80%、100%,分别精密称取坎地沙坦酯工作对照品适量,每组各三份样品;再按处方比例分别称取辅料适量,混合均匀,置50mL量瓶中,加乙腈溶解并稀释至刻度,摇匀;精密量取此溶液5mL,置50mL量瓶中,加乙腈稀释至刻度,摇匀;再精密量取此溶液5mL,置50mL量瓶中,用1%聚山梨酯20溶液稀释至刻度,摇匀。另取坎地沙坦酯工作对照品适量,依法操作,结果平均回收率为99.4%,RSD为0.8%。
3.8溶出均一性及相似性研究:取中试3批样品及坎地沙坦酯片上市样品,以1%聚山梨酯20溶液900mL为溶出介质,在同一台仪器上分别于5min、10min、15min、30min、45min、60min取样进行检测,依法操作。
为考察中试三批样品和国内上市样品与原研上市样品的溶出的相似性,以原研上市样品作参比制剂,以中试三批样品和国内上市样品作受试制剂,以溶出均一性累计数据计算f2相似因子。f2=50×log{[1+错误!]-0.05×100(}说明:n为时间点个数;Rt为参比制剂平均累计释放度;Tt为受试制剂平均累计释放度),计算结果如下:

批号 20101004 20101005 20101006 f2值 78.2 77.5 77.4
试验结果表明,以原研上市样品做参比,中试三批样品的f2值均>50,表明中试三批样品与原研上市样品有较好的相似性。3.9不同溶出介质的对比研究:选取20101004批中试样品与原研上市样品(必洛斯),分别于0.1mol/L盐酸、醋酸盐缓冲液(pH4.0)、磷酸盐缓冲液(pH6.8)、水(每种介质均含1%聚山梨酯20溶液)四种溶出介质条件下,在同一台仪器上分别于5min、10min、15min、30min、45min、60min取样,依法操作。以原研上市样品(必洛斯)做参比,中试样品的f2值>50,表明中试样品与原研上市样品在不同的溶出介质条件下有较好的相似性。结果如下:
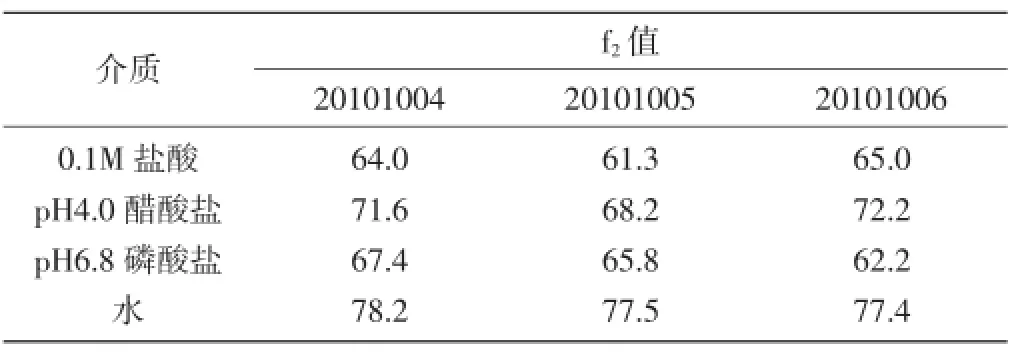
介质 f2值20101004 20101005 20101006 0.1M盐酸pH4.0醋酸盐pH6.8磷酸盐水64.0 71.6 67.4 78.2 61.3 68.2 65.8 77.5 65.0 72.2 62.2 77.4
4结论
有文献报道坎地沙坦酯片的溶出度可采用紫外分光光度法进行检测,但考虑到本品的规格较小、辅料较多、液相法的专属性,强故选择液相法进行检测。
坎地沙坦酯片经上述一系列的试验如线性、精密度、重复性、溶液稳定性、回收率、溶出均一性及相似性等方法学验证,结果满意,此方法适用于坎地沙坦酯片的溶出度测定。
参考文献
[1]彭兴盛,陈祝康.坎地沙坦酯片及胶囊的溶出度测定[J].中国医药工业杂志,2004,35(10):611-612.
[2]李冬华.坎地沙坦治疗高血压的临床研究[J].实用心脑血管病杂志,2010,18(5):621.
[3]刘桂芹.坎地沙坦的临床应用及其研究进展[J].现代中西医结合杂志,2009,18(36):4592-4593.
[4]坎地沙坦酯西酯片(必洛斯)质量标准JX20000248.
·药物与临床·
中图分类号:R927.1
文献标识码:A
文章编号:1672-8351(2016)07-0017-02

