腺病毒介导GFP基因标记人脂肪来源干细胞可行性研究
阳水发, 易阳艳, 黄 艳, 吴 舒, 王朝慧
实验研究
腺病毒介导GFP基因标记人脂肪来源干细胞可行性研究
阳水发, 易阳艳, 黄 艳, 吴 舒, 王朝慧
目的 研究腺病毒介导绿色荧光蛋白(GFP)基因标记人脂肪来源干细胞(ADSCs)的可行性。方法 通过酶消化法获取人ADSCs,采用流式细胞术检测表面标记物以及成脂分化诱导进行鉴定。将Ad-GFP通过不同感染复数(MOI分别为25、50、100)转染ADSCs,观察各组转染效率,找出最适合的转染条件。观察GFP标记ADSCs后随时间衰减速率,确定标记效果的维持时间。结果 获取的细胞高表达CD49d、CD90、CD105,不表达CD34、CD45、CD106,经成脂诱导2周现脂滴,油红O染色成红色,符合ADSCs的多种特性。MOI分别以25、50、100转染后,转染效率分别为(77.3±4.2)%、(94.7±3.2)%、(96.3±3.0)%,MOI=50为转染的适宜条件。GFP标记ADSCs后,在2周内的标记率仍可高达55.0%,至4周后则衰减至17.0%。结论 本研究提示通过腺病毒能够高效地介导GFP基因导入ADSCs,快速表达出蛋白产物,维持2~4周的标记示踪效果。
脂肪来源干细胞; 腺病毒; 绿色荧光蛋白; 标记; 转染
脂肪组织中含有大量的具有多向分化潜能的脂肪来源干细胞(adipose-derived stem cells, ADSCs)[1]。由于其数量多获取容易,使之成为理想的多能干细胞来源。作为一种间充质干细胞,研究证实,ADSCs不仅具有强大的多向分化潜能[2-4],还能合成分泌多种促血管形成细胞因子[5-6]。ADSCs因其优良的间充质干细胞特性,使其在组织工程构建[7]以及干细胞治疗等领域的探索成为研究热点。绿色荧光蛋白(green fluorescent protein, GFP)具有高效的荧光效应,通过适当的载体将GFP基因导入细胞,其表达的GFP将具有标记示踪作用。腺病毒是目前进行基因修饰较为常用的基因载体,通过其介导GFP基因导入ADSCs有可能是适宜选择。自2015年3月,南昌大学第二附属医院医疗美容科主要就腺病毒介导GFP标记ADSCs的效率进行评价,摸索合适的转染条件,并明确标记随时间衰减的速率。
1 对象与方法
1.1 组织来源
脂肪组织取自本科室健康成年女性腹部吸脂术后废弃脂肪,术前征得患者同意并签署知情同意书。
1.2 主要试剂与仪器
低糖DMEM培养基、FBS、0.25%胰蛋白酶-0.02% EDTA(美国GIBCO公司);Ⅰ型胶原酶、地塞米松、胰岛素、3-异丁基-1-甲基黄嘌呤(IBMX)、吲哚美辛、油红O染色剂、纤维蛋白原、凝血酶(美国SIGMA公司);鼠抗人CD34、CD45、CD49d、CD90、CD105、CD106多克隆抗体(美国EBIOSCIENCE公司);腺病毒载体Ad-GFP(上海汉恒生物);携带GFP基因的腺病毒(adenovirus- green fluorescent protein, Ad-GFP;上海汉恒生物);倒置相差显微镜、荧光倒置显微镜(日本OLYMPUS公司);流式细胞仪(美国BD公司)。
1.3 ADSCs的分离培养与鉴定
1.3.1 ADSCs的获取 取健康成人吸脂术后的脂肪组织10 ml,加入等体积1.0 mg/ml的Ⅰ型胶原酶溶液,混匀后37℃恒温水浴消化40 min,定时摇匀;1000 r/min离心5 min,去除上层油脂及液体成分,加入完全培养基重悬后200目滤网过滤;再次离心,10%FBS低糖DMEM培养基重悬后细胞计数,调整细胞浓度为(5~10)×105/L, 接种至25 cm2培养瓶中,37 ℃、5%CO2孵箱中培养。48 h后首次换液,待细胞80%融合后按1∶2胰蛋白酶消化传代。每天以倒置相差显微镜观察细胞形态和生长状况,传至第3代供实验用。
1.3.2 流式细胞术检测ADSCs表面抗原 取第3代ADSCs, 胰蛋白酶消化,离心5 min,1000 r/min,弃上清液,加少量PBS吹打均匀;调整细胞密度为1×109/L,将细胞悬液移入EP管(100 μl/管),每管分别加入2种不同荧光素标记的流式抗体各5 μl,以同型PE-IgG和FITC-IgG抗体为阴性对照;室温避光孵育30 min,PBS洗涤2次以去除未结合的抗体;离心弃上清液后每管加500 μl PBS重悬均匀,行双荧光标记检测。
1.3.3 ADSCs的成脂诱导和油红O染色 取第3代ADSCs, 胰蛋白酶消化, 接种到置有盖玻片的6孔培养板上,待细胞贴壁融合较多时,将培养基更换为成脂诱导培养基(高糖DMEM,10%FBS,1 μmol/L地塞米松,10 μmol/L胰岛素, 0.5 mmol/L IBMX,200 μmol/L吲哚美辛),阴性对照用10%FBS的完全培养基培养,每周换液2、3次;定期观察细胞形态变化,培养2周后取细胞爬片;PBS清洗后4%多聚甲醛固定5 min,洗涤后加入油红O工作液染色15 min;PBS洗涤2次后行显微镜观察。
1.4 Ad-GFP转染ADSCs效率
将状态良好的第3代ADSCs胰酶消化,离心洗涤,加入完全培养基重悬,按1∶2传代比例接种于6孔板,加完全培养基培养至细胞融合接近于80%,细胞计数板计数单孔细胞数。根据细胞计数,按感染复数(MOI)25、50、100计算每孔加入Ad-GFP(病毒滴度为1×1010pfu/ml)的体积,补加半量培养基2 h后换液,置于孵箱常规培养。转染后每24 h观察荧光强度,48 h时各组随机选取3个高倍镜视野统计绿色荧光标记率。将MOI为50的转染细胞消化,重悬后通过流式细胞术检测绿色荧光标记率。
1.5 GFP标记ADSCs后随时间衰减速率
将MOI=50的转染细胞继续置于孵箱常规培养,3 d换液1次。在转染后1、2、4周分别用荧光显微镜观察荧光强度。每次重复3个高倍显微镜视野统计绿色荧光标记率。
1.6 统计学处理

2 结果
2.1 ADSCs光镜下形态学观察
原代细胞需要约7 d融合至90%,传代后生长迅速。至第3代ADSCs形态稳定,为典型的成纤维细胞样形态,呈细长梭形,有粗大的分支,细胞生长密集时呈现漩涡性(图1)。
2.2 流式细胞术检测ADSCs表面抗原表达结果
选取的第3代ADSCs经6种流式抗体结合后上机检测,结果显示,ADSCs高表达CD49d、CD90、CD105,不表达或极低表达CD34、CD45、CD106。
2.3 ADSCs的成脂诱导和油红染色结果
ADSCs在成脂诱导培养基中培养3 d后见透亮脂滴开始增多变大。诱导2周后脂滴形成较多,融合为较大脂滴,经油红O染色可见脂滴被染成红色(图2)。
2.4 Ad-GFP转染ADSCs效率
Ad-GFP按MOI分别为25、50、100转染ADSCs后48 h,在荧光显微镜下即可观察到强度较高的绿色荧光。随MOI值增大,表达绿色荧光细胞数增多,荧光强度亦增强。通过计数得出的绿色荧光标记百分率分别为77.3%±4.2%、94.7%±3.2%、96.3%±3.0%。MOI=50的转染细胞经流式细胞术检测GFP标记率为95.4%,与计数所得数值吻合,显示MOI=50时转染效率已经很高,几乎所有ADSCs都成功标记,继续增大MOI值对标记率增加有限。见图3。
2.5 GFP标记ADSCs后随时间衰减速率
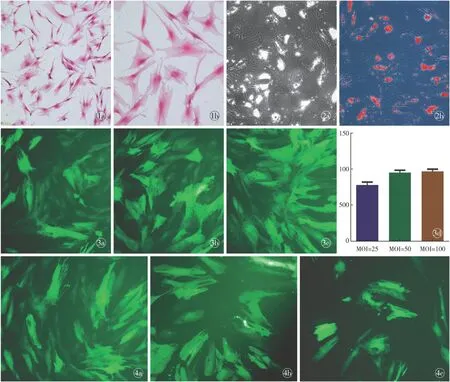
图1 第3代ADSCs苏木精-伊红染色观察(倒置相差显微镜) a.×100 b.×200 图2 ADSCs成脂诱导2周油红O染色(倒置相差显微镜 ×200) a. 染色前 b. 染色后 图3 Ad-GFP转染ADSCs效率 a. MOI=25 b. MOI=50 c. MOI=100 d. 标记阳性率 e. MOI=50流式细胞术检测标记率 图4 GFP标记ADSCs后,随时间衰减速率 a. 1周 b. 2周 c. 4周
Fig 1 ADSCs at 3 passages stained by hematoxylin eosin stain (Inverted phase contrast microscope). a.×100. b. ×200. Fig 2 ADSCs induced by adipogenic differentiation at 2weeks stained with Oil red O (Inverted phase contrast microscope ×200). a. before staining. b. after staining. Fig 3 Transfection efficiency of ADSCs infected with Ad-GFP. a. MOI=25. b. MOI=50. c. MOI=100. d. marking of positive rate. e. the percentage of labeled cells of MOI=50 by the flow cytometry. Fig 4 The attenuation rate after ADSCs labeled by GFP. a. 1 week. b. 2 week. c. 4 week.
腺病毒介导GFP导入ADSCs后,GFP荧光标记率随时间延长而减退。转染1周后,标记率为83.3%;转染2周后,标记率为55.0%;转染4周后,标记率为17.0%。见图4。显示腺病毒介导GFP转染ADSCs后,在2周内的标记率仍然较高,至4周后,标记率则衰减至较低水平。
3 讨论
在诸如组织工程构建和干细胞治疗研究中,我们需要对干细胞进行标记示踪,以此研究干细胞在活体组织器官中的定植和分化转归等机制[8]。目前对于干细胞标记的方法有多种,对ADSCs的标记需要满足一定的条件,如高效、稳定、安全、简便。GFP基因是科研工作中常用的报告基因[9]。在转染过程中,常作为间接提示目的基因导入细胞效率的标记。通过转染载体介导GFP基因导入ADSCs,使GFP基因在ADSCs一定时期内稳定表达,通过荧光激发可以进行活体成像和组织切片的荧光分析,因而能对ADSCs进行标记示踪。
目前常用的基因转染载体包括病毒载体和脂质体载体。病毒载体具有转染效率高,携带基因较大,对宿主细胞毒性低的特点,在当前的科研领域应用普遍。腺病毒是病毒转染中最常用到的基因载体,其作为基因载体具有多重优势:转染效率高,基因导入宿主细胞后可大量表达;可转染非增殖期细胞;不整合入宿主染色体,不致基因突变[10-12]。通过腺病毒介导GFP基因标记ADSCs是一种合理方法。
本研究通过酶消化法从人脂肪组织中获取ADSCs,经过细胞形态学、流式细胞术对细胞表明标记物检测、成脂分化诱导进行鉴定。鉴定结果表明,符合ADSCs的相关特征。根据预实验,我们将Ad-GFP以感染复数(MOI)为25、50、100感染ADSCs。GFP基因通过腺病毒导入细胞后,24 h即观察到少量绿色荧光,48~72 h有高强度的绿光荧光,这说明通过重组腺病毒成功将GFP基因导入ADSCs,并且通过成功转录表达出GFP。在48 h时荧光照片显示,MOI值增大,表达绿色荧光的细胞增多。MOI=50时,流式细胞术精确检测显示标记率达到95%以上,而再次提高感染复数,GFP标记率增加空间较小,说明Ad-GFP以感染复数为50即已达到理想的标记率。
腺病毒作为基因载体转染的一个特点是基因不整合到宿主细胞的基因组中,因而不产生突变致癌的作用,这也决定了腺病毒介导基因转染属于瞬时转染,目的基因只能在一定时期内维持表达,之后表达逐渐消失。本研究表明,腺病毒介导GFP标记ADSCs能维持2~4周的示踪效果,在2周内具有较好的标记效果,超过1个月则标记效果较差。
总之,本研究提示通过腺病毒能够高效地介导GFP基因导入人ADSCs,并且进入细胞的GFP基因能够快速表达出大量蛋白产物,发挥对人ADSCs的标记作用,且能维持2~4周的标记示踪效果。本研究的结果可以为人ADSCs的后续研究提供一种高效稳定的标记示踪方法,如在组织工程中研究ADSCs的分化转归,以及在干细胞治疗中研究ADSCs的定植分布等。同时,本研究亦提示腺病毒能高效率的介导目的基因导入人ADSCs,导入基因后能在较长时间内持续过表达,因而可为人ADSCs的基因修饰提供可行的技术方式。
[1] Mizuno H, Tobita M, Uysal AC. Concise review: Adipose-derived stem cells as a novel tool for future regenerative medicine[J]. Stem Cells, 2012,30(5):804-810.
[2] 高 宇, 余庆雄, 李青峰. 脂肪干细胞体外诱导分化的研究进展[J]. 组织工程与重建外科杂志, 2014(2):106-109.
[3] Li Q, Qi LJ, Guo ZK,et al. CD73+ adipose-derived mesenchymal stem cells possess higher potential to differentiate into cardiomyocytes in vitro[J]. J Mol Histol, 2013,44(4):411-422.
[4] Kajiyama H, Hamazaki TS, Tokuhara M, et al. Pdx1-transfected adipose tissue-derived stem cells differentiate into insulin-producing cells in vivo and reduce hyperglycemia in diabetic mice[J]. Int J Dev Biol, 2010,54(4):699-705.
[5] Zhu M, Zhou Z, Chen Y, et al. Supplementation of fat grafts with adipose-derived regenerative cells improves long-term graft retention[J]. Ann Plast Surg, 2010,64(2):222-228.
[6] Hsiao ST, Lokmic Z, Peshavariya H, et al. Hypoxic conditioning enhances the angiogenic paracrine activity of human adipose-derived stem cells[J]. Stem Cells Dev, 2013,22(10):1614-1623.
[7] Verseijden F, Posthumus-Van SS, van Neck JW, et al. Comparing scaffold-free and fibrin-based adipose-derived stromal cell constructs for adipose tissue engineering: an in vitro and in vivo study[J]. Cell Transplant, 2012,21(10):2283-2297.
[8] 袁福康, 陆信武, 秦金保, 等. 双标记示踪脂肪来源干细胞治疗下肢缺血的研究[J]. 中华实验外科杂志, 2015,32(11):2676.
[9] 朱玉德, 代兴亮, 赵东亮, 等. 红色/绿色荧光蛋白示踪胶质瘤干祖细胞在肿瘤血管形成中的作用[J]. 中华实验外科杂志, 2013,30(2):297-299.
[10] Zheng YM, An ZX, Zhao XE, et al. Comparation of enhanced green fluorescent protein gene transfected and wild-type porcine neural stem cells[J]. Res Vet Sci, 2010,88(1):88-93.
[11] Tatineni S, Mcmechan AJ, Hein GL, et al. Efficient and stable expression of GFP through Wheat streak mosaic virus-based vectors in cereal hosts using a range of cleavage sites: formation of dense fluorescent aggregates for sensitive virus tracking[J]. Virology, 2011,410(1):268-281.
[12] 黄 懿, 韶云鹏, 丁留成, 等. 过表达整合素连接酶基因腺病毒体外转染骨髓间充质干细胞的研究[J]. 中华实验外科杂志, 2014,31(6):1373.
Feasibility study of Human adipose-derived stem cells marked with GFP gene mediated by adenovirus
YANGShui-fa,YIYang-yan,HUANGYan,WUShu,WANGZhao-hui.
(DepartmentofPlasticSurgery,SecondAffiliatedHospitalOfNanchangUniversity,Nanchang330006,China)
YIYang-yan,Email:yyy0218@126.com
Objective To research the feasibility of human adipose-derived stem cells (ADSCs) marked with green fluorescent protein (GFP) gene mediated by adenovirus. Methods The ADSCs were harvested from human liposuction fat by enzymatic digestion, then identified by detecting surface antigens and inducing adipogenic differentiation. Next, the Ad-GFP was transfected to ADSCs through different MOI (25, 50, and 100). The transfection efficiency of each group was also observed to determine the optimal transfection conditions. Finally, maintenance time was determined by observing the attenuation rate after GFP gene marked ADSCs. Results The strong expression of the cells were CD49d, CD90 and CD105, while the negative expression were CD34, CD45 and CD106.Lipid droplets were generated at 2 weeks after adipogenic differentiation, and oil red O staining was positive, which was in accordance with a variety of characteristics of ADSCs. Transfection efficiency after different 25, 50, and 100 MOI were (77.3±4.2)%, (94.7±3.2)%, (96.3±3.0)% respectively, indicating that MOI=50 was the optimal condition. The transfection efficiencies of ADSCs marked by GFP were 55.0% at 2 weeks and 17.0% at 4 weeks. Conclusion This study suggests that adenovirus can efficiently mediate GFP gene into ADSCs and rapidly express the GFP gene, maintaining 2 to 4 weeks tracing effect to ADSCs.
Adipose-derived stem cells; Adenovirus; Green fluorescent protein; Mark; Transfection
江西省科技支撑计划(2010BSA15100) 作者单位:330006 江西 南昌,南昌大学第二附属医院 医疗美容科
阳水发(1989-),男,江西宜春人,硕士研究生.
易阳艳,330000,南昌大学第二附属医院 医疗美容科,电子信箱:yyy0218@126.com
10.3969/j.issn.1673-7040.2016.08.017
R318.08
A
1673-7040(2016)08-0495-04
2016-04-10)

