维甲酸通过抑制沉默调节因子1诱导P19细胞分化为神经细胞的机制
张俊士 王 琼 贺维亚 赵雪艳
(河南大学淮河医院神经内科,河南 开封 475000)
维甲酸通过抑制沉默调节因子1诱导P19细胞分化为神经细胞的机制
张俊士王琼贺维亚赵雪艳
(河南大学淮河医院神经内科,河南开封475000)
目的探讨维甲酸(RA)诱导P19向神经分化的潜在分子机制。方法适当浓度RA诱导P19细胞4 d,观察是否有神经细胞标志物β-Tubulin产生,同时观察对SIRT1和Notch1的影响。RT-PCR和Western印迹实验检测敲低SIRT1对β-Tubulin和Notch1的影响。Western印迹实验检测高表达Notch1是否对β-Tubulin表达水平产生影响。结果RA诱导P19细胞4 d内β-Tubulin表达水平逐渐升高,SIRT1和Notch1表达水平明显降低,表明RA在4 d内能够明显地刺激P19细胞向神经细胞方向分化,并能够抑制SIRT1和Notch1信号通路。敲低SIRT1后,与对照组比较诱导分化4 d后神经分化标志物β-Tubulin水平升高,Notch1水平下降。高表达Notch1组在诱导神经分化4 d后β-Tubulin水平相对较低。结论RA可能通过降低SIRT1而抑制Notch1信号通路,促使P19细胞向神经分化。
维甲酸;P19细胞;神经分化;SIRT1;Notch1
小鼠胚胎性癌细胞P19是McBurney等〔1〕从C3H/He雄性小鼠睾丸畸胎瘤中分离出来的,体外常用于探究胚胎分化发育分子机制。在设定浓度的全反式维甲酸(RA)的刺激下,P19细胞能够向多种类型的神经元和神经胶质细胞方向分化。沉默调节因子(SIRT)1在胚胎发育过程中起到重要作用〔2〕。Notch1信号通路对神经干细胞的分化起调控作用,Notch1上调对细胞分化起抑制作用,而下调则促进其分化〔3〕。本实验通过RA处理诱导P19细胞向神经分化,观察诱导的前4 d SIRT1和Notch1表达的变化,探讨SIRT1和Notch1是否参与RA诱导P19细胞向神经分化的过程。
1 材料和方法
1.1细胞及主要试剂P19细胞购于美国模式培养物保藏所(American Type Culture Collection)。α-MEM培养基和胎牛血清(FBS)购自美国Hyclone公司,0.25%胰蛋白酶和乙二胺四乙酸(EDTA)购自广州市达晖生物技术有限公司,RA购自美国Sigma公司,胰蛋白酶和青链霉素混合液购自美国Gibco公司,β-Tubulin抗体、SIRT1抗体、Notch1抗体、β-actin抗体、辣根过氧化物酶标记二抗购自美国Abcam公司,二喹宁甲酸(BCA)蛋白定量分析试剂盒和增强化学发光法(ECL)化学发光底物购自美国Thermo公司,二甲亚砜(DMSO)购自上海国药集团。
1.2主要仪器设备CO2培养箱购自德国NERAEVS公司,超净工作台购自上海跃进医疗器械厂,酶标仪购自美国Molecular Devices公司,电泳仪购自北京六一仪器厂。
1.3实验方法
1.3.1细胞培养及向神经细胞分化的诱导培养基为α-MEM培养基,其中包含10% FBS、100 U/ml链霉素和100 U/ml青霉素。P19细胞于37℃、5%CO2孵箱中贴壁培养,每隔2 d更换1次培养液。至细胞汇合达到90%,弃去旧培养基,用0.25%胰蛋白酶消化。计数后选取1×105个细胞/ml密度接种于含终浓度为0.5 μmol/L的RA培养基中,于37℃、5%CO2孵箱中诱导4 d,收集成团细胞用于免疫印迹和RT-PCR检测。诱导当天计为第1天,以此类推。
1.3.2细胞转染P19细胞转染pcDNA-Notch1前24 h使用胰酶消化、计数,以1×105/ml的密度接种于6孔板中培养,至细胞汇合至40%~50%时行细胞转染。转染严格依照试剂说明书,转染后细胞转入完全培养基中继续培养24~48 h后收集。为了转染针对SIRT1基因的特异siRNA慢病毒载体,将P19细胞分为转染组(si-SIRT1组)和慢病毒转染对照组(si-con组)。取上述各组细胞悬液,接种于培养基中于37℃、5%CO2条件下培养24 h。将含si-SIRT1的慢病毒载体或空白病毒各100 μl在转染试剂下转染至各组P19细胞,实验过程严格按照流程说明书执行。
1.3.3免疫印迹收集各组P19细胞,加入裂解液后提取总蛋白,其浓度由BCA法测定。变性后冷却,行12%分离胶十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)电泳、聚偏氟乙烯(PVDF)转膜、室温用脱脂奶粉封闭2 h、一抗4℃过夜孵育、二抗室温孵育2 h后,利用ImageJ对所得各组条带进行成像分析,β-actin作为内参。蛋白质相对表达水平用目标蛋白质灰度值比β-actin灰度值来表示。
1.3.4实时反转录PCR(RT-PCR)各组P19细胞完成实验后,提取总RNA,将RNA反转录成cDNA。所用SIRT1基因引物序列,上游:5′-GCA TGC ATG GAA CCT TTG CCT CAT CTA CA-3′,下游:5′-GAT TAC CCT CAA GCC GCT TA-3′;内参GAPDH基因引物序列,上游:5′-ACT CCA CTC ACG GCA AAT TCA-3′,下游:5′-GCC TCA CCC CAT TTG ATG TT-3′。
1.4观察指标①RA诱导不同时间对P19细胞神经分化特异性标志物β-Tubulin、SIRT1和Notch1的影响。②敲除SIRT1后,RA对P19细胞β-Tubulin和Notch1表达水平的影响。③高表达Notch1后,RA对P19细胞β-Tubulin表达水平的影响。
1.5统计学方法采用SPSS10.0软件进行t检验。
2 结 果
2.1RA诱导P19细胞向神经细胞分化P19细胞在RA的诱导下,每天检测神经分化特异性标志物β-Tubulin的变化。RA诱导前(第0天)几乎检测不到β-Tubulin(设为1)。当0.5 μmol/L的RA诱导时,随着时间的增加,β-Tubulin表达水平递增(1、2、3、4 d时分别为2.3±0.26,5.2±0.57,11.6±1.36,25.8±2.36),说明RA可以明显地刺激P19细胞向神经细胞方向分化,也证实了此神经分化模型的有效性。见图1。
2.2RA降低P19细胞中SIRT1表达水平对照组无RA诱导下,P19细胞SIRT1表达水平较高。但经过0.5 μmol/L的RA诱导不同时间后,SIRT1表达水平逐渐降低,在0~4 d内呈时间依赖性(0、1、2、3、4 d时分别为1,0.86±0.09,0.61±0.07,0.44±0.06,0.26±0.04)。由此推测,SIRT1在RA诱导P19细胞向神经细胞分化的过程中可能起到重要作用。见图2。
2.3RA抑制P19细胞中Notch1通路与对照组比较,RA诱导P19细胞分化的过程中,Notch1的表达水平明显降低,并呈时间依赖性(0、1、2、3、4 d时分别为1,0.89±0.07,0.76±0.08,0.53±0.06,0.42±0.07)。Notch1信号通路具有调控干细胞分化的功能,此结果表明Notch1信号通路参与了RA诱导P19分化过程。见图3。
2.4Notch1信号通路受SIRT1调控由以上实验结果提出假设,Notch1信号通路受SIRT1调控,进而影响P19细胞的分化。为了验证此假设,敲除SIRT1的P19细胞在RA诱导4 d后检测神经分化特异性标志物β-Tubulin和Notch1的水平变化。si-ton组设为1,si-SIRT1组SIRT1 mRNA及蛋白水平分别为0.10±0.02,0.15±0.03,成功降低SIRT1 mRNA和蛋白的表达水平。0 d时si-con组β-Tubulin及Notch1水平均设为1,si-SIRT1组分别为0.98±0.05,1.06±0.11。与si-con组(26.84±2.81、0.52±0.08)比较,诱导分化4 d后si-SIRT1组神经分化标志物β-Tubulin水平升高(37.80±4.23),Notch1水平下降(0.31±0.06),验证了SIRT1在RA诱导的神经分化中起到重要作用,并且推测SIRT1调控下游Notch1信号通路。见图4。
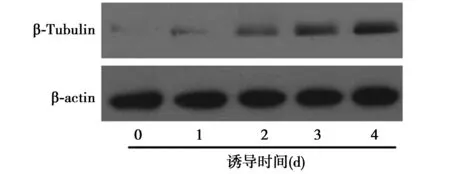
图1 RA对P19细胞神经分化的影响
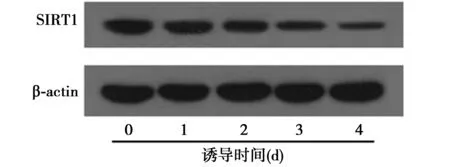
图2 RA对P19细胞中SIRT1的影响
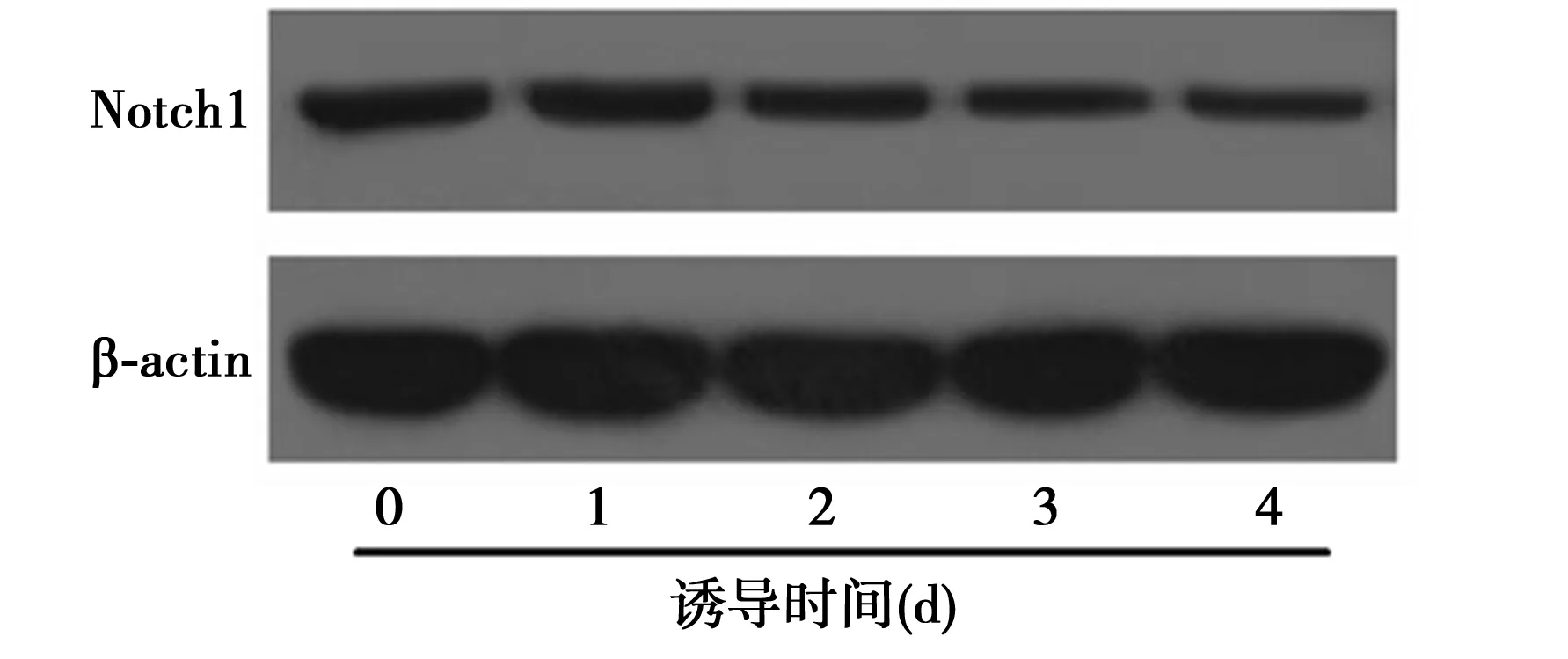
图3 RA对P19细胞中Notch1的影响
2.5激活Notch1对RA诱导P19细胞向神经细胞分化的影响为了证实Notch1信号通路对神经分化起作用,高表达Notch1的P19细胞在RA诱导4 d后检测β-Tubulin的表达水平。0 d时,对照组β-Tubulin表达量设为1,高表达Notch1组β-Tubulin表达量为0.97±0.04。结果发现,与对照组(23.81±2.40)相比,高表达Notch1组在诱导神经分化4 d后β-Tubulin水平相对较低(14.92±1.84)(图5),表明Notch1对神经分化起作用。
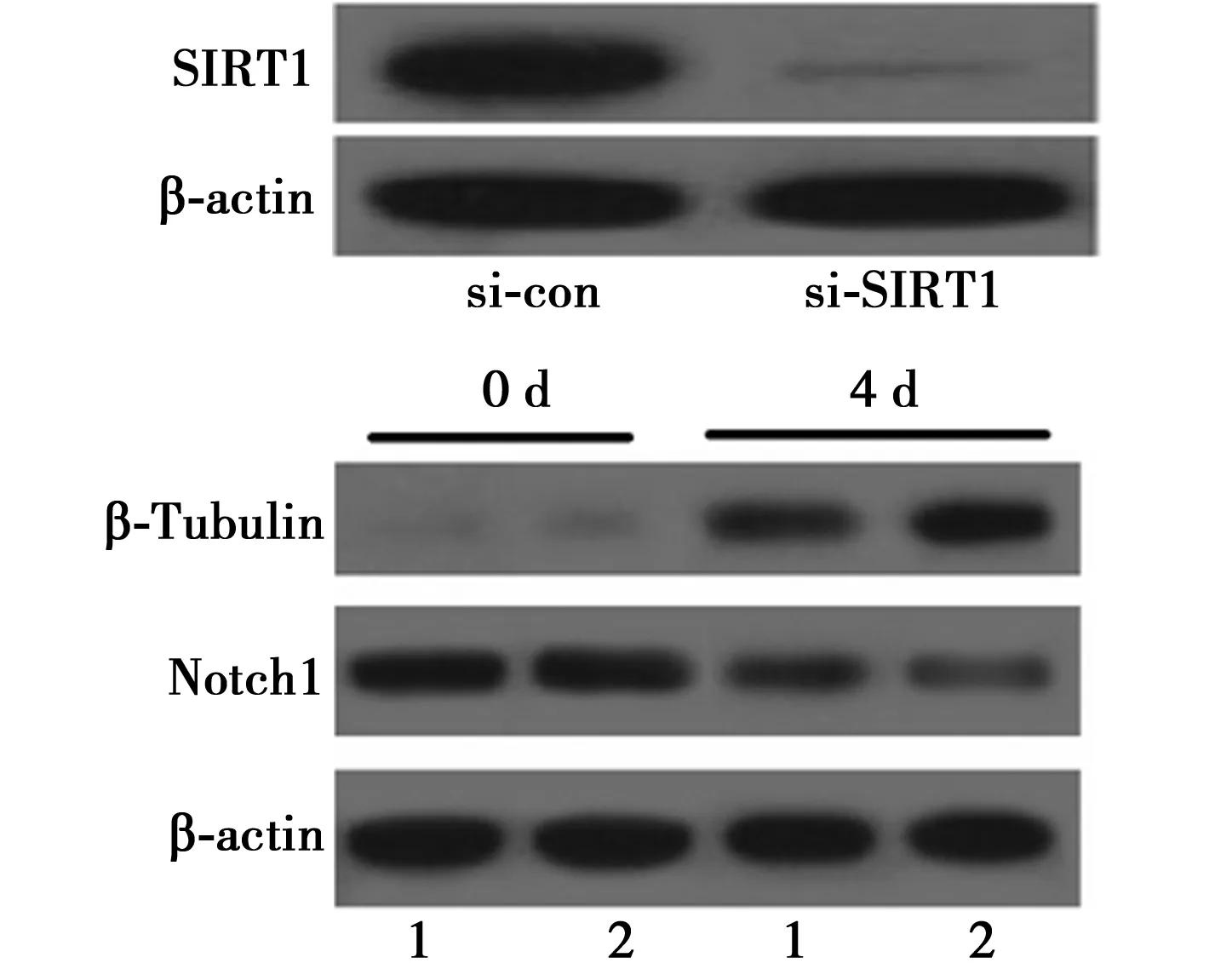
1:si-con;2:si-SIRT1图4 敲降SIRT1对P19细胞神经分化和Notch1的影响

1:pcDNA-con;2:pcDNA-Notch1图5 高表达Notch1对P19细胞神经分化的影响
3 讨 论
实验证实可Sox6促进RA诱导的P19细胞向神经方向分化〔4〕。Boudjelal等〔5〕发现Stra13高表达的P19细胞有向神经分化的功能,而野生P19细胞则向中胚层/外胚层分化。此外,RA能诱导P19细胞Stra13表达,Stra13可能是RA早期目标基因,参与抑制P19细胞向中胚层/外胚层分化以及诱导神经分化过程。κ-Casein(CSN3)在RA诱导P19细胞神经分化的过程中亦高表达,证实了CSN3在此过程中的重要作用〔6〕。TAL2在RA诱导P19细胞后的第3 h表达水平开始增加,至第24 h时恢复至常态,表明TAL2在脑发育中调控着干细胞向神经分化〔7〕。尽管以上实验明确了RA诱导的P19神经分化过程的多种调控机制,但其他机制仍需要探究。
SIRT1与包括神经发育在内的多种生理活动联系紧密〔8〕。研究显示,诱导神经前体细胞分化过程中,SIRT1的位置从细胞质转移到细胞核,从而调控神经前体细胞向神经细胞的方向分化〔9〕。人类胚胎干细胞分化过程中,在RNA-结合蛋白HuR和精氨酸甲基转移酶(CARM1)的调控下,SIRT1 mRNA和蛋白水平都显著降低,继而激活若干种发育相关基因,例如Delta样配体4(DLL4)、T-框蛋白3(TBX3)和配对核基因6(PAX6),从而调控干细胞分化方向〔10〕。干细胞分化过程中SIRT1的水平亦受若干miRNAs的调控。实验已经证实SIRT1蛋白水平在小鼠胚胎干细胞(mESCs)中水平高于处在分化阶段的mESCs,而SIRT1的3′非编码区mRNA与多种mRNAs直接相互作用,例如miR-181a/b、miR-9、miR-204、miR-135a和miR-199b〔11〕。在SIRT1的参与下,某些转录因子如FOXO3发生去乙酰化,亦会影响细胞分化〔12〕。RA诱导P19细胞神经分化的过程中SIRT1水平明显降低,而此诱导过程如果加入SIRT1的诱导剂白藜芦醇,神经分化标志物nestin就会受到抑制,即P19细胞向神经分化的能力受到抑制〔13〕。本实验表明诱导初期SIRT1对分化起到关键作用,进一步验证了SIRT1下调可抑制Notch1信号通路,而Notch1的抑制对分化起到促进作用。
Notch1信号通路对维持干细胞特性、调节神经干细胞分化等方面意义重大。神经干细胞经亲神经复合物百日咳杆菌气管定植因子(tCFA15)处理,Notch1的表达受到抑制,最终促使神经干细胞向神经分化而非星形胶质细胞分化〔14〕。肖迎等〔15〕在诱导小鼠胚胎干细胞分化为神经细胞中发现Notch1在诱导前表达较高,而随着RA诱导的进行,Notch1的表达越来越低,神经细胞数亦逐渐增多,说明抑制Notch1增强神经分化趋势。Jing等〔16〕在研究小鼠骨髓间充质干细胞的过程中发现,受miR-9调控的Notch1下调可以诱导神经细胞标志物和微管相关蛋白(MAP)-2,促进向神经细胞的分化。最近的一项研究表明,从中药植物中提取的红景天苷可以诱导小鼠骨髓间充质干细胞向神经细胞方向分化,表现为诱导后神经表型标志物神经元烯醇酶(Eno)2、MAP-2、β-tubulin Ⅲ表达的增加,其机制部分依赖于Notch1信号通路〔17〕。以上研究指明,Notch1信号通路是参与神经分化的重要信号通路。本研究结果与上述研究结果一致。
1McBurney MW,Rogers BJ.Isolation of male embryonal carcinoma cells and their chromosome replication patterns 〔J〕.Dev Biol,1982;89(2):503-8.
2Wang RH,Sengupta K,Li C,etal.Impaired DNA damage response,genome instability,and tumorigenesis in SIRT1 mutant mice 〔J〕.Cancer Cell,2008;14(4):312-23.
3Artavanis-Tsakonas S,Rand MD,Lake RJ.Notch signaling:cell fate control and signal integration in development 〔J〕.Science,1999;284(5415):770-6.
4Hamada-Kanazawa M,Ishikawa K,Nomoto K,etal.Sox6 overexpression causes cellular aggregation and the neuronal differentiation of P19 embryonic carcinoma cells in the absence of retinoic acid 〔J〕.FEBS Lett,2004;560(1-3):192-8.
5Boudjelal M,Taneja R,Matsubara S,etal.Overexpression of Stra13,a novel retinoic acid-inducible gene of the basic helix-loop-helix family,inhibits mesodermal and promotes neuronal differentiation of P19 cells 〔J〕.Genes Dev,1997;11(16):2052-65.
6Komori R,Kobayashi T,Matsuo H,etal.Csn3 gene is regulated by all-trans retinoic acid during neural differentiation in mouse P19 cells 〔J〕.PLoS One,2013;8(4):e61938.
7Kobayashi T,Komori R,Ishida K,etal.Tal2 expression is induced by all-trans retinoic acid in P19 cells prior to acquisition of neural fate 〔J〕.Sci Rep,2014;4:4935.
8Said RS,El-Demerdash E,Nada AS,etal.Resveratrol inhibits inflammatory signaling implicated in ionizing radiation-induced premature ovarian failure through antagonistic crosstalk between silencing information regulator 1(SIRT1)and poly(ADP-ribose)polymerase 1(PARP-1)〔J〕.Biochem Pharmacol,2016;103(2):140-50.
9Hisahara S,Chiba S,Matsumoto H,etal.Histone deacetylase SIRT1 modulates neuronal differentiation by its nuclear translocation 〔J〕.Proc Natl Acad Sci U S A,2008;105(40):15599-604.
10Calvanese V,Lara E,Suárez-Alvarez B,etal.Sirtuin 1 regulation of developmental genes during differentiation of stem cells 〔J〕.Proc Natl Acad Sci U S A,2010;107(31):13736-41.
11Saunders LR,Sharma AD,Tawney J,etal.miRNAs regulate SIRT1 expression during mouse embryonic stem cell differentiation and in adult mouse tissues 〔J〕.Aging(Albany NY),2010;2(7):415-31.
12Kim MJ,Ahn K,Park SH,etal.SIRT1 regulates tyrosine hydroxylase expression and differentiation of neuroblastoma cells via FOXO3a 〔J〕.FEBS Lett,2009;583(7):1183-8.
13Kang MR,Lee SW,Um E,etal.Reciprocal roles of SIRT1 and SKIP in the regulation of RAR activity:implication in the retinoic acid-induced neuronal differentiation of P19 cells 〔J〕.Nucleic Acids Res,2010;38(3):822-31.
14Bouissac J,Garwood J,Girlanda-Jungès C,etal.tCFA15,a trimethyl cyclohexenonic long-chain fatty alcohol,affects neural stem fate and differentiation by modulating Notch1 activity 〔J〕.Eur J Pharmacol,2013;718(1):383-92.
15肖迎,王琪,唐仕波,等.Notch1 蛋白在胚胎干细胞向神经细胞诱导分化过程中的表达 〔J〕.中国组织工程研究与临床康复,2008;12(25):4967-70.
16Jing L,Jia Y,Lu J,etal.MicroRNA-9 promotes differentiation of mouse bone mesenchymal stem cells into neurons by Notch signaling 〔J〕.Neuroreport,2011;22(5):206-11.
17Zhao HB,Qi SN,Dong JZ,etal.Salidroside induces neuronal differentiation of mouse mesenchymal stem cells through Notch and BMP signaling pathways 〔J〕.Food Chem Toxicol,2014;71:60-7.
〔2016-01-11修回〕
(编辑袁左鸣/滕欣航)
10.3969/j.issn.1005-9202.2016.14.007
河南省高等学校重点科研项目(No.16A320003);河南省教育厅国际合作项目(No.162102410089)
赵雪艳(1975-),女,硕士,副主任医师,主要从事神经科基础研究。
张俊士(1979-),男,硕士,主治医师,主要从事神经科基础研究。
R74
A
1005-9202(2016)14-3365-03;

