内吗啡肽-1对高糖环境下树突细胞免疫功能的影响
杨小淮 周 诚 潘治宇 杨丽娟 李正红
(蚌埠医学院生理学教研室,安徽 蚌埠 233030)
内吗啡肽-1对高糖环境下树突细胞免疫功能的影响
杨小淮1周诚潘治宇杨丽娟李正红
(蚌埠医学院生理学教研室,安徽蚌埠233030)
目的观察内吗啡肽(EM)-1对高糖环境下树突细胞(DC)免疫功能的影响。方法从正常人外周血中提取和分离单个核细胞,诱导成为未成熟DC;使用高浓度葡萄糖作为刺激因素,不同浓度的EM-1作为干预因素;分别设高糖组(HG组)、高糖加10-6mmol/L EM-1组(A组)、高糖加10-8mmol/L EM-1组(B组)、高糖加10-10mmol/L EM-1组(C组)。流式细胞术检测DC表型变化;酶联免疫吸附法(ELISA)检测DC分泌的细胞因子的变化;DC与自体淋巴细胞共培养,羧基荧光素二醋酸盐琥珀酰亚胺酯(CFSE)法检测T淋巴细胞的增殖能力。结果与HG组比较,A组CD83、CD86、趋化因子受体(CCR)7和CD36表达均上调,B组和C组CD86、CCR7和CD36表达上调;与HG组比较,A组、B组和C组白细胞介素(IL)-12和IL-10的分泌均减少,T淋巴细胞增殖指数均降低,以A组作用明显。结论EM-1上调高糖环境下DC表面分子CD83、CD86、CCR7和CD36表达,抑制DC分泌炎性细胞因子IL-12和IL-10,抑制DC的T淋巴细胞增殖能力。
树突细胞;高糖;内吗啡肽-1;动脉粥样硬化
动脉粥样硬化(AS)是一种慢性炎症和自身免疫性疾病,免疫和炎症是致其发病和发展的关键〔1,2〕。AS是糖尿病(DM)最常见的并发症之一,其发生的机制尚未完全清楚,而高血糖作为DM患者体内最具有特征性的改变,在DM血管并发症中起着始动和关键作用,被认为是AS的独立危险因素〔3,4〕。树突细胞(DC)是目前已知功能最强的专职抗原递呈细胞,最大特点是能刺激初始型T淋巴细胞活化和增殖,而其他的抗原递呈细胞,如巨噬细胞和B淋巴细胞仅能刺激已活化的T淋巴细胞或记忆T淋巴细胞,因此DC是特异性免疫应答的始动者,其激活T淋巴细胞能力也是巨噬细胞1 000倍。研究表明,DC参与了AS发生发展的全过程,在激活和放大AS的炎症免疫反应中起重要的调控作用〔1〕。高糖可以促进DC成熟和激活T淋巴细胞的能力,并通过自身释放一些炎症因子,加速和放大炎症免疫反应〔5〕。内吗啡肽(EM)-1是1997年新发现的内源性阿片肽,被认为是Mu阿片受体(MOR)的内源性配体〔6〕,具有广泛的生物学作用,如镇痛、心血管效应和免疫应答等。最新研究发现EM-1能抑制巨噬细胞吞噬脂质,下调单核-巨噬细胞源性泡沫细胞表面CD36的表达,影响肿瘤坏死因子(TNF)-α 和干扰素(IFN)-γ的释放,而影响动脉斑块的形成,可能具有抗炎、抗动脉粥样硬化的作用〔7〕。那么EM是否能通过影响DC的分化成熟和免疫功能,而参与AS的形成和发展,目前尚未见报道。本实验通过观察EM-1对高糖环境下人DC的成熟和免疫功能的影响,以探讨EM可能对AS发生发展的影响。
1 材料和方法
1.1药品与试剂淋巴细胞分离液(天津TBD生物技术公司);无糖型RPMI1640溶液(杭州吉诺公司);EM-1和D-葡萄糖(SIGMA公司);抗体:CD83-FITC和CD86-PE(Invitrogen公司),CD36-FITC、HLA DR-PERCP和CD11c-APC(eBioscience公司),CD3-APC(天津协科生物公司);人白细胞介素(rhIL)-10 和rhIL-12酶联免疫吸附(ELISA)试剂盒(R&D公司)。
1.2标本来源用于DC培养的健康人外周血取自本院学生志愿者,年龄18~22(平均20)岁。均排除心脏病或DM史。
1.3DC的诱导培养Ficoll 密度梯度离心法分离正常人外周血得到外周血单个核细胞(PBMC),用RPMI1640洗涤2 次,用RPMI1640 完全培养基(含10%灭活新生牛血清)调节PBMC 密度至1×107cell/ml,加入6孔板中,放置37℃、5%CO2培养箱培养4 h,洗去非贴壁细胞即淋巴细胞,冻存淋巴细胞。贴壁细胞用含人粒-单集落刺激因子(rhGM-CSF)、rhIL-4的无糖RPMI1640 完全培养基继续培养;每隔2 d半量换液,补充等量细胞因子;第7天收获未成熟DC(imDC)。
1.4高糖环境下DC的分组诱导培养用无糖RPMI1640完全培养基定浓收集的imDC,按照每孔1×106cell/ml的浓度种进24孔板,每孔加入相同浓度的D-葡萄糖(终浓度为25 mmol/L)和不同浓度的EM-1(HG组、A组、B组、C组的EM-1浓度分别为0、10-6、10-8、10-10mmol/L),放置CO2培养箱继续培养2 d。分别收集上清液500 μl,冻存。
1.5镜下观察细胞形态和流式检测DC表面分子在镜下观察各组细胞后,分别收集各组细胞,离心定容后移至流式上样管,并用CD83-FITC、CD86-PE、CD36-FITC和CCR7-PE荧光标记抗体染色,混匀后避光室温染色30 min,经磷酸盐缓冲液(PBS)洗涤2次,2%含多聚甲醛(PFA)200 μl重悬后上流式细胞仪检测,并用Cellquest软件和Flow Jo软件分析。
1.6检测T淋巴细胞增殖复苏冻存的同体淋巴细胞,用无糖不完全RPMI1640重悬细胞并调节浓度为106个/ml。加入羧基荧光素二蜡酸盐琥珀酰亚胺脂(CFSE)贮存液(终浓度为1 μmol/L),置37℃水浴箱染色15 min,用无糖完全RPMI1640培养液洗涤3次。取出少部分CFSE染色后的淋巴细胞标记的抗CD3-APC抗体作为原代细胞,置于4℃冰箱内避光保存备用。收集各组DC细胞,用PBS洗涤3次,洗净高糖和EM-1。每组按照5 000个DC和106个标记CFSE的淋巴细胞混合加入96孔板中,放置CO2培养箱继续培养3 d。分别吸出各组全部细胞,用PBS洗涤3次后,移至流式上样管,并用抗CD3-APC抗体染色,混匀后避光室温染色30 min,经PBS洗涤2次,2% PFA 200 μl重悬后上流式细胞仪检测,用Flow Jo软件分析得出各组的DC刺激T淋巴细胞的增殖指数(PI)。
1.7ELISA法检测DC分泌细胞因子IL-10和IL-12的含量解冻各组DC上清液,离心10 min除去颗粒和聚合物,按照ELISA试剂盒中说明书的步骤测定。绘制拟合曲线,R2>0.99,保证了由该曲线及其方程求出的样本浓度具有很强的可信性。
1.8统计学分析应用SPSS17.0软件进行单因素方差分析、q检验。
2 结 果
2.1高糖环境下EM-1对DC形态学的影响在葡萄糖浓度为25 mmol/ml环境下,第9天DC的形态并没因EM-1的干预发生明显改变。见图 1。
2.2高糖环境下EM-1诱导DC表型的变化见表1。与HG组相比,A组CD83、CD86、CCR7和CD36表达均上调,B组和C组CD86、CCR7和CD36表达上调。

图1 高糖环境下不同浓度EM-1诱导DC的形态学变化(×200)

组别CD83CD86CCR7CD36HG组29.56±1.5349.15±2.9528.40±1.2528.25±2.19A组33.78±2.851)58.21±1.272)43.36±3.932)42.02±1.8320)B组29.53±0.993)56.12±0.692)37.24±1.712)3)34.72±1.212)4)C组31.51±3.0255.21±1.692)32.61±1.511)4)5)30.81±1.064)5)F/P值4.0/<0.0522.18/<0.0137.08/<0.0167.13/<0.01
与HG组比较:1)P<0.05,2)P<0.01;与A组比较:3)P<0.05,4)P<0.01;与B组比较:5)P<0.01
2.3高糖环境下EM-1诱导DC与淋巴细胞共培养后的T淋巴细胞增殖情况变化HG组PI值最高(2.13±0.02),明显高于原代(1.21±0.01),说明高糖作用下的DC能促进T淋巴细胞增殖;3组不同浓度的EM-1干预后的T淋巴细胞的增殖指数分别是A组(1.56±0.04)、B组(1.98±0.03)、C组(1.96±0.03),均显著低于HG组(P<0.01),高浓度A组EM-1作用显著高于B组和C组(P<0.01)。
2.4高糖环境下EM-1诱导DC分泌IL-10和IL-12的变化EM-1能显著抑制高糖环境下DC炎性因子IL-12和IL-10的分泌。见表2。
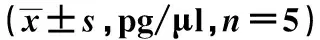
表2 高糖环境下EM-1诱导DC分泌的IL-10和IL-12含量
与HG组比较:1)P<0.01;与A组比较:2)P<0.05,3)P<0.01;与B组比较:4)P<0.01
3 讨 论
2型糖尿病(T2DM)致死致残的重要原因之一就是AS〔8〕,AS是一种与脂质在动脉壁聚集相关和各种炎性细胞参与的慢性炎症过程,其基本病变是动脉内膜的脂质沉积、内膜灶状纤维化、粥样斑块形成。文献〔9〕报道DC在人AS病变中的数量明显增加,而且在炎性浸润区域聚集。其中一部分DC吞噬脂质形成泡沫细胞;另一部分DC以成熟形式为主,呈递抗原激活和促进T淋巴细胞的增殖,并与巨噬细胞和活化的T淋巴细胞聚集一起形成斑块,在不稳定斑块中DC数量更是增多明显,并参与斑块破裂的发生。
CD36是清道夫受体B家族的一员,主要分布于血管内皮细胞、单核巨噬细胞、DC、血小板和脂肪细胞等。CD36与氧化低密度脂蛋白(ox-LDL)识别、摄取和泡沫细胞的形成及血管病损处炎症反应关系密切,是AS发生发展过程中非要重要的受体〔10,11〕。EMs是生物体内产生天然的具有阿片样活性的物质,文献〔12,13〕报道EMs能通过与免疫细胞表面的MOR结合,影响一些炎性细胞的免疫功能,达到抑制炎症的作用。EMs还可以保护高糖对内皮细胞的损害〔14〕,通过抑制巨噬细胞源泡沫细胞其表面分子CD36的表达和TNF-α与IFN-γ的释放,影响动脉斑块的形成〔7〕。
已有文献〔5〕报道,高糖可以促进DC成熟、上调CD86等表型的表达和加强DC激活T淋巴细胞的能力,并通过自身释放一些炎症因子,加速和放大炎症免疫反应,从而促进AS的形成。本实验结果提示EM-1可能进一步活化DC,促进其趋向成熟、加速其迁移活动,增强DC的炎症免疫反应;EM-1加强DC吞噬脂质能力,参与AS的形成;EM-1抑制DC释放炎性因子IL-10和IL-12,并抑制T淋巴细胞的增殖,可能具有抗炎和抑制动脉斑块形成的作用。EM-1对DC免疫功能影响的复杂性,有待进一步研究。
1Chistiakov DA,Orekhov AN,Sobenin IA,etal.Plasmacytoid dendritic cells:development,functions,and role in atherosclerotic inflammation 〔J〕.Front Physiol,2014;25(5):279.
2Randolph GJ.Mechanisms that regulate macrophage burden in atherosclerosis〔J〕.Circ Res,2014;114(11):1757-71.
3杨辉,冯跃明.2型糖尿病患者发生动脉粥样硬化的相关危险因素〔J〕.中国老年学杂志,2013;33(8):1751-2.
4Ulutas KT,Dokuvucu R,Sefil F,etal.Evaluation of mean platelet volume in patients with type 2 diabetes mellitus and blood glucose regulation:a marker for atherosclerosis〔J〕?Int J Clin Exp Med,2014;7(4):955-61.
5姚康,葛均波,孙爱军,等.高糖对人单核细胞源树突状细胞分化成熟和免疫功能的影响及其机制研究〔J〕.中华心血管病杂志,2006;34(1):60-4.
6Zadina JE,Hackler L,Ge LJ,etal.A potent and selective endogenous agonist for the mu-opiate receptor 〔J〕.Nature,1997;386(6624):499-502.
7Chiurchiu V,Izzi V,D′Aguilio F,etal.Endomorphin-1 prevents lipid accumulation via CD36 down-regulation and modulates cytokines release from human lipid-laden macrophages〔J〕.Peptides,2011;32(1):80-5.
8胥利,赵庆华,周波,等.老年2型糖尿病与动脉粥样硬化相关性研究〔J〕.中国老年学杂志,2012;32(7):1479-80.
9Bobryshev YV,Lord RS.Co-accumulation of dendritic cells and natural killer T cells within rupture-prone regions in human atherosclerotic plaques〔J〕.J Histochem Cytochem,2005;53(6):781-5.
10Chavez-Sanchez L,Garza-Reves MG,Espinosa-Luna JE,etal.The role of TLR2,TLR4 and CD36 in macrophage activation and foam cell formation in response to oxLDL in humans〔J〕.Hum Immunol,2014;75(4):322-9.
11Kuchibhotla S,Vanegas D,Kennedy DJ,etal.Absence of CD36 protects against atherosclerosis in ApoE knock-out mice with no additional protection provided by absence of scavenger receptor A Ⅰ/Ⅱ 〔J〕.Cardiovasc Res,2008;78(1):185-96.
12Azuma Y,Ohura K,Wang PL,etal.Endomorphins delay constitutive apoptosis and alter the innate host defense functions of neutrophils 〔J〕.Immunol Lett,2002;81(1):31-40.
13Izzi V,Chiurchiu V,Aquilio FD,etal.Endomorphin-1 inhibits the activation and the development of a hyporesponsive-like phenotype in lipopolysaccharide-stimulated THP-1 monocytes 〔J〕.Int J Immunopathol Pharmacol,2008;21(4):833-43.
14Liu J,Wei S,Tian L,etal.Effects of endomorphins on human umbilical vein endothelial cells under high glucose〔J〕.Peptides,2011;32(1):86-92.
〔2015-07-25修回〕
(编辑冯超/王一涵)
10.3969/j.issn.1005-9202.2016.14.009
安徽省教育厅自然科学研究重点项目(KJ2011A202);蚌埠医学院科技发展基金重点项目(Bykf13A10)
李正红(1970-),女,教授,博士,硕士生导师,主要从事免疫性疾病研究。
杨小淮(1973-),男,硕士,副主任医师,主要从事慢性炎症研究。
R587.1
A
1005-9202(2016)14-3370-03;
1蚌埠医学院第一附属医院泌尿外科

