烟草花青素苷转运相关基因NtAN9的分离与表达分析
崔超军,李嘉敏,陈君宇,张润钊,祝钦泷
烟草花青素苷转运相关基因NtAN9的分离与表达分析
崔超军,李嘉敏,陈君宇,张润钊,祝钦泷*
(华南农业大学 生命科学学院,亚热带农业生物资源保护与利用国家重点实验室,广东省植物功能基因组与生物技术重点实验室,广州 510642)
为研究花青素苷的转运,利用电子克隆和RT-PCR方法,从普通烟草(Nicotianatabacum)花中分离了1个编码谷胱甘肽转移酶(GST)基因,命名为NtAN9(GenBank登录号KX356542)。NtAN9包含一个690 bp的开放阅读框,编码229个氨基酸残基,属于phi型GST。NtAN9基因组结构由3个外显子和2个内含子组成。多序列比对分析表明,NtAN9与矮牵牛(Petuniahybrida)花青素苷转运相关的GST基因PhAN9具有88%的一致性。系统进化分析显示,NtAN9与花青素苷转运相关的GST基因聚为一支,是PhAN9的直系同源基因。定量PCR分析表明,NtAN9基因在含有花青素苷的四个花发育时期中均有表达,其中在开花前的第Ⅲ期(2 cm <花芽<4 cm)表达丰度达到最高,而在不含花青素苷的根、茎和叶中不表达。由此推测,分离得到的NtAN9可能具有类似PhAN9的功能,与烟草花青素苷的转运与积累相关。NtAN9基因的分离与表达分析,为进一步研究烟草花青素苷的转运奠定了基础。
烟草;花青素苷转运;谷胱甘肽转移酶;基因克隆;表达分析
类黄酮和花青素苷生物合成是目前研究得较清楚的代谢途径之一,但其后期阶段从细胞质转运到中央液泡的过程仍不是很清楚。目前研究表明,有4类蛋白,即谷胱甘肽转移酶(glutathione S-transferase, GST)、多药耐药抗性相关蛋白(multidrug resistance-associated protein,MRP)、多药和有毒化合物排出家族(multidrug and toxic compound extrusion, MATE) 和同源于哺乳动物的胆红素易位酶同族体(bilitranslocase-homologue, BTL-homologue), 可能参与花青素苷向液泡的转运,其中GST蛋白又是重要和基础的一类[1]。
植物GST是一类含有多个成员的超基因家族,根据其基因组结构和蛋白氨基酸同源性,分为可溶性的7类GST,即φ(phi,F)、τ(tau,U)、θ(theta,T)、ζ(zeta,Z)、λ(lamda,L)、DHAR (dehydroascorbate reductase)和TCHQD(tetrachlorohydroquinone dehalogenase),以及不溶性微粒GST,它们在植物的初生代谢和次生代谢中,通过底物特异性和转运靶向 (液泡、胞外等)的不同,行使不同的功能[2]。φ和τ是植物特异的GST,种类也最多。首个克隆的花青素苷相关GST是玉米Bronze2基因,其编码GSTⅢ蛋白,突变导致花青素苷不能在玉米籽粒中积累[3]。矮牵牛PhAN9基因编码Bronze2的同源蛋白GSTI,突变导致花青素苷不能在矮牵牛花瓣中积累,其突变表型能够被玉米Bronze2基因互补[4]。目前,通过GST基因突变体筛选和功能互补研究,已克隆了部分与花青素苷转运相关的GST基因,如拟南芥AtTT19[5]、紫苏(Perillafrutescens)PfGST1[6]、葡萄VvGST4[7]、仙客来CkmGST3[8]、香石竹DcGSTF2[9]和荔枝LcGST4[10]。尽管目前GenBank数据库中已有多种植物GST基因,但与花青素苷转运相关的GST报道依然不多[1]。
烟草是一种重要的经济作物,同时也是一种用于花青素代谢调控研究的重要模式植物。目前烟草花青素苷合成途径部分结构基因和部分转录调控因子已被克隆[11-12],但至今未有花青素苷转运相关的GST基因克隆的报道。本研究利用电子克隆的方法,以矮牵牛PhAN9核酸序列为探针,搜索烟草EST数据库,拼接全长基因序列后,用RT-PCR方法快速分离获得烟草花青素苷转运相关的GST基因NtAN9,并对其在不同组织和不同花发育阶段的表达特征进行了研究,以期为验证该基因功能进而解析花青素苷转运机制奠定基础。
1 材料和方法
1.1植物材料
普通烟草(Nicotianatabacum)栽培品种K326,由实验室保存,在正常的自然条件下生长。采集正常发育的烟草花芽和花朵,以及根、茎和叶保存于-80 ℃低温冰箱,用于RNA提取。
1.2方法
1.2.1烟草基因组DNA提取、花RNA分离及cDNA第一链合成用SDS方法快速提取烟草嫩叶基因组DNA;用Invitrogen的Trizol试剂提取烟草根、茎、叶和花的4个时期的总RNA,各样品用1 μg总RNA为模版,采用Promega的M-MuLV逆转录酶和OligodT Primer进行反转录,合成cDNA第一链。反转录条件为:42℃ 40 min,50 ℃ 30 min,99 ℃ 5 min,5 ℃ 5 min。
1.2.2烟草花青素苷的提取与测定烟草花发育的4个时期参考Pattanaik等的文献报道[11]划分:Ⅰ期(花芽<1 cm)、Ⅱ期(1 cm<花芽<2 cm)、Ⅲ期(2 cm <花芽<4 cm)和Ⅳ期(盛花期)。烟草花青素苷的提取采用Zhu等报道的方法[13],用1% 盐酸甲醇4 ℃避光抽提过夜,然后用分光光度仪分别测量样品在530 nm和650 nm的光吸收值A,按公式[(A530-0.25×A650)/每克鲜重]计算花青素苷的相对含量。
1.2.3烟草NtAN9基因全长序列的克隆采用电子克隆的方法,用矮牵牛PhAN9基因(Y07721)cDNA 序列作为探针,在NCBI网站的expressed sequence tags (EST)数据库和genomic survey sequence(GSS)数据库进行核酸序列搜索与比对,得到与PhAN9高度相似的烟草EST和GSS序列,再用这些序列在上述数据库中进一步进行搜索,最终获得的所有序列用DNAman软件对所获得的EST和GSS序列进行多重比对和Contig拼接。根据多重比对和拼接的结果,设计5′和3′-末端特异引物F-NtAN9 (5′-ATGGTAGTGAAGGTGTATGGTTCAG-3′)和R-NtAN9 (5′-TTAAAGTTTTACTTCTTTAAATAGGGGTGCAG-3′)用于扩增NtAN9全长cDNA编码区序列和对应的基因组序列。
RT-PCR以烟草花cDNA第一链1 μL为模版,采用TOYOBO高保真的KOD FX酶进行50 μL标准PCR体系扩增,参数如下:95 ℃ 预变性2 min,35个扩增循环(95 ℃ 变性1 min,58 ℃ 退火1 min,72 ℃ 延伸2 min),72 ℃ 再延伸5 min。NtAN9基因组DNA扩增,除用烟草嫩叶DNA为模板外,其它扩增条件同RT-PCR条件。将上述获得的PCR产物胶回收后,经过T-A克隆,单克隆子PCR检测后,选阳性克隆子测序。
1.2.4烟草NtAN9基因的生物信息学分析NtAN9基因的分子特征分析主要采用Vector NTI Suite 10.0软件包进行Open Reading Frame(ORF)查找和翻译、蛋白质基本性质。NCBI网站在线工具BLAST分析蛋白保守结构域搜索。应用ExPASy、Softberry、CBS和Psort等网上综合软件包,进行编码蛋白的基本性质、结构特点等的预测分析。使用CLUSTAL X(1.83)软件对不同GST蛋白序列进行多重比对以后,再使用Mega6.0软件中的邻位相连法(NJ法),采用Bootstrap 1000次,完成系统进化树的构建。
1.2.5烟草NtAN9基因的表达模式分析利用Primer 5.0软件,设计NtAN9基因的实时荧光定量PCR引物FqRT-NtAN9(5′-CATCTATGAACAAAGGTTGTCC-3′)和RqRT-NtAN9(5′-CAAACACTTTCTCTCCGTTACC-3′),以NtGAPDH基因作为内参,引物为F- GAPDH(5′-CTGCTCACTTGAAGGGTGGT-3′)和R- GAPDH (5′- GGGAGCAAGGCAATTTGTGG-3′)。以烟草根、茎、叶和花的4个发育时期cDNA为模板,采用宝生SYBR Green Master Mix 试剂盒的反应体系和反应程序,在BioRad IQ5 real-time PCR仪上完成荧光定量PCR。反应程序为:95 ℃ 预变性15 s, 58 ℃ 退火15 s,72 ℃ 延伸15 s,40个循环。每样品重复3次,采用2-ΔΔCt法计算基因的相对表达。
2 结果和分析
2.1NtAN9基因的克隆与核酸序列特征
通过PhAN9基因序列BLASTn分析烟草EST数据库和GGS数据库后,共获得烟草AN9基因的2条EST序列和6条GSS序列。采用DANman软件进行EST和GSS序列多重比对和拼接后,获得一条长2 317 bp的Contig序列。通过进一步搜索Contig序列编码区ORF,发现一个有3个外显子和2个内含子构成的ORF。BLASTn分析表明该序列编码区与矮牵牛PhAN9基因核酸具有89%的一致性,可以初步认定其为烟草AN9基因(图1)。
以F-NtAN9和R-NtAN9扩增引物,RT-PCR扩增烟草花cDNA后,获得1条约600 bp 的特异条带,胶回收、T-A克隆和测序。测序结果表明,烟草AN9基因cDNA ORF全长为690 bp,编码229个氨基酸(图1),命名为NtAN9,GenBank 登录号为KX356542。以烟草嫩叶gDNA为模板,扩增NtAN9基因组DNA。其gDNA从起始密码子到终止密码子长为1 538 bp,含有3个外显子和2个内含子。内含子总长为848 bp,其中内含子Ⅰ为225 bp,内含子Ⅱ为623 bp(图2),序列符合标准的GT-AG内含子剪接法则。其基因组结构与大多数花青素苷转运相关的GST基因的结构一致。

起始密码子ATG用粗体表示,终止子TAA用粗体和星号表示;N端保守结构域GST_N_Phi(M10~K77)用单下划线表示;C端保守结构域GST_C_Phi(E91~L209)用双下划线表示;阴影为保守的GSH活性位点,方框为保守的底物结合位点。图中左边数字代表核酸数字。箭头位置表示外显子间的交界处图1 NtAN9基因的核酸序列及推定氨基酸序列The ATG initiation codon is bold, and the TAA termination codon is in bold and indicated by five-pointed star. The N-terminal conserved domain GST_N_Phi(M10~K77) and the C-terminal conserved domain GST_C_Phi(E91~L209) are single and double underlines, respectively. The GSH sites are marked with gray background, and the substrate binding sites are marked in box. The two vertical arrows indicate the splice sites between exonsFig. 1 cDNA sequence and the deduced amino acid sequence of NtAN9
2.2NtAN9基因编码蛋白的特征和同源性分析
NtAN9蛋白长度为229 个氨基酸(aa),分子量(Mw)为26.34 kDa,等电点(pI)为5.76,其中极性氨基酸比例20.96%,碱性氨基酸比例为13.97%,酸性氨基酸比例为12.22%。含量最丰富的为亮氨酸Leu,占总氨基酸的13.57%,其次是Val和Lys,分别占9.17%和8.73%。 NtAN9蛋白特征与PhAN9蛋白高度相似。Blastp的保守域搜索表明,NtAN9具有GST_N_Phi(M10~K77)和GST_C_Phi(E91~L209)两个保守结构域(图1),说明NtAN9基因属于phi类型GST超基因家族蛋白成员。一般可溶性GST是以蛋白二聚体的形式行使功能,每个约26 kD亚基都包含独立的GSH 特异结合位点(G 位点)和结合疏水底物的位点(H位点),通常G 位点保守,H 位点结构可变性较大。NtAN9中的G位点在同类型GST蛋白中是高度保守和一致的,而H位点保守性相对较低(图1,图3)。
多序列比对分析发现,NtAN9与花青素苷相关的GST蛋白序列具有较高的一致性,其中与矮牵牛的PhAN9具有最高的一致性,达88%;与拟南芥AtTT19、紫苏PfGST1、葡萄VvGST4和荔枝LcGST4等也具有较高的序列一致性, 其范围在53%~70% 之间。NtAN9与这些GST蛋白在酶活功能相关的保守氨基酸和功能结构域上表现出高度一致性(图3), 说明它们可能具有相似的功能。
2.3NtAN9基因的系统进化树分析
在多序列比对的基础上,用MEGA6.0软件,选用NJ法,bootstrap 1 000次,构建了NtAN9基因与已知花青素苷转运相关GST基因及其它类型的GST基因的系统进化树(图4)。对构建的NJ树分析发现,整个系统树分为3个大支,其中NtAN9首先与同为茄科的矮牵牛PhAN9聚在一起,再与紫苏PfGST1、葡萄的VvGST4、荔枝LcGST4和拟南芥AtTT19聚类在一起形成独立的一个大支,而其它类型的GST分别形成不同的支。这意味着NtAN9属于花青素苷转运相关的GST基因家族,具有相似的花青素苷转运功能。综合Blasts、蛋白序列多序列比对分析和系统进化分析的结果,说明NtAN9基因就是矮牵牛PhAN9 基因的直系同源基因,暗示着其具有与之相同的转运功能。

图2 烟草NtAN9基因组结构Fig. 2 The genomic structure of common tobacco NtAN9 gene

黑色背景表示完全一致的氨基酸序列。五角星表示保守的GSH活性位点,三角形表示底物结合位点图3 烟草NtAN9与其它植物已知花青素苷转运相关的GST蛋白的多序列比对Shades in black represent identical amino acids among the homologous proteins. Highly conserved GSH active sites are marked with five-pointed star. Triangle indicates substrate binding sitesFig. 3 The multiple sequence alignment of NtAN9 with known-function anthocyanin transport-related GST proteins

圆点代表本研究的NtAN9在系统发生树中的位置图4 烟草NtAN9蛋白与其它植物不同类型GST蛋白的系统进化树The dot indicates NtAN9 position in the phylogenetic treeFig. 4 Neighbor joining phylogenetic tree of the complete sequences of NtAN9 and other plant GST
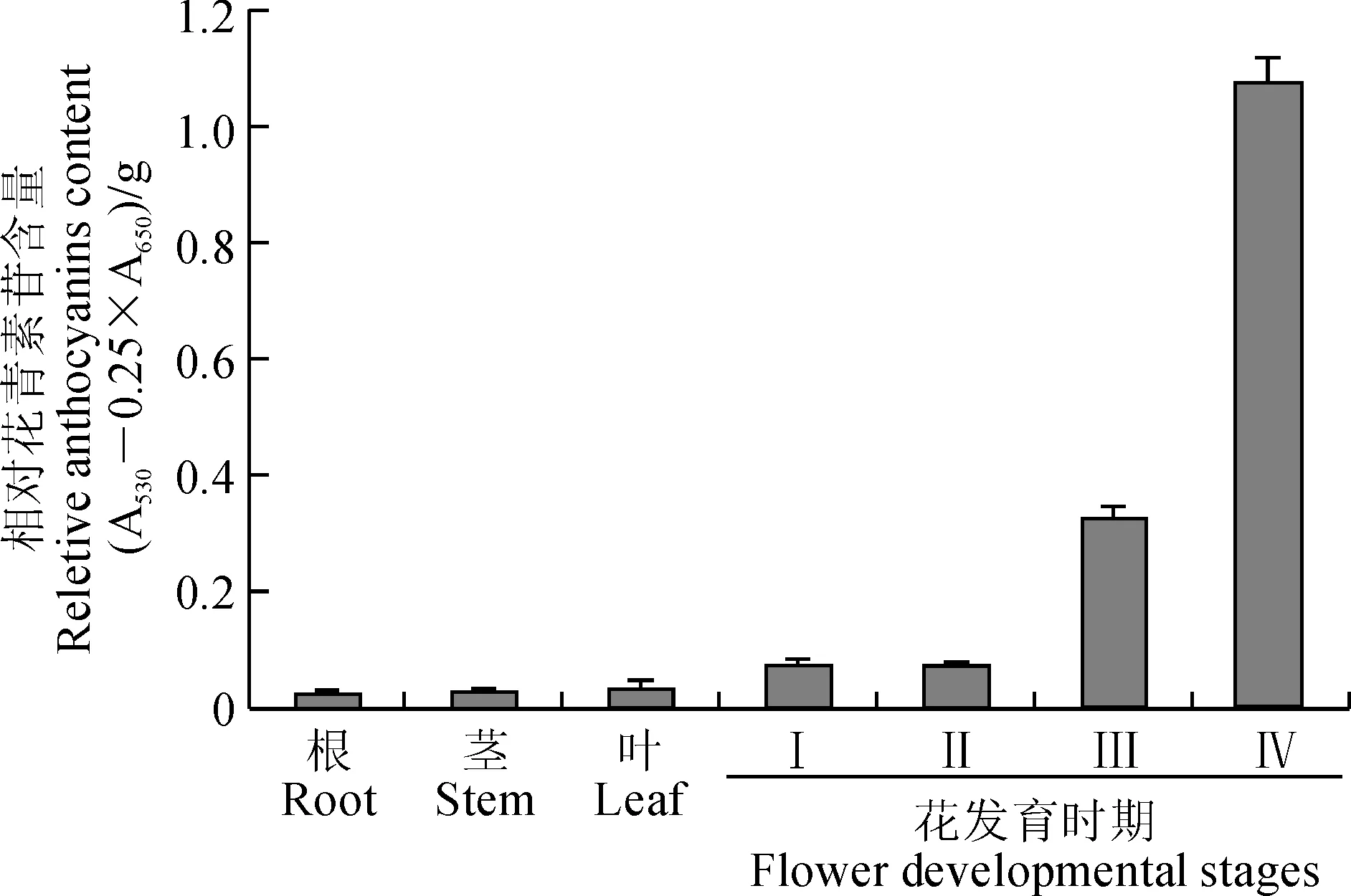
Ⅰ.花芽<1 cm;Ⅱ. 1 cm<花芽<2 cm;Ⅲ. 2 cm<花芽<4 cm; Ⅳ. 盛花期。下同图5 烟草不同组织花青素苷含量分析Ⅰ. flower bud<1 cm;Ⅱ. 1 cm 图6 NtAN9基因在烟草不同组织和花不同发育时期的表达分析Fig. 6 NtAN9 expression pattern analysis in different tobacco tissues and different flower developmental stages 2.4NtAN9基因表达模式分析 对烟草根、茎、叶和4个发育时期的花(Ⅰ、Ⅱ、Ⅲ和Ⅳ)的花青素苷含量分析表明(图5),烟草花青素苷主要存在于花中,在Ⅰ期(花芽<1 cm)和Ⅱ期(1 cm <花芽<2 cm)花中含量较低,当Ⅲ期(2 cm <花芽<4 cm)时含量显著增加,到Ⅳ期(盛花期)时达到最高含量。而在根和其它绿色组织中含量很低。 qRT-PCR分析NtAN9基因在烟草各组织的表达差异发现,在含有花青素苷的4个发育时期的花中具有较高丰度表达,而在不含花青素苷或含量极少的根、茎和叶中表达量很低(图6)。而在花发育的Ⅰ期和Ⅱ期中尽管花青素苷含量较低,但NtAN9基因的表达丰度快速增加,到第Ⅲ期时达到最大表达值,而在花青素苷含量最高的Ⅳ盛花期,表达下降。这一结果说明,NtAN9基因的表达模式与花青素苷积累模式密切相关,也与积累花青素苷的组织的发育相关。 花青素苷的生物合成主要是在细胞质内完成,包括花青素的合成、修饰、转运三个过程,只有当稳定的花青素苷转运并积累至液泡中时才有可能呈色。目前研究表明,植物GST超家族的某些成员直接参与了花青素苷的转运。本研究利用电子克隆策略和RT-PCR方法,从烟草花中分离了与花青素苷转运相关的GST蛋白基因NtAN9。 多序列比对分析表明,NtAN9与已报道的花青素苷转运相关的GST 具有很高的一致性,以及相同的保守结构域与催化位点,其中与同为茄科的矮牵牛PhAN9[4]序列一致性最高达88%。系统进化树分析显示,花青素苷转运相关GST 在物种之间具有高度保守性,NtAN9属于花青素苷转运相关的Phi类型GST,是PhAN9的直系同源基因,提示它们具有相似的功能。 表达模式分析表明,NtAN9的表达主要在积累花青素苷花发育的4个时期中,而在不含花青素苷的其他部位几乎无表达,其表达模式与花青素苷积累模式密切相关。这与已报道的花青素苷转运相关的GST基因的表达模式相符合[1]。如参与花青素苷转运的紫苏PfGST1表达与紫苏不同组织花青素苷积累模式相吻合[6,14],瓜叶菊ScGST3在含花青素苷的品系和组织中高表达,而在不含或含少量花青素苷的品系和组织中几乎不表达[15]。此外,NtAN9的表达与积累花青素苷的组织发育相关,即在花发育早期(Ⅰ至Ⅲ期)表达上升,而在发育后期(Ⅳ盛花期)、完全着色后表达下降,这与矮牵牛PhAN9[4]、仙客来CkmGST3[8],以及ScGST3 在舌状花中的表达结果类似[15]。 上述结果表明,NtAN9编码的GST蛋白可能参与了烟草花青素苷的转运和积累。NtAN9基因的克隆以及表达模式的分析,将为进一步研究其在烟草花呈色中的功能和花青素苷转运奠定基础。 [1]ZHAO J. Flavonoid transport mechanisms: how to go, and with whom[J].TrendsPlantScience, 2015,20 (9): 576-585. [2]张亚真, 张芬, 王丽鸳, 等. 植物谷胱甘肽转移酶在类黄酮累积中的作用[J]. 植物生理学报,2015,51 (11): 1 815-1 820. ZHANG Y Z, ZHANG F, WANG L Y,etal. Plant glutathioneS-transferases: roles in flavonoid accumulation[J].PlantPhysiologyJournal, 2015,51 (11): 1 815-1 820. [3]MARRS K A,ALFENITO M R,LLOYD A M,etal. A glutathione S-transferase involved in vacuolar transfer encoded by the maize geneBronze-2[J].Nature, 1995,375(6 530): 397- 400. [4]ALFENITO M R,SOUER E,GOODMAN C D,etal. Functional complementation of anthocyanin sequestration in the vacuole by widely divergent glutathione S-transferases[J].PlantCell, 1998,10(7): 1 135-1 149. [5]KITAMURA S,SHIKAZONO N,TANAKA A.TRANSPARENTTESTA19 is involved in the accumulation of both anthocyanins and proanthocyanidins inArabidopsis[J].PlantJournal., 2004,37(1): 104-114. [6]YAMAZAKI M,SHIBATA M,NISHIYAMA Y,etal. Differential gene expression profiles of red and green forms ofPerillafrutescenceleading to comprehensive identification of anthocyanin biosynthetic genes[J].FEBSJournal, 2008,275(13): 3 494-3 502. [7]CONN S,CURTIN C,BÉZIER A,etal. Purification,molecular cloning,and characterization of glutathione S-transferases(GSTs)from pigmentedVitisviniferaL. cell suspension cultures as putative anthocyanin transport proteins[J].JournalExp.Bot., 2008,59 (13): 3 621-3 634. [8]KITAMURA S,AKITA Y,ISHIZAKA H,etal. Molecular characterization of an anthocyanin-related glutathione S-transferase gene in cyclamen[J].JournalofPlantPhysiology, 2012,169(6): 636-642. [9]SASAKI N,NISHIZAKI Y,etal. Identification of the glutathione S-transferase gene responsible for flower color intensity in carnations[J].PlantBiotechnology, 2012,29(3): 223-227. [10]HU B,ZHAO J,LAI B,etal.LcGST4 is an anthocyanin-related glutathione S - transferase gene inLitchichinensisSonn[J].PlantCellRep., 2016,35(4):831-843. [11]PATTANAIK S,KONG Q,etal. Isolation and functional characterization of a floral tissue-specific R2R3 MYB regulator from tobacco[J].Planta, 2010,231(5): 1 061-1 076. [12]BAI Y,PATTANAIK S,PATRA B,etal. Flavonoid-related basic helix-loop-helix regulators, NtAn1a and NtAn1b, of tobacco have originated from two ancestors and are functionally active [J].Planta, 2011,234 (2):363-375. [13]ZHU Q,SUI S,LEI X,etal. Ectopic expression of the Coleus R2R3 MYB-Type proanthocyanidin regulator geneSsMYB3 alters the flower color in transgenic tobacco[J].PLoSOne, 2015,10(10):e0139392. [14]YAMAZAKI M,NAKAJIMA J,YAMANASHI M,etal. Metabolomics and differential gene expression in anthocyanin chemo-varietal forms ofPerillafrutescens[J].Phytochemistry, 2003,62(6): 987-995. [15]金雪花,洪艳,等. 瓜叶菊谷胱甘肽转移酶基因GST的分离及表达分析[J]. 园艺学报, 2013,40(6):1 129-1 138. JIN X H, HONG Y,etal. Isolation and expression analysis ofGSTgene encoding glutathione S-transferase fromSeneciocruentus[J].ActaHorticulturaeSinica, 2013,40 (6):1 129-1 138. (编辑:宋亚珍) Isolation and Expression Analysis of an Anthocyanin Transport-relatedNtAN9 Gene fromNicotianatabacum CUI Chaojun, LI Jiamin, CHEN Junyu, ZHANG Runzhao, ZHU Qinlong* (College of Life Sciences, South China Agricultural University, State Key Laboratory for Conservation and Utilization of Subtropical Agro-bioresources, Key Laboratory of Plant Functional Genomics and Biotechnology,Education Department of Guangdong Province, Guangzhou 510642 China) To study anthocyanin transport, we isolated a full-length geneNtAN9 (GenBank Accession No. KX356542) byinsiliconcloning and RT-PCR method fromNicotianatabacum. TheNtAN9 contains a 690 bp open reading frame (ORF) encoding 229 amino acid residues, which belongs to a putative phi class glutathione s-transferase (GST) family. Its genomic structure contains 3 exons and 2 introns. Multiple sequence alignment showed that NtAN9 has highest identities (88%) with petunia PhAN9 that is an anthocyanin transport-related GST. Phylogenetic analysis showed thatNtAN9 was clustered into an anthocyanin transport-related GST group, and was an ortholog ofPhAN11. The anthocyanin content analysis and real-time quantitation PCR (qRT-PCR) showed thatNtAN9 was expressed in different flower developmental stages, with highest level in stage Ⅲ, but almost no expression in root, stem and leaf which are almost no anthocyanin. These results suggest that theNtAN9 function is similar withPhAN9 and might be related to the transfer and accumulation of anthocyanin in tobacco plants. Nicotianatabacum; anthocyanin transport; glutathione s-transferase; gene clone; expression analysis 1000-4025(2016)07-1337-06 10.7606/j.issn.1000-4025.2016.07.1337 2016-06-06;修改稿收到日期:2016-06-18 国家级大学生创新创业训练计划项目(201610564006);广东省公益研究与能力建设项目(2016A020210084) 崔超军(1992-),男,在读本科生,主要从事植物基因工程研究。E-mail: chaojun_cui@163.com 祝钦泷,博士,助理研究员,主要从事植物基因工程研究。E-mail: zhuql@scau.edu.cn Q785; Q786 A
3 讨 论
——矮牵牛

