‘兰箭3号’箭筈豌豆荚果发育动态及腹缝线结构研究
董德珂,董 瑞,王彦荣,聂 斌,刘志鹏
(兰州大学 草地农业科技学院草地农业生态系统国家重点实验室,兰州 730020)
‘兰箭3号’箭筈豌豆荚果发育动态及腹缝线结构研究
董德珂,董瑞,王彦荣,聂斌,刘志鹏*
(兰州大学 草地农业科技学院草地农业生态系统国家重点实验室,兰州 730020)
箭筈豌豆(Viciasativa)是高海拔地区重要的一年生豆科牧草,但荚果成熟时的开裂现象会造成种子的严重损失。该研究以栽培品种‘兰箭3号’为对象,对其荚果在发育过程中的形态特征、水分含量、腹缝线表面结构及腹缝线横截面解剖结构的动态变化进行观察分析,以探讨箭筈豌豆荚果的裂荚机理,为生产中确定种子收获的适宜时间提供理论依据。结果显示:(1)‘兰箭3号’约在盛花后25~30 d荚果变为浅棕色,此时荚果已完成生理成熟,且荚果的大小和干重均达到最大值,含水量降到最小值;盛花后25 d荚果腹缝线出现裂缝,盛花后35 d腹缝线完全裂开。(2)‘兰箭3号’于盛花后20 d腹缝线处离层细胞开始解体;盛花后25 d,内、中、外果皮的薄壁细胞均开始失水皱缩,其中内果皮的薄壁细胞部分已开始破裂,离层细胞及其下面的薄壁细胞完全解体,外部果瓣缘细胞内侧细胞壁破裂,但外侧异常加厚的细胞壁仍然保持完整并连接两个果瓣,使荚果不开裂;盛花后30~35 d,内、中、外果皮的薄壁细胞完全失水,细胞壁皱缩在一起,同时外部果瓣缘细胞外侧细胞壁断裂成两部分,荚果的两个果瓣裂开。研究表明,盛花后25~30 d荚果失去绿色变为浅棕色时是‘兰箭3号’的适宜收获时间,且离层和细胞失水产生的机械拉力是导致箭筈豌豆荚果开裂的主要原因,推测外部果瓣缘细胞外侧增厚融合的细胞壁很可能是‘兰箭3号’抵抗裂荚的关键结构。
箭筈豌豆;‘兰箭3号’;荚果;发育动态;裂荚;适宜收获时间;腹缝线
箭筈豌豆(Vicia.sativa)是豆科(Leguminosae)野豌豆属(ViciaLinn.)一年生闭花授粉植物,普遍种植于中国的长江中下游、华北和西北等地区[1]。箭筈豌豆具有适应性广、抗寒性强、营养价值高、经济效益好等特点,是中国高海拔地区重要的牧草和绿肥作物,在中国草地农业系统中发挥着不可替代的作用[2-5]。南志标等通过在青藏高原地区引种野豌豆属(Viciaspp.)和山黛豆属(Lathyrusspp.),于2011年成功培育了适宜在高寒和高海拔地区种植的国家级牧草新品种‘兰箭3号’,其具有早熟、生育期短、抗寒性强、种子产量高等特点,是中国高海拔地区的反刍动物的优质蛋白粗饲料[2,6]。
裂荚现象普遍存在于豆科植物中,对其种子生产造成巨大的损失[7,8]。确定种子适宜的收获时间,减免裂荚的发生,可一定幅度上提高种子产量[9]。因此从19世纪60年代起一些研究者开始致力于种子适宜收获时间的研究,避免收获时间不当带来的损失[10]。不同物种种子适宜收获时间不同,研究方法也有很多。总体来说,荚果和种子的生长发育天数[11,12]、形态特征[12,13]和生理指标[12,14,15]等是种子适宜收获确定的主要依据。
裂荚与荚果本身的组织结构有着密切联系,在自然或物理机械压力下,造成了荚果的某一位点开裂[9]。腹缝线是心皮边缘闭合卷曲发育而来的,荚果首先沿着心皮愈合处的腹缝线开裂,然后由于机械扭曲力的作用使得背缝线开裂,因此腹缝线是荚果开裂的起始部位[16]。已有的对荚果解剖结构的研究发现离层、内果皮的内厚壁组织、中果皮的木质化细胞以及维管束等是荚果开裂及抗裂荚的重要结构[17-19]。在大豆裂荚的最新研究中发现,果荚开裂抗性的关键结构是腹缝线处位于离层细胞上方的纤维帽细胞,纤维帽细胞由细胞壁过度加厚的薄壁细胞组成,可以抵抗由离层细胞释放的水解酶的作用,使其具有一定的裂荚抗性[19]。不同物种的荚果微观结构不同,裂荚机理也就不同,目前裂荚区微观结构的观察在拟南芥[20-22]、大豆[19,23]、油菜[24,25]等模式植物和作物中相对较成熟,但在箭筈豌豆等重要豆科牧草中尚未有报道。本研究对‘兰箭3号’箭筈豌豆各发育时期的荚果腹缝线进行解剖结构观察,试图找到与裂荚抗性相关的结构,为进一步研究箭筈豌豆的裂荚机理奠定基础。
1 材料和方法
1.1实验材料
本实验所用材料‘兰箭3号’均由草地农业生态系统国家重点实验室提供。
1.2试验设计
试验地点设于兰州大学草地农业科技学院榆中试验田(35.57°N,104.09°E)。选取正常饱满的种子种植于1 m × 20 m的小区,单行单株种植,株距20 cm,3次重复,其它条件相同。盛花期标记刚刚开放的花朵(以旗瓣还未展开为刚刚开放,如图1盛花后第0天所示)。
1.3取样与处理
盛花期标记的花朵,每5 d取样1次,直至盛花后35 d。每个小区每次随机取10个发育正常的荚果,用于荚果和种子的形态学和生理学特征观察与分析。另外,每个小区随机取若干个发育正常的荚果放入FAA固定液(70%乙醇∶冰乙酸∶甲醛=9∶0.5∶0.5)中,4 ℃冰箱中保存,用于电镜扫描和半薄切片制备。
1.4荚果形态学特征
将各时期取样的荚果,放置比例尺,用数码相机拍照,随后用Digimizer4.2图像分析软件对扫描图像进行分析,测量荚果长、宽和厚,精确到0.01 mm。
1.5种子和荚果的生理学特征
将各时期取样的荚果,分离荚皮和种子。用电子天平分别称量每个荚果的荚皮和种子的鲜重,精确到0.001 g,并计算平均值。将荚皮和种子在80 ℃下烘干至恒重并称量,精确到0.001 g,分别计算平均值和含水量。
含水量=鲜重-干重
1.6腹缝线表面结构扫描电镜观察
从FAA固定液中,取出各时期取样的荚果,截取腹缝线中间的一段(约3 mm),利用JSM-5600扫描电镜进行观察,获取扫描图像。
1.7腹缝线横截面解剖结构观察
从FAA固定液中,取出各时期取样的荚果,截取腹缝线中间的一段(约3 mm),70%(1 h)、80%(1 h)95%(1 h)、95%(1 h)、100%(1 h)、100%(1 h)、100%(1 h)乙醇梯度脱水,100%(1 h)、100%(1 h)二甲苯置换,预渗透液(Technovit 9100预渗透液∶二甲苯=1∶1)处理(1 h),用Technovit 9100预渗透液进行预渗透(24 h),Technovit 9100渗透液进行渗透(72 h),Technovit 9100混合液(A液∶B液=9∶1)包埋材料,放入4 ℃冰箱过夜。利用Leica RM2235手动旋转式半薄切片机进行切片,厚度为2 μm,甲苯胺蓝染色,再用电脑成像系统照相。
1.8数据分析
Excel 2016分析各时期荚果的长、宽、厚的平均值,各时期荚果和种子的鲜重、干重的平均值和其含水量,并用Origin软件进行作图。
2 结果与分析
2.1荚果的形态学特征
‘兰箭3号’荚果的颜色随生长时间的推移而发生显著的变化(图1)。在荚果生长发育的早期,盛花后0~20 d的荚果颜色为绿色;随着荚果的进一步发育,盛花后25 d荚果颜色变为棕绿色;盛花后30~35 d荚果失去绿色,变为浅棕色。浅棕色是‘兰箭3号’荚果成熟的颜色。
‘兰箭3号’荚果的长、宽和厚在荚果发育过程中的变化如图2所示。盛花后0~10 d是荚果长度和宽度的迅速生长期,于盛花后10 d左右达到最大值,此段时间荚果厚度生长相对较缓慢;盛花后10~20 d荚果厚度迅速增长,于盛花后20 d左右达到最大值,荚果厚度增加的原因是种子的生长,表明这段时间种子在迅速生长;盛花后20~35 d荚果宽度和厚度略有减小,是细胞失水皱缩造成的。
2.2荚果中荚皮和种子的生理学特征
‘兰箭3号’荚果中荚皮的鲜重、干重和含水量随其生长时间有明显的变化(图3)。荚皮的鲜重和含水量的变化趋势一致,盛花后5~10 d迅速增加,随后增速变缓,盛花后20 d左右达到最大值,盛花后20~30 d迅速减小,盛花后30~35 d两者都基本不再发生变化;荚皮干重在盛花后0~20 d呈逐渐增加的趋势,20 d左右达到最大值。
‘兰箭3号’荚果中种子的鲜重、干重和含水量随生长时间的变化如图4所示。种子的鲜重和含水量的变化也基本保持一致,盛花后5~20 d迅速增加,盛花后20~30 d迅速减小,盛花后30~35 d基本保持不变;种子的干重在盛花后5~15 d缓慢增加,盛花后15~20 d迅速增加,盛花后20~30 d缓慢增加,盛花后30 d左右达到最大值。

d表示盛花后天数图1 ‘兰箭3号’荚果发育过程中荚果的颜色d represents days after peak anthesisFig. 1 Pod color during pod development of Lanjian NO.3

图2 ‘兰箭3号’荚果发育过程中的荚果的长度、宽度和厚度Fig. 2 Pod length, width and thickness during pod development of Lanjian NO.3
2.3荚果腹缝线表面结构的扫描电镜观察
‘兰箭3号’荚果腹缝线的表面结构如图5所示。随着荚果的生长发育,表皮毛变疏,盛花后10~15 d在腹缝线中间长出一个凸起的结构(图5,B、C),盛花后20~35 d凸起平展(图5,D~F)。盛花后5~20 d腹缝线中间结构完整,没有开裂迹象(图5,A~D);盛花后25 d荚果沿着腹缝线中间开始裂开,并向两边延伸(图5,E);盛花后30 d,腹缝线中间大部分已经裂开(图5,F);盛花后35 d腹缝线中间已经完全开裂(图5,G)。
2.4腹缝线横截面的半薄切片观察
‘兰箭3号’荚果发育过程中腹缝线横截面的微观结构如图6所示。盛花后5 d,荚果的两个果瓣中间尚未分开,中果皮和内果皮有很小的厚壁细胞(图6,A)。盛花后10 d,荚果两个果瓣中间分开形成空腔,为种子发育提供空间,内果皮的厚壁细胞发育形成内厚壁组织;中果皮的厚壁细胞发育形成两个分开的维管束,分别嵌入两个果瓣中;两个果瓣连接处的果瓣缘细胞分化形成离层细胞,与两个维管束共同形成了一个帽子状的结构;外部果瓣缘细胞外侧的细胞壁明显增厚,并相互融合在一起(图6,B)。盛花后15 d,荚果微管束和内厚壁组织的细胞逐渐增多变大,细胞壁逐渐增厚;且维管束上端逐渐向外果皮延伸(图6,C)。盛花后20 d,夹在两个维管束之间的离层细胞开始解体(图6,D、H)。盛花后25 d,内、中、外三个果皮的细胞开始失水皱缩,内果皮的薄壁细胞已经有一部分开始破裂;离层细胞及其下面的薄壁细胞完全解体;外部果瓣缘细胞内侧细胞壁破裂,但是外侧异常加厚的细胞壁仍然保持完整,连接两个果瓣,使荚果不开裂(图6,E)。盛花后30~35 d,荚果的两个果瓣裂开,外部果瓣缘细胞外侧细胞壁断裂成两部分;内果皮的薄壁细胞大部分完全破裂,靠近内厚壁组织的薄壁细胞的细胞壁皱缩在一起;并且外果皮和中果皮细胞完全失水,细胞壁皱缩在一起。
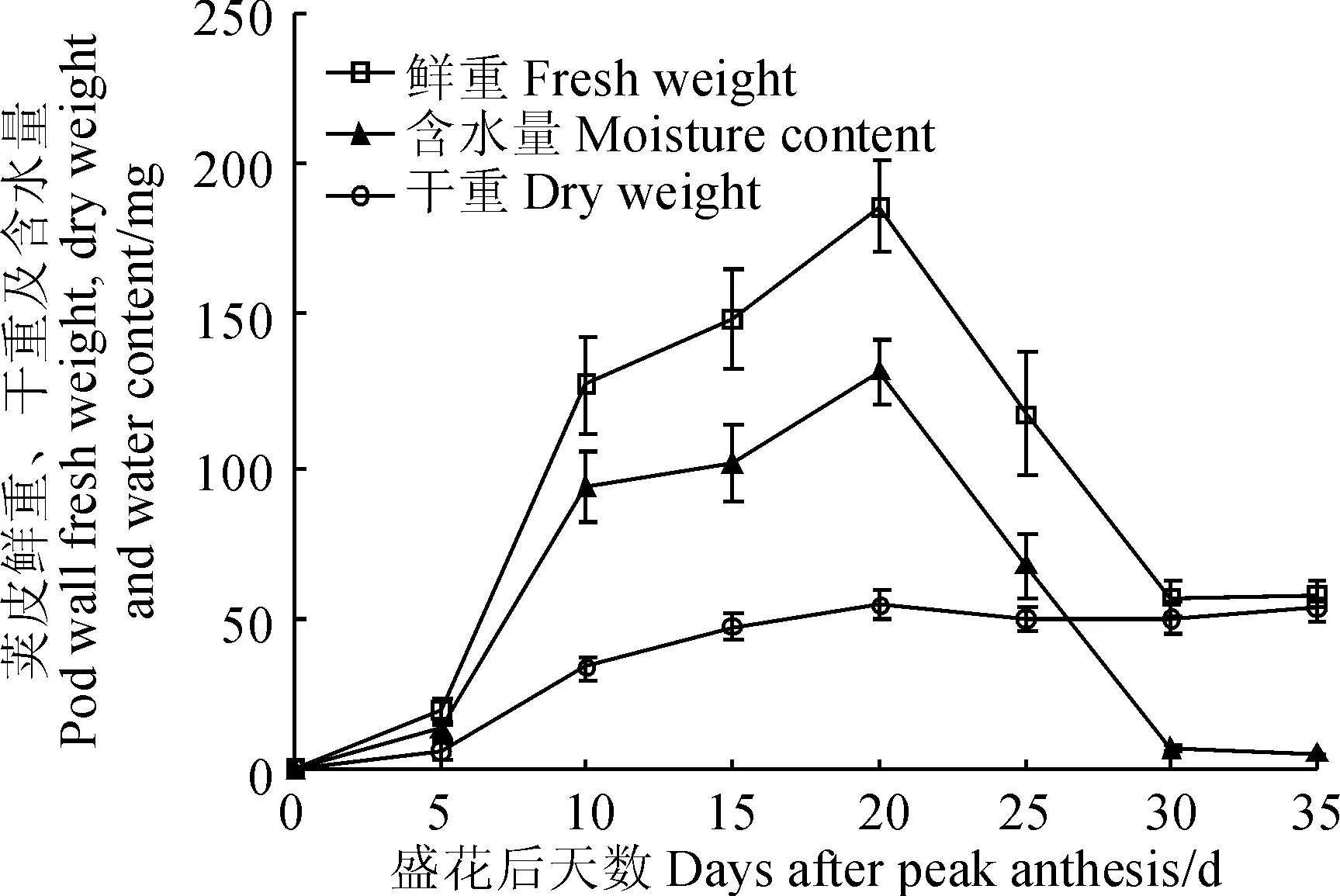
图3 ‘兰箭3号’荚果发育过程中荚皮的鲜重、干重和含水量Fig. 3 Pod wall fresh weight, dry weight and moisture content during pod development of Lanjian NO.3
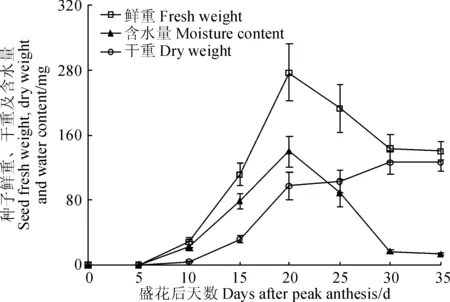
图4 ‘兰箭3号’荚果发育过程中种子的鲜重、干重和含水量Fig. 4 Seed fresh weight, dry weight and moisture content during pod development of Lanjian NO.3
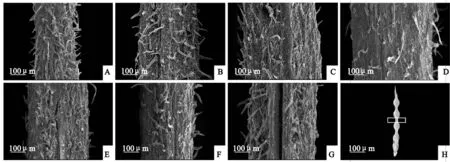
A~G. 盛花后5、10、15、20、25、30、35 d;H. 白框位置为取样部位图5 ‘兰箭3号’荚果发育过程中荚果腹缝线的扫描电镜图片A~G. 5, 10, 15, 20, 25, 30 and 35 days after peak anthesis; H. The location of white frame is the sampling siteFig. 5 Scanning electron microscope pictures of pod ventral suture during pod development of Lanjian NO.3
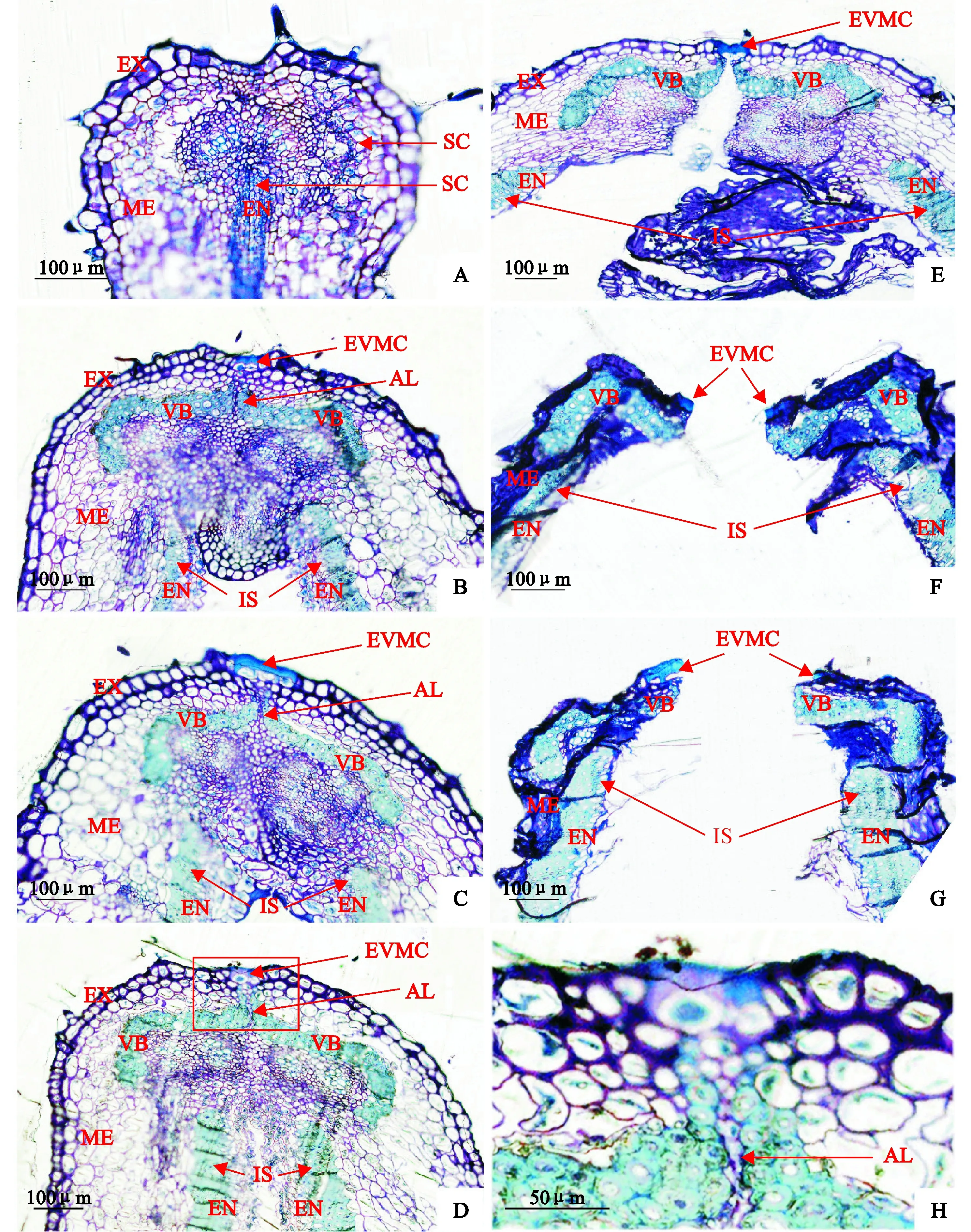
A~G. 盛花后5、10、15、20、25、30、35 d;H. D图中红框部分的放大图像SC. 厚壁细胞;EVMC. 外部果瓣缘细胞;IS. 内厚壁组织;AL. 离层;VB. 维管束;EX. 外果皮;ME. 中果皮;EN. 内果皮图6 ‘兰箭3号’荚果发育过程中荚果腹缝线横截面的半薄切片A~G. 5, 10, 15, 20, 25, 30 and 35 days after peak anthesis; H. Enlarged image of the red frame section in picture D.SC. Sclerenchymatous cells; EVMC. External valve margin cells; IS. Inner sclerenchyma; AL. Abscission layer; VB. Vascular bundle;EX. Exocarp; ME. Mesocarp; EN. EndocarpFig. 6 Semi-thin slices of pod ventral suture cross-section during pod development of Lanjian NO.3
3 讨 论
裂荚对植物体本身来说是生命过程中重要的生理现象,对物种的繁殖和传播有重要的生物学意义,但是在豆科牧草种子生产中,裂荚后的种子脱落会给农民带来严重的损失[17]。过早收获会导致种子成熟度差、活力低、质量差,过晚收获又会造成种子的严重损失,因此适宜收获间的确定可以有效减免因提前收获和裂荚带来的损失[10]。种子含水量是种子生理成熟和收获时间的精确判断指标[12]。本实验通过对‘兰箭3号’箭筈豌豆荚果发育动态的研究,发现盛花后25~30 d荚果失去绿色变为浅棕色时,荚果大小和干重不再发生明显变化,荚皮和种子的含水量达到最低,表明此时‘兰箭3号’的种子已经完成了生理成熟,且对裂荚起始部位腹缝线微观结构的观察也发现此时荚果已经出现开裂迹象,因此推断盛花后25~30 d荚果失去绿色变为浅棕色时是‘兰箭3号’种子的适宜收获时间。本研究将发育动态与微观结构联系起来,使收获时间的确定更加可靠,对‘兰箭3号’种子生产具有重要的参考价值和实际指导意义。
离层和细胞失水产生的机械拉力是导致箭筈豌豆荚果开裂的主要原因。离层是荚果开裂不可或缺的结构[17]。本研究发现,‘兰箭3号’荚果的离层是发育完全且有功能的,离层位于果瓣连接处,由非木质化的薄壁细胞组成的一条很窄的细胞带。盛花后20 d荚果大小和荚皮含水量、干重已经达到最大(图2、3),此时离层细胞开始发挥作用,释放水解酶,溶解细胞壁使细胞解体,是荚果开裂的起始开关。荚果发育后期,细胞失水产生的机械力是导致荚果开裂的另一个重要原因[17]。本研究中,盛花后25 d荚皮细胞失水(图3),把果瓣缘细胞向两个方向拉扯,果瓣缘细胞属于薄壁细胞,当其承受不了拉力时就会破裂,导致荚果开裂。值得注意的是起初内果皮失水最为严重,因而对内侧的薄壁细胞拉力较大,推测可能是导致荚果先从内部开裂的原因。
内果皮的内厚壁组织和中果皮的维管束是分担由细胞失水产生的机械力的重要结构。内果皮的内厚壁组织以及维管束由厚壁细胞组成,厚壁细胞的细胞壁由胞间层、初生壁和次生壁构成,起支撑作用。在细胞失水的过程中,内、中、外三个果皮的薄壁细胞纷纷失水皱缩,而内厚壁组织和维管束细胞仍然保持稳定的结构,分担了大部分的机械拉力,是抵抗裂荚的重要结构。但是这些结构在大豆[19]、拟南芥[26]等其他豆科植物中也同样存在,并不是箭筈豌豆所独有的结构。百脉根属的荚果解剖结构发现,抗裂荚品种朝着中果皮木质化程度减小的方向发展[27]。本研究发现,箭筈豌豆的荚果的中果皮并没有木质化的趋势,也是其抗裂荚的一个原因。
在腹缝线的电镜扫描图像中,盛花后10~15 d出现了一个表面较为光滑的凸起结构(图5,B、C),且半薄切片的结果显示盛花后10~15 d外部果瓣缘细胞外侧细胞壁融合并剧烈加厚,融合后的细胞表面较为光滑(图6,B、C),因此推断该凸起结构即为外部果瓣缘细胞外侧细胞壁异常加厚产生的。随后荚皮失水,在内部拉力的作用下,果瓣缘细胞被向内拉伸,凸起逐渐展平,但细胞壁的厚度并没有受到影响。从凸起的幅度可以看出该结构对腹缝线具有很大的保护作用,可在一定程度上抵抗裂荚的发生,同时盛花后25 d两个果瓣仅靠外部果瓣缘细胞外侧增厚融合的细胞壁连接,推测该结构很可能是箭筈豌豆抵抗裂荚的关键结构。
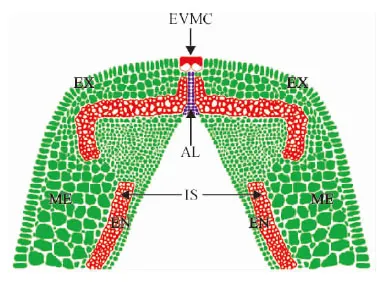
EVMC. 外部果瓣缘细胞;AL. 离层;VB. 维管束;IS. 内厚壁组织;EX. 外果皮;ME. 中果皮;EN. 内果皮图7 箭筈豌豆腹缝线横截面解剖结构示意图EVMC. Extemal value margin cells; AL. Abscission layer; VB. Vascular bundle; IS. Inner sclerenchyma; EX. Exocarp mesocarp; ME. Mesocarp; EN. EndocarpFig. 7 Anatomical structure diagram of V. sativa pod ventral suture cross-section
根据‘兰箭3号’各时期腹缝线横切面的半薄切片观察,绘制箭筈豌豆腹缝线横切面的解剖结构示意图(图7),以便于对箭筈豌豆的解剖结构进行观察和分析。在大豆裂荚的最新研究进展中指出,离层上方细胞壁过度增厚的纤维帽细胞是栽培大豆具有裂荚抗性的主要原因[19],但是箭筈豌豆的离层上方中并没有发现细胞壁过度增厚的纤维帽细胞,取而代之的是外侧细胞壁增厚融合的外部果瓣缘细胞。对比栽培大豆的解剖结构示意图[26],可以发现箭筈豌豆的外侧果瓣缘细胞与大豆的纤维帽细胞在位置上都处于离层上方且都与外部空气相接触,结构上都有过度增厚的细胞壁,功能上都是抵抗离层细胞释放的水解酶的作用,牢固连接两个果瓣使荚果不开裂,因此推测它们具有一定的同源性,但需要借助分子手段等进一步验证。该研究结果为进一步探讨箭筈豌豆的裂荚机理提供了解剖结构基础,有望在裂荚抗性的研究方面取得新的研究进展。
[1]陈默君, 贾慎修. 中国饲用植物[M]. 北京:中国农业出版社, 2002: 673-675.
[2]南志标,张吉宇,等.5个箭筈豌豆品系基因型与环境互作效应及农艺性状稳定性[J].生态学报,2004,24(3):395-401.
NAN Z B, ZHANG J Y,etal.Genotype×environment interactions and consistency analysis for agronomic characteristics of fiveViciasativalines[J].ActaEcologicaSinica, 2004,24(3):395-401.
[3]董德珂,董瑞,刘志鹏,等.532份箭筈豌豆种质资源复叶表型多样性[J].草业科学,2015,36(2):536-541.
DONG D K ,DONG R ,LIU Z P ,etal.Diversity analysis of the compound leaf phenotypic characters of 532Viciasativagermplasm resources[J].PrataculturalScience, 2015,36(2):536-541.
[4]LIU Z P, LIU P, LUO D,etal. Exploiting illumina sequencing for the development of 95 novel polymorphic EST-SSR markers in common vetch (Viciasativasubsp.sativa)[J].Molecules, 2014, 19(5): 5 777-5 789.
[5]LIU Z P, MA L C, NAN Z B,etal. Comparative transcriptional profiling provides insights into the evolution and development of the zygomorphic flower ofViciasativa(Papilionoideae)[J].PloSONE, 2013, 8(2): e57338.
[6]刘鹏,马利超,王宇,等.野豌豆属牧草种质花粉形态的扫描电镜观察[J].草业科学,2015,32(6):978-987.
LIU P ,MA L C ,WANG Y ,etal.Observation on pollen morphology ofViciagermplasms using scanning electron microscope[J].PrataculturalScience, 2015,32(6):978-987.
[7]PHILBROOK B D, OPLINGER E S. Soybean field losses as influenced by harvest delays[J].AgronomyJournal, 1989, 81(2): 251-258.
[8]张跃进,马赛斐,高启云,等.黄淮流域主栽大豆品种炸荚性研究[J].河南农业科学,2006(6):56-59.
ZHANG Y J ,MA S F ,GAO Q Y ,etal.Study on the pod-shattering of main soybean varieties of Huanghuai area[J].JournalofHenanAgriculturalScience, 2006,(6):56-59.
[9]孙东凤,康玉凡.大豆炸荚性研究进展[J].大豆科学,2011,(6):1 030-1 034.
SUN D F ,KANG Y F .Advances in studies of pod-shattering of soybean[J].SoybeanScience,2011,(6):1 030-1 034.
[10]王颖. 广布野豌豆荚果和种子发育动态及种子适宜收获时间的确定[D].长春:东北师范大学, 2008.
[11]毛培胜,韩建国,吴喜才.收获时间对老芒麦种子产量的影响[J].草地学报,2003,1(11):33-37.
MAO P S ,HAN J G ,WU X C .Effects of harvest time on seed yield of siberian wildrye[J].ActaAgrestiaSinica, 2003,1(11):33-37.
[12]ELIAS S G, COPELAND L O. Physiological and harvest maturity of canola in relation to seed quality[J].AgronomyJournal, 2001, 93: 1 054-1 058.
[13]EASTIN J D, HULTQUIST J H,etal. Physiologic maturity in grain sorghum[J].CropScience, 1973, 13: 175-178.
[14]FRASER J, EGLI D B, LEGGETT J E. Pod and seed development in soybean cultivars with differences in seed size[J].AgronomyJournal, 1982, 74: 81-85.
[15]WANG P, ZHOU D W,etal. Seed maturity and harvest time effects seed quantity and quality of HORDEUM BREVISUBULATUM[J].SeedScienceTechnology, 2006, 34: 125-132.
[16]SUZUKI M, FUJINO K,etal. A major soybean QTL,qPDH1, controls pod dehiscence without marked morphological change[J].PlantProductionScience, 2009, 12(2): 217-223.
[17]罗汝叶,巩鹏涛.植物落粒性状研究进展[J].豆科基因组学与遗传学,2011,2(1):1-13.
LUO R Y ,GONG P T .Research progress of seed-shattering habit in plants[J].LegumeGenomicsandGenetics,2011,2(1):1-13.
[18]罗栋,王彦荣,刘志鹏.豆科植物裂荚生物学基础的研究进展[J].草地学报,2015,23(5):927-935.
LUO D ,WANG Y R ,LIU Z P .Research progress in biological basis of legume pod dehiscence[J].ActaAgrestiaSinica,2015,23(5):927-935.
[19]DONG Y, YANG X, LIU J,etal. Pod shattering resistance associated with domestication is mediated by a NAC gene in soybean[J].NatureCommunications, 2015, 5(2): 3 352-3 352.
[20]DINNENY J R, DETLEF W, YANOFSKY M F. A genetic framework for fruit patterning inArabidopsisthaliana[J].Development, 2005, 132(21): 4 687-4 696.
[22]CAROL W, YANG T J W,etal. A molecular and structural characterization of senescingArabidopsissiliques and comparison of transcriptional profiles with senescing petals and leaves[J].PlantJournal, 2009, 57(4): 690-705.
[24]KADKOL G P, BEILHARZ V C,etal. Anatomical basis of shatter-resistance in the oilseed brassicas[J].AustralianJournalofBotany, 1986, 34(34): 595-601.
[25]CHILD R D, BRUCE D M. Increased resistance to pod shatter is associated with changes in the vascular structure in pods of a resynthesizedBrassicanapusline[J].JournalofExperimentalBotany, 2003, 54(389): 1 919-1 930.
[26]DONG Y, WANG Y Z. Seed shattering: from models to crops[J].FrontiersinPlantScience, 2015, 6: 476.
[27]YANG J B, SOMERS D A, WRIGHT R L,etal. Seed pod dehiscence in birdsfoot trefoil,Lotusconimbricensis, and their interspecific somatic hybrid[J].CanadianJournalofPlantScience, 1990, 70(1): 279-284.
(编辑:潘新社)
Study on Pod Development and Ventral Suture Structure ofViciasativaCultivar Lanjian NO.3
DONG Deke, DONG Rui, WANG Yanrong, NIE Bin, LIU Zhipeng*
(College of Pastoral Agriculture Science and Technology, Key Laboratory of Grassland Farming Systems, Lanzhou University, Lanzhou 730020, China)
The common vetch (Viciasativa) is an important annual legume forage at high altitudes. However, the phenomenon of pod shattering when it matured would casue serious loss of seeds. WithV.sativacultivar Lanjian NO.3 as the research object, this study analyzed dynamic changes in pod morphological, moisture content, surface structure of ventral suture, anatomical structure of ventral suture cross section during pod development in order to explore the pod shattering mechanism ofV.sativaand provide theoretical basis for determining its optimal seed harvesting time in production. The results showed that: (1) When the pod of Lanjian NO.3 turned to light brown at about 25-30 days after peak anthesis, it had completed physiological maturity and its size and dry weight had reached the highest with the moisture content had reduced to the lowest. A crack appeared in the pod ventral suture at 25 days after peak anthesis and it separated completely at 35 days after peak anthesis. (2) The abscission layer cells began to disintegrate at 20 days after peak anthesis. At 25 days after peak anthesis, all the parenchyma cells of endocarp, mesocarp and exocarp began to lose water and shrink wherein the portion of endocarp parenchyma cells began to break. The abscission layer cells and the following parenchyma cells disintegrated completely. The inside cell walls of external valve margin cells broke but the outside cell walls which abnormal thickened still remained intact and connected two fruit valves which made the pod do not crack. During the period from 25 to 30 days after peak anthesis, the parenchyma cells of endocarp, mesocarp and exocarp lost water completely and their cell walls shrank together. At the same time the outside cell walls of external valve margin cells broke into two parts and the two fruit valves of the pod cracked. The research shows that the optimal harvest time of Lanjian NO.3 seeds was the period from 25 to 30 days after peak anthesis when the pod turned to light brown. The abscission layer cells and machine tensile which generated by cell water loss were the main causes ofV.sativapod crack. Conjecture that the thickening and fused cell walls of external valve margin cells were the key structure resistant to pod shattering probably.
V.sativa; Lanjian NO.3; pod; development dynamic; pod shattering; optimum harvest time; ventral suture
1000-4025(2016)07-1376-07
10.7606/j.issn.1000-4025.2016.07.1376
2016-01-30;修改稿收到日期:2016-07-12
国家重点基础研究发展计划(973计划)(2014CB138704)
董德珂(1991-),在读硕士研究生,主要从事草类作物遗传育种研究。E-mail:dongdk10@lzu.edu.cn
刘志鹏,教授,博士生导师,主要从事牧草种质资源与育种研究。E-mail:lzp@lzu.edu.cn
Q944.59
A

